CD4+/CD8+T淋巴细胞在肝细胞癌组织中的浸润及与预后的相关性研究
钟鉴宏 向骁 覃宏贵 游雪梅 马良 吴飞翔 向邦德 袁卫平 黎乐群,3
作者单位:530021 南宁 1广西医科大学附属肿瘤医院肝胆外科;2广西肝癌诊疗工程技术研究中心;3区域性高发肿瘤早期防治研究教育部重点实验室
临床研究
CD4+/CD8+T淋巴细胞在肝细胞癌组织中的浸润及与预后的相关性研究
钟鉴宏1,2向骁1,2覃宏贵1,2游雪梅1,2马良1,2吴飞翔1,2向邦德1,2袁卫平1,2黎乐群1,2,3
作者单位:530021 南宁1广西医科大学附属肿瘤医院肝胆外科;2广西肝癌诊疗工程技术研究中心;3区域性高发肿瘤早期防治研究教育部重点实验室
目的检测CD4+/CD8+T淋巴细胞在肝细胞癌(hepatocellular carcinoma,HCC)组织中的浸润程度,并分析其与预后的相关性。方法收集行肝切除术的HCC患者215例,采用免疫组化技术检测CD4+/CD8+T淋巴细胞在HCC癌组织中的浸润程度,根据浸润情况比较患者肝切除术后无瘤生存率和总生存率。结果CD4+T淋巴细胞高浸润和低浸润比例分别为60.9%和39.1%。CD4+T淋巴细胞高浸润组患者总生存率和无瘤生存率均显著高于低浸润组(P=0.015,P=0.038)。CD8+T淋巴细胞高浸润和低浸润比例分别为34.9%和65.1%。CD8+T淋巴细胞高浸润组患者的总生存率和无瘤生存率亦显著高于低浸润组患者(P=0.033,P=0.047)。结论CD4+或CD8+T淋巴细胞低浸润可能与HCC患者术后不良预后相关。
肝肿瘤;CD4+T淋巴细胞;CD8+T淋巴细胞;总生存率;预后
肝细胞癌(hepatocellular carcinoma,HCC)恶性程度高,预后较差[1-2]。复发是HCC患者术后死亡的主要原因[3]。因此,寻找影响HCC复发的风险因素有重要意义。癌灶和癌旁的适应性免疫细胞参与形成肿瘤免疫微环境。有研究显示,T细胞的侧群细胞(如CD4+和CD8+T淋巴细胞)浸润与结直肠癌患者术后复发率和总生存率相关[4],癌组织CD4+和CD8+T淋巴细胞高浸润的患者预后更佳[4-5]。但在HCC研究领域,此类研究报道较少。本研究收集接受肝切除术HCC患者的临床资料,采用免疫组化法分析癌组织中CD4+和CD8+T淋巴细胞的浸润水平,探讨其与HCC患者预后的相关性,现报道如下。
1 材料与方法
1.1一般资料
收集2011年1月至2013年6月在广西医科大学附属肿瘤医院首次行肝切除术治疗的HCC患者资料[6],所有患者均经术后病理学确诊。纳入标准:⑴癌和癌旁蜡块匹配于同一患者;⑵临床病理基线资料完整;⑶术后至少有一次随访记录;⑷术前未接受针对 HCC治疗;⑸HBsAg(+)。排除标准:⑴复发性HCC;⑵HCV抗体(+)。HCC术后或肿瘤复发后采取的任何治疗方式不影响本研究的纳入和排除标准。本研究经我院伦理委员会通过,所有患者知情同意。
1.2 免疫组化方法和判定标准
10%浓度甲醛固定标本,石蜡常规包埋。免疫组化实验方法详见文献[7]。参考文献[8],并根据CD4+和CD8+T淋巴细胞受体蛋白染色强度范围的不同进行评分:从低浸润到高浸润分为score 0+、score 1+、score 2+和score 3+。score 0+和score 1+归为低浸润;score 2+和score 3+归为高浸润。细胞β连环蛋白表达小于10%表示1+、10%~50%表示2+、>50%表示3+。
1.3 观察指标
肝切除术操作方法详见文献[9-10],围手术管理如文献[11]描述。患者出院后每3个月电话随访1次,内容包括患者一般情况、出院后治疗情况(包括到其他医院进行治疗)、疾病复发与否等。术后定期复查甲胎蛋白、乙肝两对半、血常规、肝功能、肾功能、凝血酶原时间、胸部X线、腹部B超、腹部CT或MRI,复查频率遵循我国HCC诊疗规范——《原发性肝癌诊疗规范(2011年版)》[12]。随访终点包括因HCC复发或相关并发症死亡,随访截至2016年8月。
1.4 统计学处理
采用IBM SPSS Statistics 21.0软件对数据进行统计分析。非正态分布的定量资料用中位数(四分位数间距)M(QR)描述。分类变量率或构成比比较采用χ2检验或Fisher确切概率法。生存率用Kaplan-Meier法估计,组间差异比较行log-rank检验。多因素分析采用Cox比例风险回归模型。以P<0.05为差异有统计学意义。
2 结果
2.1 纳入情况
2011年1 月至2013年6月我院共实施肝切除术686例,其中混合型肝癌18例,肝内胆管癌13例,肝肉瘤和肝腺瘤各2例;接受多次肝切除术34例;术前接受针对HCC治疗(经肝动脉化疗栓塞或放疗)32例,术后无随访记录85例,HCV抗体(+)3例;癌和癌旁石蜡缺失12例;癌或癌旁石蜡缺失(即资料不完整)270例。最终215例符合本研究纳入标准。
2.2 纳入研究患者一般特点和预后分析
纳入研究的215例HCC患者中,男性191例,女性24例;年龄≥60岁78例,<60岁137例,中位年龄46岁(19~71岁);67.9%患者合并肝硬化,93%的患者肝功能Child-Pugh A级;根据巴塞罗那临床肝癌分期(Barcelona clinical liver cancer,BCLC)0/A 期占60%,B期占19%,C期占21%;其他基线资料见表1。截至2016年8月,共87例患者死亡,中位生存期为51个月,1年、2年、3年、4年累积总生存率分别为92%、82%、73%、50%(图1A);174例患者出现肿瘤复发,中位无瘤生存期为24个月,1年、2年、3年、4年累积无瘤生存率分别为66%、47%、26%、15%(图1B)。
2.3 CD4+和CD8+T淋巴细胞的浸润水平与临床病理特征及预后的关系
215 例HCC癌组织免疫组化结果分析显示,CD4+T淋巴细胞高浸润和低浸润的比例分别为60.9%和39.1%,免疫组化结果见图2。CD4+T淋巴细胞低浸润与大肿瘤、微血管侵犯、肿瘤包膜不完整、术前甲胎蛋白≥400 ng/mL、术后1个月甲胎蛋白≥400 ng/mL、Edmondson-Steiner分级Ⅲ/Ⅳ级、BCLC-C期和肿瘤复发相关。见表1。
在总生存率方面,CD4+T淋巴细胞低浸润的风险比为1.782(95%CI 1.121~2.833);无瘤生存率CD4+T淋巴细胞低浸润的风险比为1.399(95%CI 1.018~1.921)。CD4+T淋巴细胞高浸润组患者总生存率和无瘤生存率均显著高于低浸润组(P=0.015,P=0.038)。见图3。

表1 HCC癌组织CD4+、CD8+T淋巴细胞的浸润水平与患者临床病理特征的关系(n)

(续表)
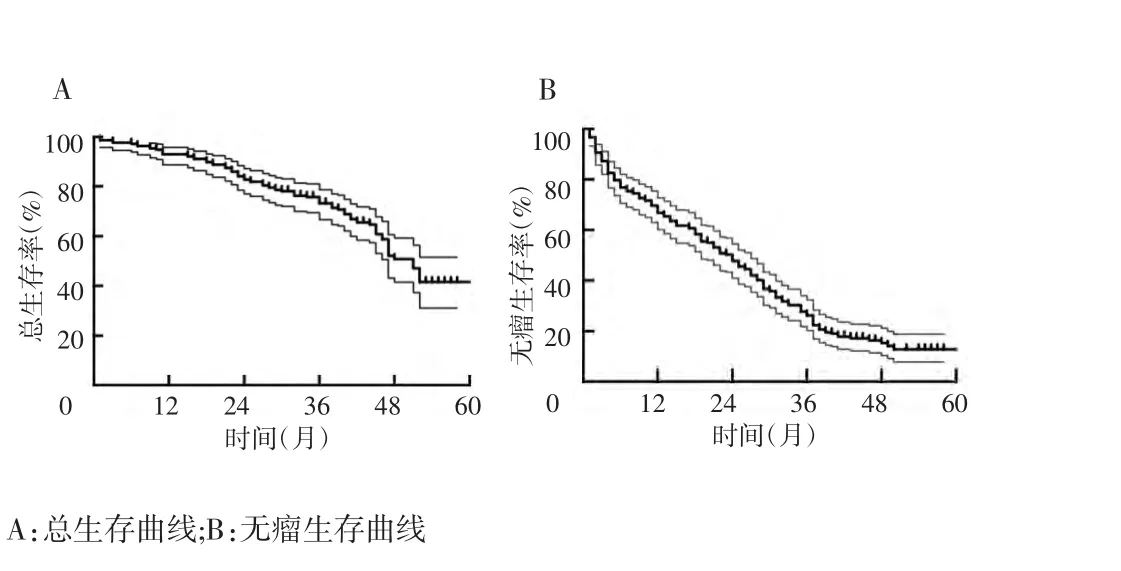
图1 215例HCC患者的总生存和无瘤生存曲线
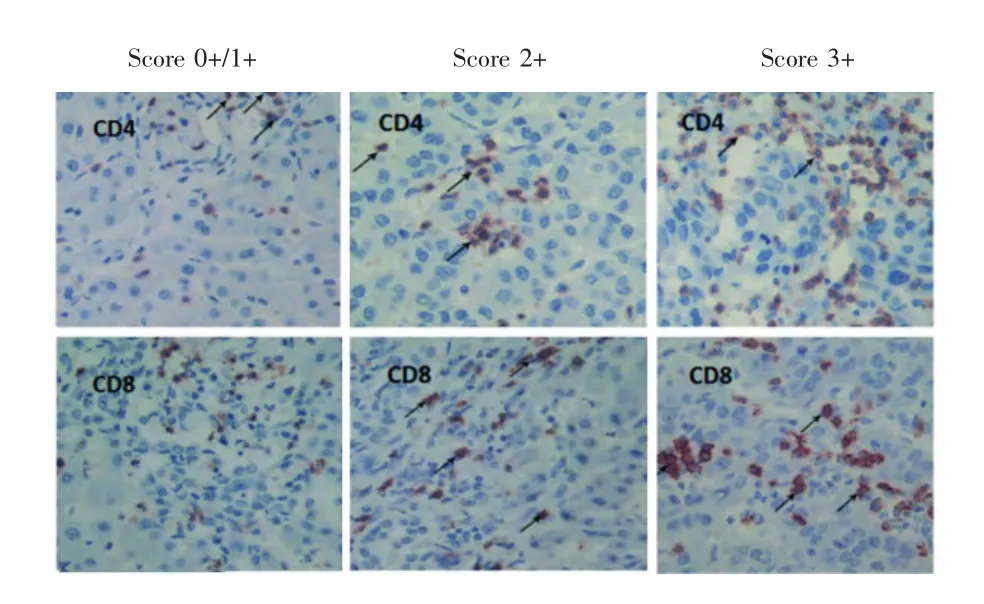
图2 CD4+/CD8+T淋巴细胞在HCC癌组织中的浸润(×400)
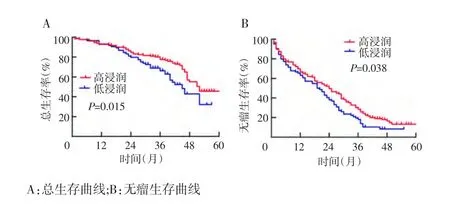
图3 CD4+T淋巴细胞浸润与总生存率和无瘤生存率的关系
CD8+T淋巴细胞高浸润和低浸润的比例分别为34.9%和65.1%,免疫组化结果见图2。CD8+T淋巴细胞低浸润与多结节、肿瘤包膜不完整、术前甲胎蛋白≥400 ng/mL、术后1个月甲胎蛋白≥400 ng/mL、Edmondson-Steiner分级Ⅲ/Ⅳ级以及肿瘤复发相关(表1)。在总生存率方面,CD8+T淋巴细胞高浸润的风险比为1.591(95%CI 1.039~2.437);无瘤生存率CD8+T淋巴细胞高浸润的风险比为1.371(95%CI 1.004~1.872)。CD8+T淋巴细胞高浸润组患者总生存率和无瘤生存率均显著高于低浸润组患者(P=0.033,P=0.047)。见图4。
2.4 单因素和多因素分析预后风险因素
单因素分析显示,肿瘤直径≥5cm、多结节、肝硬化、微血管侵犯、肿瘤包膜不完整、术前甲胎蛋白≥400 ng/mL、术后1个月甲胎蛋白≥400 ng/mL、Edmondson-Steiner分级Ⅲ/Ⅳ级、BCLC-C期肿瘤可能是患者不良预后的独立危险因素,而CD4+和CD8+T淋巴细胞高浸润可能是患者预后的保护因素。在无瘤生存率方面,肿瘤直径≥5 cm、多结节、微血管侵犯、肿瘤包膜不完整、术前甲胎蛋白≥400 ng/mL、术后1个月甲胎蛋白≥ 400 ng/mL、BCLC-C期肿瘤可能是患者肿瘤复发的独立危险因素,而CD4+和CD8+T淋巴细胞高浸润可能是肿瘤复发的保护因素。
多因素分析显示,肿瘤直径≥5 cm、多结节、微血管侵犯、肿瘤包膜不完整、术前甲胎蛋白≥400 ng/mL、术后1个月甲胎蛋白≥400 ng/mL、Edmondson-Steiner分级Ⅲ/Ⅳ、BCLC-C期肿瘤和肿瘤复发是患者不良预后的独立危险因素,而CD4+和CD8+T淋巴细胞高浸润是患者预后的保护因素(表2)。在无瘤生存率方面,肿瘤直径≥5 cm、多结节、微血管侵犯、肿瘤包膜不完整、术前甲胎蛋白≥400 ng/mL、术后1个月甲胎蛋白≥400 ng/mL、BCLC-C期肿瘤是肿瘤复发的独立危险因素,而CD4+和CD8+T淋巴细胞高浸润是肿瘤复发的保护因素。见表2。

图4 CD8+T淋巴细胞浸润与总生存率和无瘤生存率的关系

表2 Cox比例风险回归模型分析HCC患者总生存率和无瘤生存率
3 讨论
肝切除术是早期HCC的首选治疗方式,但总体效果欠佳,可能与患者机体免疫系统抗肿瘤免疫缺陷有关。调节性T淋巴细胞CD4+和CD8+通过调节免疫功能发挥抗肿瘤作用,同时也可抑制抗肿瘤免疫,使肿瘤细胞逃避机体的免疫监视[13]。本研究分析215例HCC患者癌组织中CD4+和CD8+T淋巴细胞浸润与患者临床病理特征以及预后的相关性,结果发现CD4+和CD8+T淋巴细胞低浸润与多个不良预后因素相关,CD4+和CD8+T淋巴细胞高浸润组患者的总生存率和无瘤生存率均显著高于低浸润组患者,多因素分析发现CD4+和CD8+T淋巴细胞高浸润是肿瘤复发和患者预后的保护因素,与Gabrielson等[14]报道结果一致。
CD8+T淋巴细胞与非特异性自然杀伤细胞等共同承担着肿瘤的免疫监视作用,具有对肿瘤细胞直接杀伤功能。在本研究中,HCC组织中CD8+T淋巴细胞高浸润组患者总生存率和无瘤生存率均显著高于低浸润组患者。Gabrielson等[14]研究发现,无论是HCC组织还是癌旁组织的CD8+T淋巴细胞高浸润均与更低的肿瘤复发率相关。Gao等[15]一项纳入302例HCC的研究发现,HCC组织中CD4+T淋巴细胞或CD8+T淋巴细胞高浸润组患者的无瘤生存率和总生存率均稍高于低浸润组患者,但差异均无统计学意义。大量研究证实,HCC组织中FoxP3+Tregs细胞高浸润与患者无瘤生存率和总生存率呈负相关,一致认为FoxP3+Tregs细胞促进HCC疾病进展与通过抑制CD8+T淋巴细胞等免疫细胞的数量和功能有关[15-17]。
另一方面,PD-L1分子高表达是T细胞耗竭的重要标记,与T细胞激活和功能呈负相关[18]。共培养实验显示,PD-L1在HCC细胞中可导致T细胞凋亡,且干扰素介导上调PD-L1表达后T细胞凋亡更加明显;而使用PD-L1抑制剂后,T细胞凋亡则明显下降[19]。另外,在PD-L1敲除小鼠模型中发现,PD-L1在肝内CD8+T细胞激活和失活方面发挥至关重要的作用[20]。上述研究说明,PD-1/PD-L1表达与CD4+/CD8+T淋巴细胞浸润存在一定拮抗或协同作用。抗PD-1/PD-L1治疗可能通过上调CD4+/CD8+T淋巴细胞数量或恢复其功能而发挥抗肿瘤增殖的作用。
综上所述,本研究结果显示,HCC癌组织中CD4+和CD8+T淋巴细胞的浸润与多个临床病理因素相关,CD4+T淋巴细胞、CD8+T淋巴细胞高浸润是HCC患者预后的保护因素。
[1] 余家华,李秋林,容敏华,等.2013年广西肿瘤登记地区恶性肿瘤发病和死亡分析[J].中国癌症防治杂志,2017,9(1):30-39.
[2] Siegel RL,Miller KD,Jemal A.Cancer Statistics,2017[J].CA Cancer J Clin,2017,67(1):7-30.
[3] Zhong JH,Rodriguez AC,Ke Y,et al.Hepatic resection as a safe and effective treatment for hepatocellular carcinoma involving a single large tumor,multiple tumors,or macrovascular invasion[J].Medicine(Baltimore),2015,94(3):e396.
[4] Anitei MG,Zeitoun G,Mlecnik B,et al.Prognostic and predictive values of the immunoscore in patients with rectal cancer[J].Clin Cancer Res,2014,20(7):1891-1899.
[5] Pagès F,Kirilovsky A,Mlecnik B,et al.In situ cytotoxic and memory T cells predict outcome in patients with early-stage colorectal cancer[J].J Clin Oncol,2009,27(35):5944-5951.
[6] 钟鉴宏,游雪梅,马良,等.2003-2013年某肿瘤专科医院肝细胞癌肿瘤分期及首次治疗方法调查分析[J].中国癌症防治杂志,2015,7(6):403-407.
[7] Wang YY,Qi LN,Zhong JH,et al.High expression of AKR1B10 predicts low risk of early tumor recurrence in patients with hepatitis B virus-related hepatocellular carcinoma[J].Sci Rep,2017,7:42199.
[8] 许良中,杨文淘.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):229-231.
[9] Zhong JH,Ke Y,Gong WF,et al.Hepatic resection associated with good survival for selected patients with intermediate and advancedstage hepatocellular carcinoma[J].Ann Surg,2014,260(2):329-340.
[10] Zhong JH,Xiang BD,Gong WF,et al.Comparison of long-term survival of patients with BCLC stage B hepatocellular carcinoma after liver resection or transarterial chemoembolization[J].PLoS One,2013,8(7):e68193.
[11] You XM,Mo XS,Ma L,et al.Randomized clinical trial comparing efficacy of simo decoction and acupuncture or chewing gum alone on postoperative ileus in patients with hepatocellular carcinoma after hepatectomy[J].Medicine(Baltimore),2015,94(45):e1968.
[12]中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版)[J].临床肝胆病杂志,2011,27(11):1141-1159.
[13] Topalian SL,Drake CG,Pardoll DM.Immune checkpoint blockade:a common denominator approach to cancer therapy[J].Cancer Cell,2015,27(4):450-461.
[14] Gabrielson A,Wu Y,Wang H,et al.Intratumoral CD3 and CD8 tcell densities associated with relapse-free survival in HCC[J].Cancer Immunol Res,2016,4(5):419-430.
[15] Gao Q,Qiu SJ,Fan J,et al.Intratumoral balance of regulatory and cytotoxic T cells is associated with prognosis of hepatocellular carcinoma after resection[J].J Clin Oncol,2007,25(18):2586-2593.
[16] Huang Y,Wang FM,Wang T,et al.Tumor-infiltrating FoxP3+Tregs and CD8+T cells affect the prognosis of hepatocellular carcinoma patients[J].Digestion,2012,86(4):329-337.
[17] Fu J,Xu D,Liu Z,et al.Increased regulatory T cells correlate with CD8 T-cell impairment and poor survival in hepatocellular carcinoma patients[J].Gastroenterology,2007,132(7):2328-2339.
[18] Blank C,Gajewski TF,Mackensen A.Interaction of PD-L1 on tumor cells with PD-1 on tumor-specific T cells as a mechanism of immune evasion:implications for tumor immunotherapy[J].Cancer Immunol Immunother,2005,54(4):307-314.
[19] Muhlbauer M,Fleck M,Schutz C,et al.PD-L1 is induced in hepatocytes by viral infection and by interferon-alpha and-gamma and mediates T cell apoptosis[J].J Hepatol,2006,45(4):520-528.
[20] Dong H,Zhu G,Tamada K,et al.B7-H1 determines accumulation and deletion of intrahepatic CD8(+)T lymphocytes[J].Immunity,2004,20(3):327-336.
[2017-02-24收稿][2017-03-28修回][编辑 罗惠予]
Expression and prognostic significance of CD4+/CD8+T lymphocytes in patients with hepatocellular carcinoma
Zhong Jianhong1,2,Xiang Xiao1,2,Qin Honggui1,2,You Xuemei1,2,Ma Liang1,2,Wu Feixiang1,2,Xiang Bangde1,2,Yuan Weiping1,2,Li Lequn1,2,3
(1Department of Hepatobiliary Surgery,Affiliated Tumor Hospital of Guangxi Medical University;2Guangxi Liver Cancer Diagnosis and Treatment Engineering and Technology Research Center;3Key Laboratory of High-Incidence-Tumor Early Prevention and Treatment,Ministry of Education,Nanning 530021,P.R.China)
ObjectiveTo clarify the relationship between infiltration by CD4+/CD8+T lymphocytes and prognosis of patients with hepatocellular carcinoma(HCC).MethodsA total of 215 HCC patients who underwent hepatectomy were examined by immunohistochemistry to detect infiltration of CD4+/CD8+T lymphocytes in tumor tissues.Disease-free survival and overall survival were compared between patients with or without such infiltration.ResultsOf all patients,60.9%showed high CD4+T lymphocyte infiltration,while the remaining 39.1%showed low infiltration.Rates of disease-free survival and overall survival were significantly higher among patients with high infiltration than among patients with low infiltration (P=0.038 and 0.015,respectively).Of all patients,34.9%showed high CD8+T lymphocyte infiltration and 65.1%showed low infiltration.Rates of disease-free survival and overall survival were significantly higher among patients with high infiltration than among patients with low infiltration (P=0.047 and 0.033,respectively).ConclusionLow infiltration of CD4+or CD8+T lymphocytes into tumors may relate to poor prognosis of HCC patients.
Liver neoplasms;CD4+T lymphocytes;CD8+T lymphocytes;Overall survival;Prognosis
Li Lequn.E-mail:Li_lequn@263.net
R735.7
A
1674-5671(2017)04-06
10.3969/j.issn.1674-5671.2017.04.13
国家科技重大专项课题资助项目(2012ZX10002010001009);广西卫计委科研课题资助项目(Z2016512,GZZC15-34,Z2015621,Z2014241);广西科学研究与技术开发计划资助项目(桂科攻14124003-4);广西研究生教育创新计划资助项目(YCBZ2015030)
黎乐群。E-mail:Li_lequn@263.net

