下调叉头框转录因子3a促进鼻咽癌侵袭转移
罗敏 胡国清
作者单位:430030 武汉 华中科技大学同济医学院附属同济医院肿瘤科
下调叉头框转录因子3a促进鼻咽癌侵袭转移
罗敏 胡国清
作者单位:430030 武汉 华中科技大学同济医学院附属同济医院肿瘤科

胡国清,华中科技大学同济医院肿瘤中心二级教授,主任医师,博士研究生导师。兼任中国抗癌协会鼻咽癌专业委员会常委,中国临床肿瘤学会(CSCO)委员,CSCO小细胞肺癌专家委员会委员,CSCO抗肿瘤药物安全管理专家委员会委员,湖北省抗癌协会常委,湖北省鼻咽癌专业委员会主任委员,《中华放射肿瘤学杂志》编委等。曾留学德国,从事临床肿瘤工作40年,有丰富的临床经验,擅长鼻咽癌等头颈部肿瘤、肺癌、乳腺癌、胃肠道肿瘤、恶性淋巴瘤等肿瘤的放射治疗及其综合治疗。承担多项国家自然科学基金及省重点科研项目;获省市科技进步奖二等奖、三等奖各1项。主编/副主编著作5部,主译专著1部;发表学术论文100余篇,近5年以第一作者及通信作者发表SCI论文17篇。
目的 探讨下调叉头框转录因子3a(FOXO3a)对促进鼻咽癌侵袭转移的影响。方法 慢病毒shRNA和空载病毒液Mock shRNA按复感染指数(multiplicity of infection,MOI)为50转染鼻咽癌CNE2和HNE1细胞,构建低表达FOXO3a的稳定转染细胞。采用Western blot、Real-time PCR检测其转染效率。划痕实验和Transwell实验检测下调FOXO3a对诱导鼻咽癌细胞侵袭转移的影响。Western blot检测上皮间质转化(epithelial-mesenchymal transition,EMT)相关蛋白E-cadherin、Vimentin、N-cadherin、Twist和Snail的表达,免疫荧光检测EMT相关蛋白定位。Western blot和Real-time PCR检测基质金属蛋白酶MMP2和MMP9的表达。结果 成功构建低表达FOXO3a稳定转染鼻咽癌CNE2和HNE1细胞。划痕实验和Transwell实验结果显示,与空载体转染鼻咽癌细胞比较,低表达FOXO3a稳定转染鼻咽癌细胞的侵袭和转移能力增强,EMT相关蛋白E-cadherin表达下调,而Vimentin、N-cadherin、Twist和Snail表达显著升高,MMP2和MMP9表达亦升高。结论 下调FOXO3a可促进鼻咽癌的侵袭转移。
鼻咽肿瘤;叉头框转录因子3a;侵袭;转移
鼻咽癌(nasopharyngeal carcinoma,NPC)是我国最常见的头颈部恶性肿瘤,放疗是首选的治疗手段。早期鼻咽癌单纯放疗后5年生存率达90%,而晚期鼻咽癌即使采用适形调强放疗联合化疗综合治疗,仍有20%~30%的患者治疗失败[1]。因此深入研究鼻咽癌复发转移的内在分子机制,寻找新的有效靶点,将成为提高鼻咽癌疗效并改善患者生活质量的重要环节[2-3]。叉头框转录因子3a(FOXO3a)是重要的抑癌基因,在多种肿瘤中被证实与上皮间质转化(epithelialmesenchymal transition,EMT)相关[4],其表达被证实与基质金属蛋白酶(matrix metallopro-teinases,MMPs)表达相关[5]。而上皮间质转化和MMPs的表达在鼻咽癌侵袭转移中起重要作用[6-7]。所以笔者推测下调FOXO3a可能促进鼻咽癌发生侵袭转移。
1 方法
1.1 细胞培养
人鼻咽癌细胞系CNE2和HNE1购自中南大学癌症研究所。所有细胞系均用含10%胎牛血清的RPMI-1640(启动子生物科技)培养于在 37 °C、5%CO2培养箱中。
1.2 主要试剂
RPMI-1640培养液购自美国Hy-Clone公司,胎牛血清(fetal bovine serum,FBS)购自杭州四季青公司,BCA蛋白定量试剂盒为海碧云天生物技术研究所产品,E-cadherin、Vimentin、N-cadherin、Twist和 Snail兔抗人单克隆抗体均购自美国Cell Signaling Technology公司,MMP9、MMP2兔抗人单克隆抗体均购自美国Epitomics公司,慢病毒 FOXO3a shRNA1、FOXO3a shRNA2、FOXO3a shRNA3和空载病毒液Mock shRNA购自上海吉凯基因化学技术有限公司。
1.3 细胞转染
将对数生长期的细胞制备成单细胞悬液,按9×104个/孔接种于12孔板中,12 h后按复感染指数(multi-plicity of infection,MOI)为 50分别加入下调FOXO3a(FOXO3a shRNA1、FOXO3a shRNA2、FOXO3a shRNA3)和对照空载病毒液(Mock shRNA),同时设置空白对照组。转染10 h后更换完全培养液,24 h后用含1 μg/mL嘌呤霉素的完全培养液培养48 h,筛选转染成功的鼻咽癌细胞,收集细胞,进一步鉴定。
1.4 Real-time PCR实验
收集各组细胞,用Trizol法提取细胞总RNA,TaKaRa公司反转录试剂盒合成cDNA,按Green SYBR试剂盒(Invitrogen公司)说明书于实时荧光定量PCR仪进行扩增。FOXO3a上游引物:5'-CCCAACCAGCTCCTTTAACA-3',下 游 引 物 :5'-GAGTCCGAAGTGAGCAGGTC-3';MMP9 上游引物:5'-TTGACAGCGACAAGAAGTGG-3',下游引物:5'-GCCATTCACGTCGTCCTTAT-3';MMP2 上 游 引 物 :5'-TACGATGGAGGCGCTTG-3',下 游 引 物 :5'-TGCACTGCCAACTATTTGTC-3';GAPDH 上 游 引 物 :5'-GGTCGGAGTCAACGGATTTG-3',下游引物:5'-GGAAGATGGTGATGGGATTTC-3'。反应条件:95 ℃ 30 s;95 ℃ 8 s,60 ℃32 s,40个循环;95 ℃ 1 min,60 ℃ 30 s,95 ℃ 30 s。
最后以2-ΔΔCt法计算基因相对表达量。
1.5 Western blot实验
用RIPA细胞裂解液于冰上裂解细胞,裂解产物经离心、蛋白变性后,加入Loading buffer上样至SDSPAGE胶电泳分离,PVDF膜恒流电转,5%脱脂奶粉封闭 1 h,Tween-PBS洗膜后加入一抗(E-cadherin、Vimentin、N-cadherin、Twist、Snail、MMP9 和 MMP2 兔抗),4℃过夜孵育,再次洗膜后加入二抗,室温孵育1 h,Tween-PBS洗膜,ECL化学发光法显影,凝胶成像分析系统进行灰度扫描,计算各组条带的灰度值。以GAPDH为内参对照。
1.6 细胞划痕实验
取对数生长期细胞分别接种于24孔板中培养至95%融合,用10 μL无菌枪头垂直划出一条无细胞区,小心洗去漂浮细胞3遍后加入无血清培养液,放至37℃、5%CO2培养箱培养,分别在划痕0 h、24 h后于显微镜下观察并拍照。各实验组24 h细胞迁移距离(mm)=0 h划痕宽度-24 h划痕宽度;24 h细胞迁移率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.7 Transwell实验
实验于Transwell板上室面铺ECM胶40 μL,5 h后取对数生长期细胞,以每毫升1×105个密度接种于上室,下室加入含10%胎牛血清的完全培养液600 μL,于37℃、5%CO2培养箱培养24 h,再经甲醇固定,0.1%结晶紫染色,用棉签刮除上室面ECM胶,于显微镜下随机选取5个视野(×200)观察并拍照,计数每个视野中穿过滤膜的细胞数。
1.8 统计学处理
采用IBM SPSS Statistics 19.0统计学软件进行统计分析。计量资料组间比较采用独立样本t检验分析,以P<0.05为差异有统计学意义。
2 结果
2.1 稳定转染细胞系的建立
分别将下调 FOXO3a(FOXO3a shRNA1、FOXO3a shRNA2、FOXO3a shRNA3)和对照空载(Mock shRNA)的4种慢病毒转染鼻咽癌 CNE2和HNE1细胞,Western blot检测各慢病毒稳定转染鼻咽癌细胞株中FOXO3a蛋白的表达水平。结果显示,Mock shRNA未明显影响 FOXO3a蛋白表达,而FOXO3a shRNA转染可使FOXO3a蛋白表达明显下调,其中以FOXO3a shRNA3下调作用最显著(图1A)。Real-time PCR检测 FOXO3a mRNA表达量,结果显示,Mock shRNA不影响 FOXO3a mRNA表达,而其余3种 FOXO3a shRNA可明显抑制 FOXO3a mRNA表达,其中以FOXO3a shRNA3的抑制作用最明显,抑制率可达70%左右(图1B)。因此,选取FOXO3a shRNA3和Mock shRNA转染细胞用于后续实验。以上表明本实验成功建立低表达FOXO3a稳定转染鼻咽癌细胞。

图1 低表达FOXO3a稳定转染鼻咽癌细胞建立
2.2 下调FOXO3a表达后鼻咽癌细胞的迁移能力
细胞划痕实验结果显示,低表达FOXO3a鼻咽癌细胞CNE2-shRNA3和HNE1-shRNA3的划痕愈合率分别为(80.23±7.10)%和(79.56±6.06)%,空载体转染细胞CNE2-Mock shRNA和HNE1-Mock shRNA划痕愈合率分别为(23.62±3.94)%和(20.83±5.34)%,低表达FOXO3a鼻咽癌细胞划痕愈合率明显高于空载体转染细胞(P<0.01),见图2。说明下调FOXO3a表达可增强细胞迁移能力。

图2 下调FOXO3a表达后鼻咽癌细胞的迁移能力
2.3 下调FOXO3a表达后鼻咽癌细胞的侵袭能力
Transwell侵袭实验结果显示,低表达FOXO3a鼻咽癌细胞CNE2-shRNA3和HNE1-shRNA3细胞穿过上室ECM胶及聚碳酸酯膜的数量分别为(105.33±18.50)个和(118.00±14.58)个,较空载体转染细胞CNE2-Mock shRNA 的(45.00±9.57)个和 HNE1-Mock shRNA 的(40.67±7.21)个明显升高(P<0.01),见图 3。可见下调FOXO3a后鼻咽癌细胞的侵袭能力显著增强。

图3 下调FOXO3a表达后鼻咽癌细胞的侵袭能力
2.4 下调FOXO3a表达后鼻咽癌细胞EMT相关标志蛋白的表达及定位
Western blot检测下调FOXO3a表达后鼻咽癌各细胞系中EMT相关标志蛋白的表达,结果显示,低表达FOXO3a鼻咽癌细胞中上皮标志蛋白E-cadherin均较对应空载体转染细胞表达下调或缺失(P<0.01),间质标志蛋白Vimentin和N-cadherin表达较空载体转染细胞升高(P<0.01),同时Twist和Snail表达亦上调(P<0.01),见图4A。利用荧光标记的抗体标记细胞内蛋白,荧光显微镜下观察EMT标志蛋白的细胞定位,发现空载体转染鼻咽癌细胞在细胞间隙可见黏附蛋白E-cadherin表达于细胞膜,低表达FOXO3a鼻咽癌细胞与细胞间E-cadherin表达缺失。同时细胞质内的骨架蛋白Vimentin较空载体转染细胞表达增加,均出现间质细胞样改变,见图4B。以上结果证实下调FOXO3a表达能诱导鼻咽癌细胞系获得间质细胞样特性。

图4 下调FOXO3a表达后鼻咽癌细胞EMT相关标志蛋白的表达及定位
2.5 下调FOXO3a表达后鼻咽癌细胞MMP2和MMP9的表达
Real-time PCR和Western blot检测下调FOXO3a后鼻咽癌细胞MMP2和MMP9的表达情况,与空载体转染细胞比较,低表达FOXO3a鼻咽癌细胞MMP2和MMP9的表达上调,差异有统计学意义(P<0.05)。见图5。
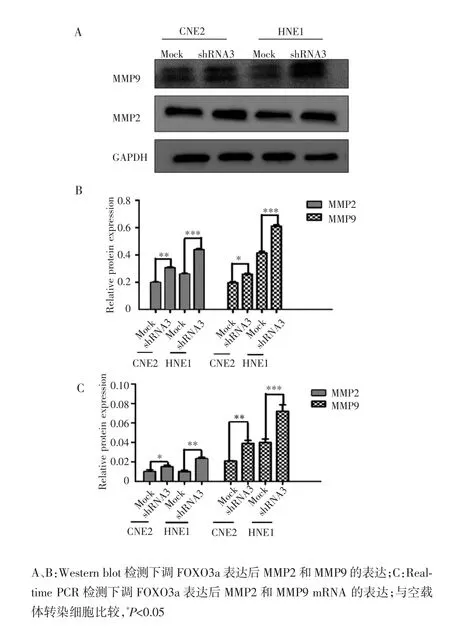
图5 下调FOXO3a表达后MMP2和MMP9的表达
3 讨论
叉头框转录因子(FOXO)是2000年被正式命名的一个新的转录因子家族,主要在调控细胞增殖、分化、新陈代谢、凋亡以及调节免疫等方面起重要作用[8-10]。该家族包括多个成员,其中研究最多为FOXO3a[11]。FOXO3a 已在乳腺癌、胃癌、肺癌、肾透明细胞癌等[12-15]多种肿瘤中被证实与肿瘤的EMT相关。但目前FOXO3a在鼻咽癌中的研究较少,仅在鼻咽癌组织中被证明其表达与预后相关以及与肿瘤的EMT有关[16]。EMT是指上皮细胞失去上皮样表型,获得间质样细胞特点的生物学过程,可介导恶性肿瘤侵袭和转移[6,17]。MMPs是一个大家族,因其需要 Ca2+、Zn2+等金属离子作为辅助因子而得名。MMPs几乎能降解ECM中的各种蛋白成分,破坏肿瘤细胞侵袭的组织学屏障,在肿瘤侵袭转移中起关键性作用[18],其中MMP9和MMP2已在我们前期研究中被证实与鼻咽癌侵袭相关[19]。因此我们推测下调FOXO3a可能通过诱导EMT和上调MMP2与MMP9而促进鼻咽癌侵袭转移。
本研究采用慢病毒作为有效载体,成功构建低表达FOXO3a的稳定转染细胞系,通过特异性下调FOXO3a表达后,观察下调FOXO3a基因在调控鼻咽癌细胞发生EMT、上调MMP2和MMP9和进一步诱导侵袭转移中的作用。结果显示,下调的FOXO3a抑制了鼻咽癌细胞上皮标志蛋白E-cadherin的表达,诱导间质细胞标志蛋白Vimentin的表达升高,通过这一系列作用,最终促进鼻咽癌上皮细胞发生间质表型转化。此外,MMPs是一类锌依赖的蛋白水解酶家族,其活化是诱导肿瘤浸润和转移的重要步骤。其家族成员MMP2和MMP9能降解细胞外基质中的主要成分—Ⅳ型胶原,在肿瘤侵袭转移中发挥关键作用[19-20]。本研究发现下调FOXO3a表达后鼻咽癌细胞MMP2和MMP9蛋白表达升高,提示FOXO3a可能参与MMP2和MMP9的调节,促进肿瘤细胞对细胞外基质成分的降解,从而使鼻咽癌上皮细胞侵袭和迁移能力显著增强。
综上所述,本研究结果证实,鼻咽癌细胞中FOXO3a基因为调控侵袭和迁移的重要因子之一,可能通过调控EMT相关蛋白表达,上调MMP2和MMP9诱导鼻咽癌细胞获得降解细胞外基质并向远处运动的能力,最终促进鼻咽癌细胞的侵袭和迁移。然而在其诱导肿瘤细胞上皮间质转化、上调MMP2和MMP9以及进一步调控侵袭转移的过程中,具体通过何种信号通路和细胞因子协同作用,仍然有待进一步探索。本研究为深入研究FOXO3a在鼻咽癌侵袭转移中的作用机制奠定了基础,为针对侵袭转移的肿瘤治疗提供了依据。
[1] Chua ML,Chan AT.Nasopharyngeal carcinoma[J].Lancet,2016,387(10022):1012-1024.
[2] 曾雷,卢泰祥.鼻咽癌综合治疗策略[J].中国癌症防治杂志,2012.4(3):205-209.
[3] Bruce JP,Yip K,Bratman SV,et al.Nasopharyngeal cancer:molecular landscape[J].J Clin Oncol,2015,33(29):3346-3355.
[4] Liu H,Yin J,Wang H,et al.FOXO3a modulates WNT/β-catenin signaling and suppresses epithelial-to-mesenchymal transition in prostate cancer cells[J].Cell Signal,2015,27(3):510-518.
[5] Xu K,Pei H,Zhang Z,et al.FoxO3a mediates glioma cell invasion by regulating MMP9 expression[J].Oncol Rep,2016,36(5):3044-3050.
[6] YeungKT,YangJ.Epithelial-mesenchymaltransition in tumor metastasis[J].Mol Oncol,2017,11(1):28-39.
[7] Brown GT,Murray GI.Current mechanistic insights into the roles of matrix metalloproteinases in tumour invasion and metastasis[J].J Patho,2015,237(3):273-281.
[8] Wang Y,Zhou Y,Graves DT.FOXO transcription factors:their clinical significance and regulation[J].Biomed Res Int,2014,2014:925350.
[9] Kajihara T,Jones M,Fusi L,et al.Differential expression of FOXO1 and FOXO3a confers resistance to oxidative cell death upon endometrial decidualization[J].Mol Endocrinol,2006,20(10):2444-2455.
[10] Lee HY,You HJ,Won JY,et al.Forkhead factor,FOXO3a,induces apoptosis of endothelial cells through activation of matrix metalloproteinases[J].Arterioscler Thromb Vasc Biol,2008,28(2):302-308.
[11] Nho RS,Hergert P.FoxO3a and disease progression[J].World J Biol Chem,2014,5(3):346-354.
[12] Yu DD,Lv MM,Chen WX,et al.Role of miR-155 in drug resistance of breast cancer[J].Tumour Biol,2015,36(3):1395-1401.
[13] Park SH,Jang KY,Kim MJ,et al.Tumor suppressive effect of PARP1 and FOXO3A in gastric cancers and its clinical implications[J].Oncotarget,2015,6(42):44819-44831.
[14] Liu H,Yin J,Wang C,et al.FOXO3a mediates the cytotoxic effects of cisplatin in lung cancer cells[J].Anticancer Drugs,2014,25(8):898-907.
[15] Ni D,Ma X,Li HZ,et al.Downregulation of FOXO3a promotes tumor metastasis and is associated with metastasis-free survival of patients with clear cell renal cell carcinoma[J].Clin Cancer Res,2014,20(7):1779-1790.
[16] Shou Z,Lin L,Liang J,et al.Expression and prognosis of FOXO3a and HIF-1α in nasopharyngeal carcinoma[J].J Cancer Res Clin Oncol,2012,138(4):585-593.
[17] Nantajit D,Lin D,Li JJ.The network of epithelial-mesenchymal transition:potential new targets for tumor resistance[J].JCancerRes Clin Oncol,2015,141(10):1697.
[18] Wróbel-Roztropiński A,Zielińska-Kamierska B,Lucas-Grzelczyk W,et al.The matrix metalloproteinase in oral and oropharyngeol cancer-literature review[J].Postepy Biochem,2016,62(4):506-510.
[19] Sun W,Liu DB,Li WW,et al.Interleukin-6 promotes the migration and invasion of nasopharyngeal carcinoma cell lines and upregulates the expression of MMP-2 and MMP-9[J].Int J Oncol,2014,44(5):1551-1560.
[20] Bauvois B.New facets of matrix metalloproteinases MMP-2 and MMP-9 as cell surface transducers:outside-in signaling and relationship to tumor progression[J].Biochim Biophys Acta,2012,1825(1):29-36.
[2017-05-17收稿][2017-06-08修回][编辑 罗惠予]
《中国癌症防治杂志》执行优惠、奖励政策的启事
为了更好、更快地进行肿瘤学术交流和推广科研成果的应用,促进我国肿瘤防治事业的繁荣和发展,本刊执行优惠、奖励政策:
1.所有来稿均免收审稿费;
2.优先3个月内发表科研基金资助的论著;
3.凡属国家级、省部级重大项目的论著免收论文发表版面费;
4.在读研究生课题论著减免50%的版面费;
5.凡发表国家级科研基金资助的论著奖励1 500元,发表省部级科研基金资助的论著奖励1 000元。
(本刊编辑部)
Silencing Forkhead Box Transcription Factor(FOXO3a)promotes tumor invasion and migration in nasopharyngeal carcinoma
Luo Min,Hu Guoqing
(Department of Oncology,Tongji Hospital,Tongji Medical CollegeAffiliated,Huazhong University of Science and Technology,Wuhan 430030,P.R.China)
ObjectiveTo investigate whether Silencing Forkhead Box Transcription Factor(FOXO3a)can promote tumor invasion and migration in nasopharyngeal carcinoma(NPC).MethodsThe NPC cell lines CNE2 and HNE1 were transfected with lentiviruses encoding short hairpin RNA(shRNA)targeting FOXO3a or encoding mock shRNA,and transfection efficiency was checked usingWestern blotting and real-time PCR.Scratch and transwell tests were performed to determine whether silencing FOXO3a induced invasion and migration of NPC cells.Western blotting was performed to identify changes in levels of the epithelial-mesenchymal transition markers E-cadherin,Vimentin,N-cadherin,Twist and Snail.Localization of these marker proteins was analyzed using immunofluorescence.Western blotting and real-time PCR were also used to measure expression of matrix metalloproteinases (MMPs)2 and 9.ResultsStably transfected cell lines were constructed in which FOXO3a was silenced.Silencing FOXO3a promoted tumor invasion and migration,based on the scratch and transwell tests.Levels of the epithelial marker E-cadherin were reduced.In contrast,levels of the mesenchymal markers vimentin and N-cadherin were increased,as were levels of MMP2 and MMP9.ConclusionSilencing FOXO3a may promote tumor invasion and migration in NPC.
Nasopharyngeal neoplasm;FOXO3a;Invasion;Migration
Hu Guoqing.E-mail:gqhu@tjh.tjmu.edu.cn
R739.63
A
1674-5671(2017)04-06
10.3969/j.issn.1674-5671.2017.04.07
国家自然科学基金资助项目(81272491,81572960)
胡国清。E-mail:gqhu@tjh.tjmu.edu.cn

