低分化甲状腺癌临床病理特征分析
王富强,谭改民
低分化甲状腺癌临床病理特征分析
王富强,谭改民*
目的探讨低分化甲状腺癌(PDTC)的临床病理特征。方法收集2009年4月—2016年9月安阳市肿瘤医院病理科所有甲状腺癌手术标本502例,学习都灵共识诊断标准并再次由两位高年资医师重新复查组织切片,诊断PDTC 10例。分析10例PDTC患者的临床特征、组织学特点、免疫组化结果。结果10例患者中男3例,女7例;发病年龄39~74岁,中位发病年龄61岁。10例患者均表现为甲状腺或颈部肿物,伴有吞咽疼痛或声音嘶哑。B超均表现为甲状腺低回声实性结节。10例患者组织结构主要呈实性巢状或片状浸润性生长伴有坏死,低分化部分缺乏乳头状癌核特点,核分裂易见,可伴发有分化好的甲状腺乳头状癌或滤泡性乳头状癌成分。免疫组化结果显示,10例AE1/AE3、CK19阳性表达,8例甲状腺转录因子1(TTF-1)阳性表达,6例甲状腺球蛋白(TG)局灶染色弱阳性,4例波形蛋白染色呈区域阳性表达,10例患者Ki-67增殖指数为10%~50%。随访结果:3例术后局部复发,1例出现肺部转移,3例分别于术后4年、6年及7年死于肿瘤全身转移,其余3例随访时间短未见复发与转移。结论PDTC是一种独特的且较少见的甲状腺恶性肿瘤,其组织形态特殊,临床预后介于高分化甲状腺癌与未分化甲状腺癌之间。
甲状腺肿瘤;病理学;预后
王富强,谭改民.低分化甲状腺癌临床病理特征分析[J].中国全科医学,2017,20(26):3304-3308.[www.chinagp.net]
WANG F Q,TAN G M.Clinicopathological characteristics of poorly differentiated thyroid carcinoma[J].Chinese General Practice,2017,20(26):3304-3308.
低分化甲状腺癌(poorly differentiated thyroid carcinoma,PDTC)是一类癌细胞起源于滤泡上皮的恶性肿瘤。这一概念提出多年,但一直存在争议。2004年世界卫生组织(WHO)甲状腺肿瘤分类正式将其列为独立的肿瘤性疾病[1]。其形态学和生物学行为介于高分化乳头状癌或滤泡癌与未分化癌(间变性癌)之间。PDTC可以原发或从高分化甲状腺癌发展而来。由于人们对这类肿瘤的认识比较模糊,也缺乏统一具体的诊断标准,易与其他甲状腺恶性肿瘤产生混淆。直到2006年在意大利都灵召开的会议,对分化差的甲状腺癌进行专题讨论,并达成了一致的诊断共识[2]。本研究采用都灵共识诊断标准回顾性分析安阳市肿瘤医院收治的10例PDTC患者的病例资料,对其临床病理特征及免疫组化检测结果进行分析,进一步为临床诊治提供依据。
1 资料与方法
1.1 临床资料 收集2009年4月—2016年9月安阳市肿瘤医院病理科所有甲状腺癌手术标本502例,通过查阅病理资料发现原病理诊断低分化乳头状癌5例,未分化癌18例。然后学习都灵共识诊断标准并再次由两位高年资医师重新复查组织切片,诊断PDTC 10例。查阅各患者的主要症状、体征及治疗情况,并通过电话进行随访。
1.2 方法 所有标本经10%甲醛溶液固定、常规脱水、石蜡包埋、切片、HE染色,镜下观察。免疫组化染色采用SP法,均采用徕卡全自动免疫组化仪。设阴性和阳性对照。抗体包括AE1/AE3、CK19、甲状腺转录因子1(TTF-1)、甲状腺球蛋白(TG)、波形蛋白(vimentin)、降血钙素(calcitonin)、CD56、嗜铬粒蛋白A(CgA)、Syn、Ki-67,均购自福州迈新生物公司。
1.3 结果判读 癌细胞的特定部位染色显示棕黄色为阳性表达,其中AE1/AE3、CD56定位于细胞膜为阳性表达, CK19、TG、波形蛋白、降血钙素、CgA、Syn定位于细胞质为阳性表达,TTF-1、Ki-67定位于细胞核为阳性表达。
1.4 观察指标 分析10例PDTC患者的临床特征、组织学特点、免疫组化结果。
2 结果
2.1 临床特征 10例患者中男3例,女7例;发病年龄39~74岁,中位发病年龄61岁。10例患者均表现为甲状腺或颈部肿物,伴有吞咽疼痛或声音嘶哑。B超均表现为甲状腺低回声实性结节。术后6例周围淋巴结转移,5例进行了131I治疗。随访10例患者中3例术后局部复发,1例出现肺部转移,3例分别于术后4年、6年及7年死于肿瘤全身转移,其余3例随访时间短未见复发与转移(见表1)。
2.2 组织学特点 肿瘤切面灰白结节状,界限不清。肿物最大径3~7 cm。10例PDTC组织,4例表现单纯性低分化癌组织成分,6例合并乳头状癌成分,占肿瘤组织成分比例10%~40%。镜下主要呈实性巢团或片状浸润性生长。部分癌巢中央可见大片坏死,癌巢被明显的纤维组织间质分割包绕(见图1,本文彩图详见本刊官网www.chinagp.net电子期刊相应文章);部分病理组织内伴有高分化乳头状或滤泡型乳头状癌成分(见图2);部分低分化癌细胞可在周围正常的甲状腺滤泡组织内穿插浸润性生长(见图3);部分细胞质透明,被薄壁血管分割呈片巢状(见图4);部分癌细胞呈巢状,在组织内促纤维组织性浸润性生长伴有间质内钙化(见图5);所有低分化癌部分细胞缺乏乳头状癌核特点,其细胞质丰富透明或嗜酸,核圆形或短梭形,核深染,核仁明显,显著的核分裂象(≥3个/10 HPF)。PDTC很少由单一成分构成,多伴有不同比例的高分化乳头状或滤泡性乳头状癌成分混合存在(见表1)。
2.3 免疫组化结果 10例AE1/AE3、CK19阳性表达(见图6),8例TTF-1阳性表达(见图7),6例TG局灶染色弱阳性(见图8),4例波形蛋白染色呈区域阳性表达,10例患者Ki-67增殖指数为10%~50%。均未见降血钙素、CD56、CgA、Syn阳性表达。

表1 10例PDTC患者临床病理特征
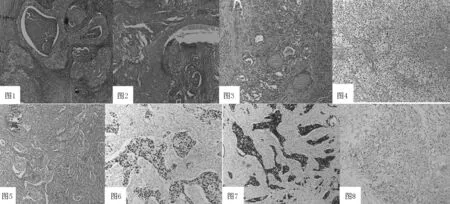
图1 癌细胞呈巢团状,中央见坏死(HE染色,×40)
Figure1 Nested thyroid carcinoma cells with central necrosis found by pathological examination with HE staining(the image was magnified 40 times by a microscope)
图2 低分化癌组织合并乳头状癌成分(HE染色,×40)
Figure2 Poorly differentiated thyroid carcinoma tissues accompanied with components of papillary carcinoma found by pathological examination with HE staining (the image was magnified 40 times by a microscope)
图3 低分化癌组织在周围正常滤泡上皮间穿插浸润生长(HE染色,×40)
Figure3 Poorly differentiated thyroid carcinoma tissue interspersed and infiltrated among the normal follicular epithelium found by pathological examination with HE staining (the image was magnified 40 times by a microscope)
图4 癌细胞被薄壁血管分隔呈片巢状,细胞质透明(HE染色,×100)
Figure4 Nested thyroid carcinoma cells separated by thin-walled vessels with clear cytoplasm found by pathological examination with HE staining (the image was magnified 100 times by a microscope)
图5 癌细胞巢在间质内促纤维组织性浸润性生长(HE染色,×100)
Figure5 Thyroid carcinoma cell nests surrounded by infiltrated interstitial fibrous tissues found by pathological examination with HE staining (the image was magnified 100 times by a microscope)
图6 癌细胞表达CK19(SP法,×100)
Figure6 Expression of CK19 in thyroid carcinoma cells found by immunohistochemical examination with SP staining(the image was magnified 100 times by a microscope)
图7 癌细胞表达TTF-1(SP法,×100)
Figure7 Expression of TTF-1 in thyroid carcinoma cells found by immunohistochemical examination with SP staining(the image was magnified 100 times by a microscope)
图8 癌细胞局灶表达TG(SP法,×100)
Figure8 Focal TG expression in thyroid carcinoma cells found by immunohistochemical examination with SP staining(the image was magnified 100 times by a microscope)
3 讨论
PDTC非常少见,有文献报道在甲状腺癌中仅占0.23%,好发于老年女性,可能与碘缺乏有关[3]。PDTC患者临床多以生长迅速的无痛性颈部肿块或颈部多发淋巴结肿大就诊,体格检查肿块质地偏硬,边界不清,活动度差,偶以声音嘶哑、吞咽不适为首发症状。
1983年SAKAMOTO等[4]首次把具有实性、梁状及岛状生长方式的甲状腺癌命名为低分化癌。1984年意大利CARCANGIU等[5]学者把分化差的癌细胞呈实性生长的岛状模式命名为岛状癌,期间各国学者关于PDTC的诊断标准一直存在争议。直到2004年WHO甲状腺肿瘤分类才正式将PDTC列为一种独立类型的肿瘤[1],强调其组织结构上出现滤泡细胞分化现象,形态学和生物学行为处于分化与未分化癌之间。组织学特征伴有岛状、小梁状及实性改变,且具有浸润性生长、坏死及浸润血管现象。但未提出明确的诊断标准[6]。到2006年,在意大利都灵召开了有关PDTC的共识会议上达成一致的诊断标准[2]。在WHO的诊断标准基础上更加细化PDTC细胞核的特点。(1)其主体是具有一种结构性生长模式,特点是形成大而界限清楚的实性巢。其间可有纤维血管间质分割成岛状结构。(2)细胞单一、核小而一致、外形光滑,染色质分布均匀,核仁不明显。有时癌细胞大,染色质空淡、核仁明显。但细胞核主要缺乏乳头状癌核特点即核增大、不规则、聚集重叠,毛玻璃样核、核沟和核假包涵体。(3)核扭曲主要表现为核小不规则,核深染,染色质分布均匀。肿瘤性坏死主要位于实性巢状中央。核分裂较多(≥3个/10 HPF)。即使无核扭曲或肿瘤性坏死,如果符合(1)和(2)的标准也应诊断PDTC。
都灵共识诊断标准虽解决多年的诊断模糊问题,但仍有未明确的问题待解决:(1)没有明确界定低分化癌组织内合并有典型的乳头状癌或滤泡癌成分的多少,且如何划分诊断类型。(2)未分化癌与低分化癌之间是否有明确的界限。(3)高分化甲状腺癌多次复发进展为PDTC是否还强调原发及其对生物学行为的界定。研究者认为低分化区所占比例>10%能明显影响预后[7]。但另外的研究者认为以50%为低分化癌成分界定具有更明确的临床意义及诊断上的可操作性[8-9]。而DETTMER等[7]研究表明,PDTC低分化区所占比例为10%~50%的患者与低分化区所占比例>50%的患者同样具有较差的预后,两者比较无差异。有研究认为只要严格按照PDTC的定义,低分化区所占比例>10%就有意义[10-11]。本研究中PDTC一般肿物较大,生长速度较快,临床多无显著症状。主要表现为无痛性颈部肿大,肿物较大累及周围组织才表现出临床相应的症状。6例合并乳头状癌成分所占比例在10%~40%。其中2例甲状腺双叶均为低分化癌,是否为同时发生或向同一侧播散尚无明确依据。另外肿物较大者,易发生淋巴结转移;与合并乳头状癌成分少者相比,合并乳头状癌成分多且口服131I治疗者,生存期相对延长。这可能与部分低分化癌由分化好的乳头状癌发展而来有关。鉴于病例数有限,尚未进一步证实。另外4例为单纯的低分化癌,与肿物小者相比,肿物大者易发生淋巴结转移,复发时间短。甲状腺低分化癌组织形态表现实性、梁状、岛状结构,但以实性最为常见,诊断仍基于组织形态学。
本研究10例均为原发性肿瘤,镜下呈实性片状,弥漫浸润,癌巢间见大量凝固性坏死,部分癌巢被纤维组织性间质分割明显,局灶可见钙化;细胞核无乳头状癌核的特点,细胞质丰富,嗜酸,核卵圆形、核仁明显,核分裂较多,部分区域局灶见分化好的乳头状癌成分;部分区域可见片状癌巢在正常滤泡之间穿插浸润生长。其中1例PDTC细胞质透明,纤维间质分割实性巢状,可诊断透明细胞型低分化癌。此种病例更为罕见,要与其他转移性肿瘤进行鉴别。另外本组病例实性癌巢在总体瘤组织成分中所占比例均>50%。分析发现合并乳头状癌成分多者预后好于其成分少及单纯性成分者。原因可能为分化好的乳头状癌对131I吸收治疗效果好,低分化成分失去对131I吸收功能,治疗无明显改善。而对其预后判断以低分化区所占比例10%或50%究竟是否有差别,目前一直存在分歧。分析主要原因在于PDTC病例非常少见,加之对其认识上不足,易误诊为其他类型的肿瘤,这也是造成缺乏大宗病例随访分析的主要原因之一。而对于未分化癌与低分化癌之间有无界限,原发与复发诊断界定问题,鉴于目前文献介绍有限,需要更多的病例资料进行分析。至于其明确诊断主要基于常规组织形态学特征。目前尚无PDTC特异的免疫组化指标,只在鉴别诊断时确定其甲状腺滤泡细胞源性肿瘤具有很大价值。本组病例CK19在分化差的区域及乳头癌区均弥漫阳性,TTF-1、TG和波形蛋白在部分病例中阳性。这可能与癌组织分化差有关。
鉴别诊断:(1)高分化乳头状癌或滤泡癌:组织学形态具有典型的甲状腺乳头状癌细胞核形态特点,如核大聚集重叠、毛玻璃样核、核沟、核内包涵体;滤泡癌主要表现滤泡样结构,滤泡上皮细胞无明显异型,存在明显包膜或血管侵犯。而在低分化癌中可见有乳头状癌或滤泡癌成分。在免疫组化方面,两者均可表达CK19、TTF-1、TG等,说明低分化癌和高分化甲状腺癌均来自滤泡上皮细胞。免疫组化鉴别价值有限,主要鉴别组织形态和癌细胞特点。(2)甲状腺髓样癌:PDTC组织结构呈实性巢或片状伴有间质硬化或玻璃样变,可使其误诊为甲状腺髓样癌,但甲状腺髓样癌的肿瘤间质中常有淀粉样物沉积,刚果红特染阳性,免疫组化降钙素(CT)阳性,神经内分泌标志物CD56、CgA、Syn均可阳性,TTF-1在甲状腺髓样癌中可以阳性,与低分化癌鉴别价值有限。而TG阴性可以明确排除甲状腺髓样癌的诊断。(3)甲状腺未分化癌:甲状腺未分化癌常见的组织学形态以梭形细胞呈席纹状或血管外皮瘤样排列,出现显著的多形性巨细胞。TG或TTF-1通常阴性或局灶弱阳性。PDTC有时易与甲状腺未分化腺癌互相混淆。另外组织中有时可见到少量的未分化癌成分,而甲状腺未分化癌患者预后极差,中位生存期为2~12个月[12]。其治疗方法是手术,131I及促甲状腺激素(TSH)抑制治疗均无效,术式选择直接影响预后,因此两者在治疗及预后均有明显不同。(4)甲状腺转移癌:主要与甲状旁腺发生的恶性肿瘤进行鉴别。甲状旁腺癌细胞质可以透明或嗜酸,呈实性片状或巢状,侵及甲状腺组织。两者形态有时不易区分。甲状旁腺癌绝大多数是功能性的,临床表现主要是钙磷代谢异常,实验室检查甲状旁腺素水平升高,表现高钙血症和低磷血症。另外还要与肾脏转移的透明细胞癌鉴别,两者在组织形态也不易区分。但PDTC TG和TTF-1阳性表达可与其鉴别。
多数学者认为外科手术为PDTC主要治疗手段。肿瘤的根治性切除是最为有效也是临床最常采取的治疗方式。对于不具备手术治疗条件者,可进行化疗和TSH抑制治疗等[12-13]。其预后介于分化型乳头状癌或滤泡癌和未分化癌之间,5年生存率约为50%,显著低于高分化癌,若不治疗,可去分化为未分化癌。PDTC患者的平均生存时间为5.9年,5年生存率为45%~62%[14]。CHERKAOUI等[3]对PDTC进行10个月~6年的随访,57%的患者缓解,28%的患者进展,15%的患者局部复发,总体生存率为85%。甲状腺低分化癌的局部复发及远处转移率均较高,主要转移部位为肺和脑。复发过程中伴随着肿瘤的去分化,预后情况趋向于恶性程度更高的未分化癌[13,15]。本组随访10例PDTC患者预后与文献报道基本相符[3,9,11]。3例术后局部复发,1例出现肺部转移,3例分别于术后4年、6年及7年死于肿瘤全身转移,其余3例随访时间短未见复发与转移。
综上所述,PDTC是一类比较少见且具有独特组织学形态及生物学行为的恶性肿瘤。从病理诊断角度而言,目前对该类肿瘤的组织学形态认识尚不足,导致误诊为甲状腺乳头状癌或未分化癌,进而造成临床对该类肿瘤的认识及治疗经验的欠缺。因此,本研究着重从病理方面分析PDTC组织形态特点、免疫组化、生物学行为及预后,为今后病理诊断与临床治疗带来新的认识。相信随着人们认识的深入与足够重视,将会有更多的患者得到正确的诊断与临床治疗。但遗憾的是目前样本量少,缺乏大样本系统化的研究。下一步工作重点在于收集大样本量病例从其细胞遗传学角度分析,找出其中的基因靶点,从而为临床诊断与治疗带来新的契机。
作者贡献:王富强进行文章的构思与设计,研究的实施与可行性分析,结果的分析与解释,撰写论文;王富强、谭改民进行数据收集、整理,论文的修订,负责文章的质量控制及审校;谭改民对文章整体负责,监督管理。
本文无利益冲突。
[1]DELELLIS R A,LLOYD R V,HEITZ P U,et al.Pathology and genetics of tumors of endocrine organs.WHO classification of tumors[M].Lyons:IARC Press,2004.
[2]VOIANTE M,COLLINI P,NIKIFOROV Y E,et al.Poorly differentiated thyroid carcinoma:the Turin proposal for the use of uniform diagnostic criteria and an algorithmic diagnostic approach[J].Am J Surg Pathol,2007,31(8):1256-1264.DOI:10.1097/PAS.0b013e3180309e6a.
[3]CHERKAOUI G S,GUENSI A,TALEB S,et al.Poorly differentiated thyroid carcinoma:a retrospective clinicopathological study[J].Pan Afr Med J,2015,22(21):137.DOI:10.11604/pamj.2015.21.137.6720.
[4]SAKAMOTO A,KASAI N,SUGANO H.Poorly differentiated carcinoma of the thyroid.A clinicopathologic entity for a high-risk group of papillary and follicular carcinomas[J].Cancer,1983,52(10):1849-1855.
[5]CARCANGIU M L,ZAMPI G,ROSAI J.Poorly differentiated ("insular") thyroid carcinoma.A reinterpretation of Langhans′ "wuchernde Struma"[J].Am J Surg Pathol,1984,8(9):655-668.
[6]孙健,李文波,杨堤,等.低分化甲状腺癌的临床病理[J].协和医学杂志,2012,3(1):72-76.DOI:10.3969/j.issn.1674-9081.2012.01.016. SUN J,LI W B,YANG D,et al.Clinicopathological characteristics of poorly differentiated thyroid carcinoma[J].Medical Journal of Peking Union Medical College Hospital,2012,3(1):72-76.DOI:10.3969/j.issn.1674-9081.2012.01.016.
[7]DETTMER M,SCHMITT A,STEINERT H,et al.Poorly differentiated thyroid carcinomas:how much poorly differentiated is needed[J].Am J Surg Pathol,2011,35(12):1866-1872.DOI:10.1097/PAS.0b013e31822cf962.
[8]孙健,杨堤,崔全才.低分化甲状腺癌临床病理学进展[J].中华病理学杂志,2011,40(12):850-853.DOI:10.3760/cma.j.issn.0529-5807.2011.12.016. SUN J,YANG D,CUI Q C.Clinical and pathological progress of poorly differentiation thyroid carcinoma [J].Chinese Journal of Pathology,2011,40(12):850-853.DOI:10.3760/cma.j.issn.0529-5807.2011.12.016.
[9]方铣华,葛明华,罗娟.甲状腺低分化癌(岛状癌)的病理诊断[J].肿瘤学杂志,2011,17(8):625-629. FANG X H,GE M H,LUO J.Pathological diagnosis of poorly differentiated ("insular") thyroid carcinoma [J].Journal of Oncology,2011,17(8):625-629.
[10]IBRAHIMPASIC T,GHOSSEIN R,CARLSON D L,et al.Outcome in patients with poorly differentiated thyroid carcinoma[J].J Clin Endocrinol Metab,2014,99(4):1245-1252.DOI:10.1210/jc.2013-3842.
[11]方铣华,郭振英,邓敏.25例甲状腺低分化癌的临床病理分析[J].肿瘤学杂志,2015,21(11):895-899.DOI:10.11735/j.issn.1671-170X.2015.11.B007. FANG X H,GUO Z Y,DENG M.Clinicopathological features analysis on 25 cases with poorly differentiated thyroid carcinoma[J].Journal of Chinese Oncology,2015,21(11):895-899.DOI:10.11735/j.issn.1671-170X.2015.11.B007.
[12]赵翠,李小龙,高明.低分化甲状腺癌的临床生物学特征及诊疗方法[J].肿瘤,2013,33(4):345-349.DOI:10.3781/j.issn.1000-7431.2013.04.009. ZHAO C,LI X L,GAO M.Clinical and biological characteristics and diagnosis and management of poorly-differentiated thyroid carcinoma[J].Tumor,2013,33(4):345-349.DOI:10.3781/j.issn.1000-7431.2013.04.009.
[13]姜琳,王可敬,韩春.甲状腺低分化癌的诊治进展[J].中国肿瘤,2015,24(6):461-465.DOI:10.11735/j.issn.1004-0242.2015.06.A006. JIANG L,WANG K J,HAN C.Research progress on diagnosis and treatment of poorly-differentiated thyroid carcinoma[J].Chinese Cancer,2015,24(6):461-465.DOI:10.11735/j.issn.1004-0242.2015.06.A006.
[14]李媛,霍真,陈杰.甲状腺癌病理诊断中的若干问题[J].中华病理学杂志,2014,43(5):348-352.DOI:10.3760/cma.j.issn.0529-5807.2014.05.017. LI Y,HUO Z,CHEN J.Some problems in pathological diagnosis of thyroid carcinoma [J].Chinese Journal of Pathology,2014,43(5):348-352.DOI:10.3760/cma.j.issn.0529-5807.2014.05.017.
[15]PHAY J E,RINGEL M D.Metastatic mechanisms in follicular cell-derived thyroid cancer[J].Endocr Relat Cancer,2013,20(6):R307-319.DOI:10.1530/ERC-13-0187.
(本文编辑:陈素芳)
ClinicopathologicalCharacteristicsofPoorlyDifferentiatedThyroidCarcinoma
WANG Fu-qiang,TAN Gai-min*
Department of Pathology,Anyang Tumor Hospital,Anyang 455000,China
*Corresponding author:TAN Gai-min,Physician;E-mail:tgm_521@163.com
ObjectiveTo investigate the clinicopathological characteristics of poorly differentiated thyroid carcinoma (PDTC).MethodsAll the 502 surgical specimens of thyroid cancer patients sent to Department of Pathology,Anyang Tumor Hospital between April 2009 and September 2016 for pathological examination were collected.After studying the Turin consensus criteria for PDTC,2 selected senior physicians reexamined the specimens,and 10 cases of PDTC were diagnosed.The clinical features,histological features and immunohistochemical results of 10 cases of PDTC were analyzed.ResultsThe 10 PDTC cases consisted of 3 males and 7 females〔age of onset:39-74 years old(median=61 years old)〕.All showed thyroid or neck mass,accompanied by swallowing pain or hoarse voice,and thyroid hypoechoic solid nodules detected by B-mode ultrasonography.Pathological examination found that the thyroid carcinoma cells presented solid and nested or patchy infiltrative growth with necrosis.Poorly differentiated part of the thyroid carcinoma lacked nuclear characteristics of papillary carcinoma but apparently with nuclear division,which might be accompanied by the components of well differentiated thyroid papillary carcinoma or follicular papillary carcinoma.Immunohistochemical examination demonstrated that,the expressions of AE1/AE3 and CK19 were positive in 10 cases,the expression of thyroid transcription factor 1(TTF-1) was positive in 8 cases,weakly positive focal thyroglobulin (TG) expression was found in 6 cases,regional positive expression of vimentin was found in 4 cases and Ki-67 proliferative index for all the cases was 10%-50%.The follow-up results showed that,3 had postoperative local recurrence;1 had pulmonary metastasis;due to systemic metastasis,1 died 4 years after the surgery,1 died 6 years after surgery,and 1 died 7 years after surgery;3 had no postoperative recurrence and metastasis.ConclusionPDTC is a unique and rare malignant thyroid tumor with special histological features.Its clinical prognosis is between well-differentiated and undifferentiated thyroid carcinomas.
Thyroid neoplasms;Pathology;Prognosis
R 736.1
B
10.3969/j.issn.1007-9572.2017.00.002
2017-02-14;
2017-07-10)
455000河南省安阳市肿瘤医院病理科
*通信作者:谭改民,医师;E-mail:tgm_521@163.com

