亚砷酸钠中毒对大鼠海马组织神经元及肾功能的影响研究
秦文娟,管东方,邢国强,史红娟,吕海龙,姜玉峰*
亚砷酸钠中毒对大鼠海马组织神经元及肾功能的影响研究
秦文娟1,管东方1,邢国强2,史红娟3,吕海龙2,姜玉峰1*
目的观察亚砷酸钠(NaAsO2)中毒对成年SD大鼠海马组织CA3区的神经元及肾脏形态学的影响。方法于2016年2—6月,48只12周龄雄性SPF级SD大鼠随机分为对照组及低、中、高染毒组,每组各12只。将NaAsO2用蒸馏水分别配制成5、10、20 mg/kg溶液分别供低、中、高染毒组大鼠自由饮用,对照组可自由饮用蒸馏水。建造染砷模型12周后,取4组大鼠脑组织海马部分和肾组织,HE染色光镜观察海马组织神经元与肾脏形态学改变;同时测定海马组织与肾组织中超氧化物歧化酶(SOD)活力、还原型谷胱甘肽(GSH)及丙二醛(MDA)含量。结果不同剂量染毒组海马组织神经元与对照组比较,神经元胞体形态欠规则,排列稀疏且数量减少,镜下可见大量脱落及坏死的神经元。不同剂量染毒组的肾组织较对照组出现病理性改变,例如变性、坏死、组织出现水肿及炎性细胞浸润等。4组大鼠海马组织及肾组织SOD活力、GSH和MDA含量比较,差异均有统计学意义(P<0.05);其中低、中、高染毒组海马组织及肾组织SOD活力、GSH含量均低于对照组,MDA含量均高于对照组;中、高染毒组海马组织及肾组织SOD活力、GSH含量均低于低染毒组,MDA含量均高于低染毒组;高染毒组海马组织及肾组织SOD活力、GSH含量均低于中染毒组,MDA含量均高于中染毒组(P<0.05)。结论NaAsO2中毒可使大鼠海马组织神经元形态结构及肾组织结构损伤,同时提示氧化应激可能参与NaAsO2致大鼠海马组织及肾组织的毒性作用。
砷中毒;CA3区,海马;肾功能;氧化应激
秦文娟,管东方,邢国强,等.亚砷酸钠中毒对大鼠海马组织神经元及肾功能的影响研究[J].中国全科医学,2017,20(26):3246-3250.[www.chinagp.net]
QIN W J,GUAN D F,XING G Q,et al.Impact of NaAsO2poisoning on rat hippocampal neurons and the kidney function[J].Chinese General Practice,2017,20(26):3246-3250.
地壳中的砷主要以化合物的形式存在,且自然分布不均匀。在中国、印度、法国、巴西等世界范围内的许多国家均出现过砷中毒的病例,主要原因是饮用水中砷含量过高[1]。由于人类慢性砷中毒的发生可以通过多种途径摄入砷化合物引起,目前砷中毒已经成为严重的公共卫生疾病[2]。人体摄入砷后可对机体的多种器官(尤其是皮肤、神经、脑、肝脏、肾脏)累及损害。砷中毒主要表现为神经症状和局部皮肤变化,并能影响某些基因的表达,从而导致机体功能障碍及紊乱[3],最终砷中毒可能发展为皮肤癌、肝癌、肾癌等多种内脏肿瘤性疾病[4]。研究表明,过量的砷可以通过血-脑脊液屏障进入中枢和周围神经系统引起神经损伤,主要表现为认知缺陷及周围神经损伤而产生的周围神经病变,并影响神经信号传导通路的表达与功能[4-5]。德国著名神经生物学家BARDE发现了分布在大脑皮质以及海马组织等部位的脑源性神经营养因子,该因子对机体学习和记忆具有促进作用[6],然而砷暴露却可能引起学习记忆方面的障碍[7]。在机体脏器方面,肾脏是砷及其代谢产物排泄的主要器官,目前已有相关报道关于砷代谢对肾脏及其他脏器损伤方面的研究[8-9]。本实验通过建立大鼠染毒模型,观察亚砷酸钠(NaAsO2)中毒对SD大鼠海马组织神经元及肾脏形态学结构的影响及氧化应激的作用,为砷中毒致神经系统损害及脏器损伤机制研究提供相关科学依据。
1 材料与方法
1.1 实验动物及分组 于2016年2—6月,选用48只12周龄雄性SPF级SD大鼠(新疆医科大学第一附属医院动物实验中心提供),体质量为(200±20)g,随机分为对照组及低、中、高染毒组,每组各12只。将NaAsO2用蒸馏水分别配制成5、10、20 mg/kg溶液分别供低、中、高染毒组大鼠自由饮用,对照组可自由饮用蒸馏水。4组大鼠均自由进食普通饲料。饲养环境需模拟自然昼夜条件,温度控制在(21±2)℃,湿度要求40%~60%。持续染毒大鼠12周。
1.2 实验仪器 NaAsO2(Sigma公司),超低温4 ℃离心机(Thermo公司),倒置相差显微镜(Olympus),全自动Bio-rad酶标仪(Bio-rad公司),超氧化物歧化酶(SOD)试剂盒、还原型谷胱甘肽(GSH)、丙二醛(MDA)试剂盒(南京建成生物工程研究所)。
1.3 取材及标本制备 大鼠连续染毒期满12周后,每组大鼠中随机取6只,10%水合氯醛溶液腹腔注射麻醉后,用4%多聚甲醛溶液经心脏再灌注进行固定。开颅取脑,于冰上迅速分离海马组织和大脑皮质组织,并快速用预冷0.9%氯化钠溶液冲洗组织3次,在1.5 ml EP管中加入适量4%多聚甲醛溶液,进一步固定,取海马组织,经组织脱水、二甲苯透明、石蜡包埋后,切片机进行冠状位切片,厚度5 μm,固定切片后进行HE染色,倒置相差显微镜观察海马组织CA3区神经元形态结构。大鼠脱颈处死后,快速分离肾组织并用4%多聚甲醛溶液固定,经脱水、透明、石蜡包埋后,进行连续冠状位切片,切片厚度 5 μm,固定切片后进行HE染色,倒置相差显微镜观察大鼠肾组织形态结构。
1.4 海马组织及肾组织中SOD活力和GSH、MDA含量测定 4组各剩余6只大鼠,脱颈处死后,于冰上速取海马组织和肾组织,加入到预冷的0.9%氯化钠溶液中,使用眼科剪尽快剪碎海马组织块和肾组织块,并在超声机超声制成10%组织匀浆液,4 ℃条件下,以1 000 r/min离心10 min,离心半径8 cm,取上清液待用。按照试剂说明书检测海马组织和肾组织中SOD活力和GSH、MDA含量。实验重复3次,取平均值。
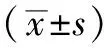
2 结果
2.1 一般情况 染毒期间,各组大鼠均未出现死亡等情况。对照组与低染毒组大鼠的毛发、空间活动以及精神状态等均无异常;中、高染毒组大鼠有明显的毛发色泽变暗及脱毛现象,表现为毛发稀疏,空间活动能力减弱。染毒后期高染毒组存在部分大鼠进食减少,空间活动迟缓,脱毛更严重。
2.2 光镜下海马组织CA3区神经元形态变化 对照组海马组织CA3区神经元多层密集整齐排列,胞体形态规整,胞质丰富,胞体与胞质界限清晰可见;低染毒组海马组织神经元较对照组数量及层数减少,排列不规律,可见部分细胞形态欠规则;中、高染毒组海马组织神经元层数锐减,排列稀疏,胞体形态不规则,部分细胞坏死脱落较明显(见图1,本文彩图详见本刊官网www.chinagp.net电子期刊相应文章)。

注:A为对照组,B为低染毒组,C为中染毒组,D为高染毒组
图1 4组大鼠大脑海马组织神经元形态变化(HE染色,×100)
Figure1 Morphology changes in hippocampal neurons stained by HE in four groups
2.3 大鼠肾组织形态学变化 对照组可见肾小球与肾小囊结构完整,上皮细胞排列规整,细胞之间界限清晰,核居正中;肾间质未见出血、水肿及炎性细胞浸润,结构正常。低染毒组可见肾上皮细胞出现水肿,毛细血管出现中度扩张,间质可见出血伴炎性细胞浸润。中、高染毒组肾上皮细胞明显水肿,肾小球毛细血管中、重度扩张出血,肾间质出血伴明显炎性细胞浸润(见图2)。
2.4 4组大鼠海马组织SOD活力、GSH和MDA含量比较 4组大鼠海马组织SOD活力、GSH和MDA含量比较,差异均有统计学意义(P<0.05);其中低、中、高染毒组海马组织SOD活力、GSH含量均低于对照组,MDA含量均高于对照组;中、高染毒组海马组织SOD活力、GSH含量均低于低染毒组,MDA含量均高于低染毒组;高染毒组海马组织SOD活力、GSH含量均低于中染毒组,MDA含量高于中染毒组,差异均有统计学意义(P<0.05,见表1)。
2.5 4组大鼠肾组织SOD活力、GSH和MDA含量比较 4组大鼠肾组织SOD活力、GSH和MDA含量比较,差异均有统计学意义(P<0.05);其中低、中、高染毒组肾组织SOD活力、GSH含量均低于对照组,MDA含量均高于对照组;中、高染毒组肾组织SOD活力、GSH含量均低于低染毒组,MDA含量均高于低染毒组;高染毒组肾组织SOD活力、GSH含量均低于中染毒组,MDA含量高于中染毒组,差异有统计学意义(P<0.05,见表2)。
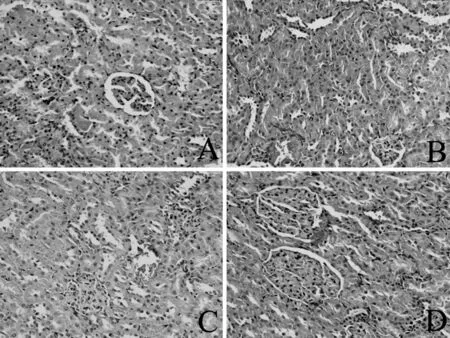
注:A为对照组,B为低染毒组,C为中染毒组,D为高染毒组
图2 4组大鼠肾脏病理变化(HE染色,×200)
Figure2 Pathology changes in renal tissues stained by HE in four groups

Table1 Comparison of activity of SOD,concentrations of GSH and MDA in hippocampal neurons tissue among four groups

组别例数SODGSHMDA对照组6193±69 20±0 301 81±0 12低染毒组6143±7a6 77±0 25a3 87±0 25a中染毒组6116±6ab4 27±0 30ab4 98±0 23ab高染毒组674±5abc2 73±0 15abc6 77±0 27abcF值200 248359 058251 275P值<0 05<0 05<0 05
注:与对照组比较,aP<0.05;与低染毒组比较,bP<0.05;与中染毒组比较,cP<0.05;SOD=超氧化物歧化酶,GSH=还原型谷胱甘肽,MDA=丙二醛

Table2 Comparison of activity of SOD,concentrations of GSH and MDA in renal tissue among four groups

组别例数SODGSHMDA对照组6147±109 47±0 550 91±0 12低染毒组690±6a6 00±0 46a2 46±0 16a中染毒组650±6ab3 13±0 25ab3 46±0 22ab高染毒组629±4abc0 39±0 06abc4 81±0 21abcF值168 199284 002251 009P值<0 05<0 05<0 05
注:与对照组比较,aP<0.05;与低染毒组比较,bP<0.05;与中染毒组比较,cP<0.05
3 讨论
目前砷中毒研究领域中慢性砷中毒的预防和治疗是较为严重且受卫生组织密切关注的问题。砷中毒不仅导致神经系统发生功能障碍,还会出现头晕、失眠、听力受损、焦虑、手足麻木以及记忆减退等一系列神经系统症状[10]。目前研究表明,砷对于大脑的神经毒性损伤作用的可能机制是由于神经元的死亡,实验发现神经元的死亡形式包括坏死和凋亡,而机体一些相关组织器官的坏死和凋亡同样也可以由砷引起[11]。对于机体而言,学习、记忆等高级神经纤维活动的关键脑区是大脑海马组织与大脑皮质区域。本研究结果显示,不同剂量染毒组大鼠海马组织SOD活力、GSH含量均低于对照组,表明砷可能透过血-脑脊液屏障,在机体脑组织中具有一定程度蓄积,伴随着染砷剂量增加,MDA含量明显高于对照组,与相关文献报道[12]一致。
大量试验研究表明,地方性砷中毒已经成为对人类危害极大的公共卫生疾病,可导致全身多种器官包括肾脏及其他脏器的损害[8-9]。肾脏近端小管部分的上皮细胞最易受外界有害物质的影响而发生变化。本实验HE染色结果显示:低、中、高染毒组大鼠肾上皮细胞发生变性、炎性细胞浸润,部分可见间质水肿以及出血等病理情况。与孙贵范[13]、杨运旗等[14]的研究结果报道一致。
首先,砷可以对脑组织抗氧化系统产生影响,可能是砷中毒对机体大脑海马组织神经元的损害作用机制之一。而神经组织在抗氧化系统失去平衡时氧自由基主要产生脂质过氧化反应,引起细胞损害,例如细胞缺血缺氧以及中毒等[15]。其次,有实验研究证实,砷可以通过诱导抗氧化酶活性缺陷,升高大脑组织神经元中脂质过氧化物水平,使MDA生成增加。而细胞内有害的过氧化物代谢产物反而能够被SOD清除,从而保护细胞不受脂质过氧化的损伤,证明组织细胞的抗氧化系统功能可以由SOD的活性间接反映。再者,能够使SOD等抗氧化酶在大脑皮质、纹状体、海马等部位降低的原因除GSH含量降低以及MDA含量增加,还包括脑中存在的自由基递质产生退化变性的因素[16]。其中SOD抗氧化损伤的机制可能是:砷诱导的氧自由基生成增加同时又与SOD结合;过多的氧自由基不仅造成过氧化物增加,也造成SOD和GSH减少[17-18]。马栓柱等[19]研究表明,随着NaAsO2染砷剂量的增加,大脑组织SOD活力随之减低。同时徐群清等[20]发现,砷中毒后大脑SOD、GSH水平明显低于阴性对照组,而MDA水平明显高于阴性对照组,本研究结果与之一致,均呈现剂量依赖性。
HE染色在临床病理诊断以及临床疾病治疗过程中不可或缺[21]。从大鼠HE染色切片观察,随着NaAsO2染砷剂量增加,导致机体大脑、肾脏损害的影响随着染砷剂量的增加而增强。
NaAsO2被大鼠摄入体内,对机体中枢神经系统毒性的作用机制主要为:直接损伤作用同时影响机体的抗氧化系统功能,砷毒性改变了大脑内神经化学递质传递及细胞凋亡方式,同时使肾脏砷毒性损伤增加,肾脏上皮细胞发生病变,脏器组织功能结构产生障碍和紊乱。严重影响大鼠体内抗氧化系统的平衡,使SOD活力、GSH含量下降,MDA含量升高,使机体抗氧化能力减弱。可见氧化应激可能是NaAsO2致大鼠海马组织神经元及肾毒性作用的机制之一,并同时为砷中毒发病机制的相关研究提供了切实的实验依据。
作者贡献:秦文娟、吕海龙、姜玉峰进行文章的构思与设计;秦文娟、管东方、邢国强、史红娟、吕海龙、姜玉峰进行研究的实施与可行性分析;秦文娟、管东方、邢国强、史红娟进行数据收集;秦文娟进行数据整理、撰写论文;秦文娟、邢国强、史红娟进行统计学处理;秦文娟、吕海龙、姜玉峰进行结果的分析与解释、论文的修订;吕海龙、姜玉峰负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
[1]李玉飞,康朝胜,臧贵勇,等.NSE在慢性砷中毒大鼠海马CA3区的表达[J].神经解剖学杂志,2010,26(1):93-97. LI Y F,KANG C S,ZANG G Y,et al.NSE expression of hippocampal CA3 area in rats following chronic arsenic poisoning exposure[J].Chinese Journal of Neuroanatomy,2010,26(1):93-97.
[2]王艳萍,姬林松,樊宏伟,等.针刺治疗对地方性氟、砷中毒患者肝功能、免疫功能的影响[J].辽宁中医杂志,2016,59(8):1728-1730. WANG Y P,JI L S,FAN H W,et al.Acupuncture treatment of liver function in patients with endemic fluorine,arsenic poisoning,the influence of immune function[J].Liaoning Journal of Traditional Chinese Medicine,2016,59(8):1728-1730.
[3]曾丹,罗鹏,丁锴,等.亚砷酸钠致大鼠肝功能损伤和肝纤维化形成及其机制探讨[J].环境与健康杂志,2015,32(10):859-862,941.DOI:10.16241/j.cnki.1001-5914.2015.10.004. ZENG D,LUO P,DING K,et al.Liver function damage and mechanism of fibrosis induced by sodium arsenite in rats[J].Journal of Environmental and Health,2015,32(10):859-862,941.DOI:10.16241/j.cnki.1001-5914.2015.10.004.
[4]苏菁,李明艳,蒋守芳,等.氟、砷染毒对大鼠脑组织CREB mRNA及蛋白表达的影响[J].环境与职业医学,2013,30(9):707-709. SU J,LI M Y,JIANG S F,et al.Effects of individual and combined exposure to fluoride and arsenic on expression of CREB mRNA and protein in rat brain[J].Journal of Environmental & Occupational Medicine,2013,30(9):707-709.
[5]陈志勇,王玲,潘振伟,等.三氧化二砷对海马神经元细胞内钙离子浓度的影响[J].哈尔滨医科大学学报,2007,41(1):16-18.DOI:10.3969/j.issn.1000-1905.2007.01.006. CHEN Z Y,WANG L,PAN Z W,et al.Effects of arsenic trioxide on cytosolic calcium in cultured hippocampal neurons[J].Journal of Harbin Medical University,2007,41(1):16-18.DOI:10.3969/j.issn.1000-1905.2007.01.006.
[6]LU Y,CHRISTIAN K,LU B.BDNF:a key regulator for protein synthesis-dependent LTP and long-term memory?[J].Neurobiol Learn Mem,2008,89(3):312-323.DOI:10.1016/j.nlm.2007.08.018.
[7]BARCO A,BRAMBILLA R,ROSENBLUM K.Neurobiology of learning and memory.editorial[J].Neurobiol Learn Mem,2015,124:1-2.DOI:10.1016/j.nlm.2015.08.001.
[8]洪峰.无机砷的肾脏损伤作用研究进展[J].国外医学(卫生学分册),2002,29(1):27-30. HONG F.Research progress of inorganic arsenic in kidney damage[J].Foreign Medical Sciences(Section Hygiene),2002,29(1):27-30.
[9]李远慧,朱筑霞,李娜,等.慢性砷中毒对肾小球细胞凋亡形态学影响[J].中国公共卫生,2008,24(9):1149-1150.DOI:10.3321/j.issn:1001-0580.2008.09.049. LI Y H,ZHU Z X,LI N,et al.Effect of chronic arsenic poisoning on configuration and apoprosis of renal glomerulus cells[J].Chinese Journal of Public Health,2008,24(9):1149-1150.DOI:10.3321/j.issn:1001-0580.2008.09.049.
[10]李玉飞,康朝胜,藏贵勇,等.慢性砷中毒对大鼠海马CA3超微结构的影响[J].环境与健康杂志,2008,25(6):517-519,565.DOI:10.3969/j.issn.1001-5914.2008.06.014. LI Y F,KANG C S,ZANG G Y,et al.Effect of chronic arsenism on ultra-structure of rats′ hippocampus CA3[J].Journal of Environmental and Health,2008,25(6):517-519,565.DOI:10.3969/j.issn.1001-5914.2008.06.014.
[11]毕伟东,王成艳,靳立巾,等.不同剂量砷对大鼠大脑皮层乙酰胆碱脂酶活性的影响[J].微量元素与健康研究,2002,19(4):12-13,29.DOI:10.3969/j.issn.1005-5320.2002.04.004. BI W D,WANG C Y,JIN L J,et al.Effect of difference dose arsenite on AChE of cerebral cortex in rat[J].Studies of Trace Elements and Health,2002,19(4):12-13,29.DOI:10.3969/j.issn.1005-5320.2002.04.004.
[12]周秀,张爱民,张桂芬,等.肝纤维化四项对各型肝病检测的临床价值[J].放射免疫学杂志,2008,21(5):424-425.DOI:10.3969/j.issn.1008-9810.2008.05.027. ZHOU X,ZHANG A M,ZHANG G F,et al.Clinical value of hepatic fibrosis four items for various liver disease detection[J].Journal of Radioimmunology,2008,21(5):424-425.DOI:10.3969/j.issn.1008-9810.2008.05.027.
[13]孙贵范.砷对小鼠肾脏毒性机理的探讨[J].中国地方病学杂志,1998,17(5):10-12. SUN G F.Arsenic in mice kidney toxicity mechanism study[J].Chinese Journal of Endemiology,1998,17(5):10-12.
[14]杨运旗,孙兰英,黄晓欣,等.慢性燃煤砷污染所致肾损害的临床病理观察[J].中国地方病学杂志,2003,22(4):72-73.DOI:10.3760/cma.j.issn.1000-4955.2003.04.025. YANG Y Q,SUN L Y,HUANG X X,et al.The clinically pathologic investigation of renal function impairment by aresnism caused by coal-burning pollution[J].Chinese Journal of Endemiology,2003,22(4):72-73.DOI:10.3760/cma.j.issn.1000-4955.2003.04.025.
[15]XU W,CHI L,ROW B W,et al.Increased oxidative stress is associated with chronic intermittent hypoxia-mediated brain cortical neuronal cell apoptosis in a mouse model of sleep apnea[J].Neuroscience,2004,126(2):313-323.DOI:10.1016/j.neuroscience.2004.03.055.
[16]BHADAURIA S,FLORA S J.Response of arsenic-induced oxidative stress,DNA damage,and metal imbalance to combined administration of DMSA and monoisoamyl-DMSA during chronic arsenic poisoning in rats[J].Cell Biol Toxicol,2007,23(2):91-104.DOI:10.1007/s10565-006-0135-8.
[17]LII C K,LIN A H,LEE S L,et al.Oxidative modifications of proteins by sodium arsenite in human umbilical vein endothelial cells[J].Environ Toxicol,2011,26(5):459-471.DOI:10.1002/tox.20572.
[18]MITTAL M,FLORA S J.Effects of individual and combined exposure to sodium arsenite and sodium fluoride on tissue oxidative stress,arsenic and fluoride levels in male mice[J].Chem Biol Interact,2006,162(2):128-139.DOI:10.1016/j.cbi.2006.05.018.
[19]马栓柱,许秀举,罗绥兰,等.染砷大鼠尿砷和血清超氧化物歧化酶的变化[J].中国地方病学杂志,2006,25(6):720. MA S Z,XU X J,LUO S L,et al.Changes of urine arsenic and serum superoxide dismutase in arsenic exposed rats[J].Chinese Journal of Endemiology,2006,25(6):720.
[20]徐群清,梁峰,莫少泽,等.砷中毒对小鼠脑细胞内钙离子浓度影响的研究[J].微量元素与健康研究,2006,23(4):8-9,12. XU Q Q,LIANG F,MO S Z,et al.Effect of arseniasis in intracellular free Ca2+concentration in isolated mouse brain cell[J].Studies of Trace Elements and Health,2006,23(4):8-9,12.
[21]XI S,JIN Y,LV X,et al.Distribution and speciation of arsenic by transplacental and early life exposure to inorganic arsenic in offspring rats[J].Biol Trace Elem Res,2010,134(1):84-97.DOI:10.1007/s12011-009-8455-1.
(本文编辑:贾萌萌)
ImpactofNaAsO2PoisoningonRatHippocampalNeuronsandtheKidneyFunction
QIN Wen-juan1,GUAN Dong-fang1,XING Guo-qiang2,SHI Hong-juan3,LYU Hai-long2,JIANG Yu-feng1*
1.Department of Human Anatomy and Histoembryology,Shihezi University School of Medicine,Shihezi 832002,China 2.Department of Hepatobiliary Surgery,the First Affiliated Hospital of the Medical College,Shihezi University,Shihezi 832002,China 3.School of Medicine,Quzhou College of Technology,Quzhou 324000,China
*Corresponding author:JIANG Yu-feng,Professor,Main research in cell signal and conduction;E-mail:yufengjiang03@126.com
ObjectiveTo observe the changes in histology and morphology of hippocampal CA3 region neurons and renal tissues in adult SD rats after NaAsO2poisoning.MethodsThis study was conducted from February to June in 2016.Forty-eight male SD rats(SPF grade) aged 12 weeks were randomly assigned to the normal control group,low-,medium-and high-dose NaAsO2infected groups with 12 in each,respectively treated by freely drinking of distilled water,5,10,20 mg/kg NaAsO2solution for an intervention of 12 weeks.All the rats were sacrificed and the hippocampal and kidney tissues were taken at the end of intervention.Light microscope was used to observe the morphology changes in hippocampal and renal tissues stained by HE.The activity of superoxide dismutase(SOD) and concentrations of reduced glutathione(GSH) and malondialdehyde(MDA) in these tissues were determined.ResultsThe observation showed that,compared with the control group,in hippocampal region of the NaAsO2infected groups,the nerve cells were irregular with decreased number and enlarged interspaces,moreover,a large number of exfoliated and necrotic nerve cells could be seen;pathological changes were found in the renal tissues,including degeneration,necrosis,edema and inflammatory cell infiltration.The activity of SOD and concentrations of GSH and MDA in hippocampal and renal tissues differed significantly among the four groups(P<0.05),specifically,the NaAsO2infected groups had lower activity of SOD and concentration of GSH but higher concentration of MDA in hippocampal and renal tissues than the control group did;the medium-and high-dose NaAsO2infected groups had lower activity of SOD and concentration of GSH but higher concentration of MDA in hippocampal and renal tissues than the low-dose NaAsO2infected group did;the high-dose NaAsO2infected group had lower activity of SOD and concentration of GSH but higher concentration of MDA in hippocampal and renal tissues than the medium-dose NaAsO2infected group did(P<0.05).ConclusionNaAsO2poisoning can cause rat hippocampal neurons morphology and renal tissue structure damage,and oxidative stress may be involved in the process.
Arsenic poisoning;CA3 region,hippocampal;Kidney function;Oxidative stress
国家自然科学基金资助项目(81360410)
R 595.2
A
10.3969/j.issn.1007-9572.2017.04.y01
2017-02-15;
2017-03-20)
1.832002新疆石河子市,石河子大学医学院人体解剖与组织胚胎学教研室
2.832002新疆石河子市,石河子大学第一附属医院肝胆外科
3.324000浙江省衢州市,衢州职业技术学院医学院
*通信作者:姜玉峰,教授,主要从事细胞信号与传导研究;E-mail:yufengjiang03@126.com

