汉滩病毒糖蛋白与人溶酶体相关膜蛋白重组真核表达载体的构建表达鉴定及作为基因疫苗的免疫安全性评价
张锦鹏,张冠文,宣国云,孟 强,谢文宇,高 宏,姜东伯,杨 琨
(第四军医大学:1基础部免疫学教研室,2学员旅,陕西西安710032)
汉滩病毒糖蛋白与人溶酶体相关膜蛋白重组真核表达载体的构建表达鉴定及作为基因疫苗的免疫安全性评价
张锦鹏1,2,张冠文1,2,宣国云1,2,孟 强1,2,谢文宇1,2,高 宏1,2,姜东伯1,杨 琨1
(第四军医大学:1基础部免疫学教研室,2学员旅,陕西西安710032)
目的:利用pVAX1真核表达载体构建汉滩病毒糖蛋白Gn及Gc与人溶酶体相关膜蛋白LAMP分子的重组真核表达载体,鉴定其在人真核细胞系HeLa中的表达.大量抽提去内毒素质粒,皮下注射Balb/c小鼠后初步对目标载体作为基因疫苗进行安全性评价.方法:利用PCR的方法分别以汉滩病毒编码糖蛋白M片段的cDNA为模板,扩增目的基因Gn和Gc,构建重组真核表达载体pVAX-Gn、pVAX-LAMP/Gn、pVAX-Gc和pVAX-LAMP/Gc,并进行酶切鉴定和Sanger测序.同时构建带有EGFP标签的四种重组质粒,LipofectamineTM2000脂质体将重组质粒瞬时转染HeLa细胞,通过荧光显微镜观察结合免疫荧光检测目的蛋白的表达.抽提高纯度去内毒素的重组质粒,采用皮下注射免疫小鼠,并取重要脏器进行组织学分析.结果:双酶切鉴定和测序结果证实目的基因Gn、LAMP/Gn、Gc和LAMP/Gc成功克隆入真核载体pVAX 1,基因与原序列一致.荧光显微镜观察连有EGFP的表达载体转染的HeLa细胞,可见明显的绿色荧光,瞬时转染后特异性抗体免疫荧光检测到目的蛋白的表达.安全性评价结果显示Balb/c小鼠耐受性良好,多次注射后无明显组织形态学改变.结论:成功构建了重组嵌合载体pVAX-Gn、pVAX-LAMP/Gn、pVAX-Gc和pVAX-LAMP/Gc,并在真核细胞系中表达出目的蛋白,免疫小鼠显示了良好的安全性,为后期对汉滩病毒的靶向基因疫苗的研究奠定了基础.
汉滩病毒包膜蛋白;LAMP分子;载体构建;蛋白表达鉴定;安全性评价
0 引言
肾综合征出血热(haemorrhagic fever with renal syndrome,HFRS)是由汉滩病毒引起的以发热、出血、急性肾功能损伤为主要临床表现的综合征,亦称流行性出血热.全球每年约有10万人发病,死亡率达5%~15%[1].我国是世界上发病最为严重的国家,占总发病人数的90%以上,严重威胁我国居民的生命健康与安全.而目前临床上尚无针对HFRS的特异性治疗药物,因此疫苗被认为是控制该疾病最为行之有效的办法.目前我国临床上用于预防HFRS的疫苗是双价灭活疫苗,它可以诱导产生一定滴度的中和抗体,对机体产生较为有效的保护作用[2-3].然而,该疫苗在诱导细胞免疫应答和长期记忆免疫应答方面存在不足,大大降低了它在公共卫生安全领域中的推广价值[4-5].现如今基因疫苗因能够模拟病原体自然感染来激活体内免疫应答,并在生产、储存、运输方面具有优势而成为疫苗研制领域中的热点.
汉滩病毒是布尼亚病毒科的一种单股负性RNA,其基因组分为三个片段,分别为大(L)、中(M)、小(S).其中M片段全长仅有一个开放阅读框编码包膜糖蛋白复合体,该前体蛋白在细胞内质网被切割加工成Gn与Gc两个糖蛋白[6-7].Gn与Gc构成病毒吸附蛋白,可识别结合细胞表面病毒受体[8],并可以刺激机体产生中和抗体.在病毒对机体细胞的侵袭与感染过程中发挥重要作用.相关文献报道,人在自然感染汉滩病毒时,Gn与Gc可诱导机体的特异性免疫应答,生成一定量的血清中和抗体[5].中和抗体在清除体内病毒这一过程中扮演重要角色,提示汉滩病毒的Gn与Gc在建立机体对抗病毒感染发病的特异性免疫保护机制中发挥重要作用,可做为DNA疫苗的研究靶点[9].
溶酶体相关膜蛋白(lysosome-associated membrane protein,LAMP)是位于溶酶体膜上的Ⅰ型穿膜蛋白,由N端溶酶体内腔部分、疏水穿膜部分及C末端短胞浆尾构成[10].LAMP分子合成后,其保守的短胞浆尾通过穿膜-胞浆区定向地结合亚细胞结构——内吞体/溶酶体,主要发挥靶向转运至溶酶体的重要功能.当编码目的抗原的基因插入到LAMP分子编码溶酶体内腔部分和胞浆尾的基因之间构成嵌合蛋白时,利用LAMP分子的导向作用,可将LAMP融合蛋白中目的抗原直接携带进入主要组织相容性复合体(major histocompatibility complex,MHC)Ⅱ类分子器室(MHC classⅡ compartment,MIIC),从而可实现DNA疫苗所表达蛋白从内源性抗原的MHC-Ⅰ类加工途径向外源性抗原的MHC-Ⅱ类加工提呈途径的转化[11-12].本研究利用汉滩病毒汉滩型(Hantaan virus,HTNV)包膜糖蛋白Gn和Gc联合LAMP靶向作用,构建了新型重组嵌合表达载体,在真核细胞系中成功表达并显示了良好的安全性,为进一步研究新型出血热基因疫苗奠定了基础.
1 材料和方法
1.1 材料 pVAX-LAMP为本实验室前期构建保存,含有LAMP分子全长序列的P43-LAMP载体为美国约翰·霍普金斯大学馈赠.pVAX 1真核表达载体、LipofectamineTM2000购自美国Invitrogen公司.引物合成委托北京奥科生物技术有限责任公司完成.DNA测序委托生工生物技术(上海)有限公司完成.限制性核酸内切酶、PCR试剂均购自TaKaRa公司,胶回收试剂盒、小量抽提质粒试剂盒购自生工生物技术(上海)有限公司,去内毒素质粒大提试剂盒购自北京天根生物有限公司,新生牛血清购自杭州四季青责任有限公司,细胞培养基1640为本实验室配制.HeLa细胞株为本实验室保存.全长HTNV M片段cDNA、Gn蛋白单克隆抗体由本校微生物教研室提供.三级实验动物Balb/c小鼠购自第四军医大学实验动物中心.文中百分比所指代的除化学药物的溶液配置为质量分数外,其余均为体积比.
1.2 方法
1.2.1 目的基因的获取 参考HTNV M片段cDNA基因全序列,使用Primer5.0设计引物,并送北京奥科公司合成.以HTNV M片段cDNA为模板,在Gn、Gc,上游5'端引入核酸酶切位点KpnI/EcoRI,下游3'端引入Xbal I/Xhol I,扩增Gn、Gc.反应体系参照TaKaRa公司rTaq酶操作流程,总体系50 μL;反应条件:95℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸1.5 min,重复30个循环;最后72℃延伸7 min.相关扩增引物见表1,酶切位点及载体构建策略见表1.
1.2.2 重组载体的构建与鉴定 将上述PCR方法得到的Gn、Gc基因、pVAX载体、pVAX-LAMP分别以Kpn I、Xba I和Xho I、EcoR I双酶切,琼脂糖凝胶电泳后,胶回收目的基因和线性载体,经T4DNA连接酶定向连接.构建pVAX-Gn、pVAX-LAMP/Gn、pVAXGc和pVAX-LAMP/Gc表达载体.同时构建pVAXGc-EGFP和pVAX-LAMP/Gc-EGFP用于检测目的蛋白的表达(图1).转化感受态细菌经卡那霉素筛选阳性克隆,小提质粒,对重组质粒行双酶切鉴定,并送至生工生物(上海)生物技术公司测序.

表1 构建重组质粒所需引物
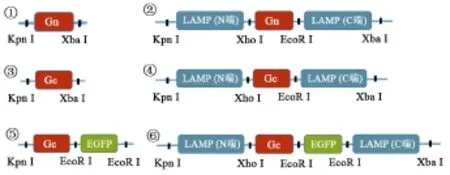
图1 重组质粒构建示意图
1.2.3 真核细胞转染 按转染试剂说明书于转染前一天取对数期Hela细胞1×106接种于六孔板,37℃、5%CO2孵箱内培养于含 10%新生牛血清的 PRMI1640培养基中,待细胞融合达70%时,将提取的去内毒素质粒采用脂质体法转染细胞,转染前1 h换用无血清不完全PRMI1640使细胞同步化,后各取4 μg重组质粒pVAX-Gn、pVAX-LAMP/Gn、pVAX-Gc和pVAX-LAMP/Gc与10 μL LipofectamineTM2000脂质体混匀后缓慢加入细胞中,6~8 h后换用10%新生牛血清的PRMI1640培养基中继续培养48 h,分别取培养上清、细胞裂解上清待检目的蛋白的表达,另设两个对照组细胞:转染pVAX-LAMP质粒的阳性对照组及不转染任何质粒的阴性对照组.此外将pVAX-Gc-EGFP和pVAX-LAMP/Gc-EGFP以同样的方法转染Hela细胞后,荧光显微镜观察融合蛋白表达.
1.2.4 免疫荧光 ①取出重组质粒转染后的细胞爬片放在24孔板中,弃去悬浮液,冷 PBS浸泡三遍.②固定:4%冷的多聚甲醛室温固定15 min,PBS洗三遍.③打孔通透:0.5%Triton通透15 min,PBS洗三遍.④封闭:与3%BSA-PBS室温封闭30 min,PBS洗三遍.⑤一抗孵育:用鼠单克隆抗体作为一抗过夜,PBS洗三遍.⑥二抗孵育:用FITC标记的山羊抗小鼠抗体作为二抗,室温10 min(避光),PBS洗三遍.蒸馏水洗掉PBS.⑦用DAPI室温复染细胞核10 min, PBS洗三遍,然后荧光共聚焦显微镜直接照荧光片.
1.2.5 安全性分析 20只成年雌性Balb/c小鼠,按照6、7、7分成三组,分别对应安慰剂、pVAX-LAMP/ Gc、pVAX-LAMP/Gc,采取尾根部皮下接种的策略,按50 μg/只/次的剂量给药,第三次接种两周后取各组小鼠心、肝、脾、肺、肾、脑等重要脏器组织进行HE染色,观察有无病理性改变.自第一次皮下接种连续三个月内对实验对象进行体质量监测,比较各组间是否存在差异.
1.3 统计学处理 体质量检测数据使用均数±标准差(mean±SD)的呈现方法,与正常安慰剂组的比较选择student-t检验方法.
2 结果
2.1 重组质粒的构建及鉴定 双酶切结果显示,重组质粒pVAX-Gn、pVAX-Gc、pVAX-LAMP/Gn、pVAXLAMP/Gc分别经Kpn I、Xba I和Xho I、EcoR I双酶切后,10 g/L琼脂糖电泳分别可得到约1600 bp、1500 bp的条带,大小与预期一致,测序结果显示序列完全正确,表明重组质粒构建成功(图2).
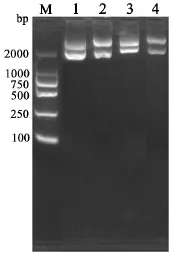
图2 重组质粒的酶切鉴定
2.2 EGFP标签鉴定Gc相关融合蛋白的表达 将连有EGFP的重组质粒pVAX-Gc-EGFP和pVAXLAMP/Gc-EGFP以采用脂质体瞬时转染Hela细胞48 h后,在荧光显微镜下,观察到明显的绿色荧光,说明该重组质粒在真核细胞中有明显的蛋白表达(图3).

图3 荧光显微镜观察Gc-EGFP和LAMP/Gc-EGFP融合蛋白在HeLa细胞中的表达,倒置相差荧光显微镜40倍拍摄
2.3 免疫荧光检测Gn相关蛋白的表达 重组质粒瞬时转染HeLa细胞,Gn特异性小鼠单克隆抗体和FITC标记的山羊抗小鼠的抗体进行染色后,通过荧光共聚焦显微镜观察到pVAX-Gn、pVAX-LAMP/Gn在真核细胞系中成功表达(图4).

图4 免疫荧光显微镜观察Gn和LAMP/Gn的表达
2.4 安全性分析 疫苗接种组小鼠心、肝、脾、肺、肾、脑等组织在HE染色后,各重要器官未见病理性改变(图5).为期三个月的体质量监测结果显示,皮下接种两种重组质粒对小鼠体质量没有影响(表2、图6).

表2 免疫接种前后小鼠体质量变化(g,x ±SD)
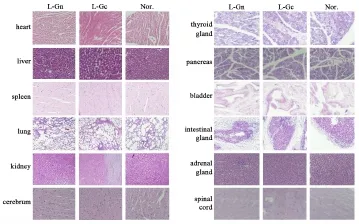
图5 安全性评价小鼠重要脏器组织病理学分析
图6 免疫接种后三个月小鼠体质量变化
3 讨论
我国是世界上汉滩病毒引起肾综合征出血热最严重的国家,现临床使用的灭活疫苗虽能诱导机体产生一定量的中和抗体[2-3],但仍存在免疫原性低,难获得特异性细胞免疫应答和长效免疫记忆能力的问题.现国内外研究主要集中于其基因疫苗的研制,并获得了一定进展[13-14],但也遇到传统基因疫苗表达内源性抗原,只能通过MHC I类途径活化CD8+T细胞,不能有效活化CD4+T细胞,缺乏长效记忆免疫等问题[15].
前期的研究证实,将编码抗原的基因插入到LAMP分子编码溶酶体内腔部分和胞浆尾基因之间构成嵌合体时,利用LAMP分子的靶向作用,可使抗原蛋白直接进入MIIC,实现MHC I类途径向MHC II类途径转化,克服传统DNA疫苗表达内源性蛋白单纯活化MHC I类抗原提成加工途径、单纯诱导特异性细胞免疫应答这一缺陷[16],同时活化CD4+T细胞高表达CD40L,作为B细胞活化的第二信号使之分化为浆细胞分泌抗体,介导体液免疫应答,此外活化的CD4+T细胞可以分泌大量的细胞因子来刺激其他免疫细胞活化、增殖、分化,从而也可获得长效记忆免疫效应,提高对疾病的预防和治疗效果[17-18].
本研究通过分子克隆手段,利用汉滩病毒糖蛋白cDNA成功构建重组真核表达载体pVAX-LAMP/Gn、pVAX-LAMP/Gc,瞬时转染真核细胞检测到目的融合蛋白成功表达.值得注意的是,在鉴定目的蛋白表达的策略选择上,本课题通过倒置相差荧光显微镜对EGFP标签蛋白表达的直接观察法确认糖蛋白Gc相关载体的表达,而在糖蛋白Gn相关分子的表达鉴定中改用免疫荧光的方法,这是因为汉滩病毒属于布尼亚病毒属,目前发现该属中绝大多数病毒的糖蛋白Gn可以激活宿主细胞内部的自噬机制,使得具有该分子的融合蛋白无法在细胞内稳定存在,从而很难通过荧光标签蛋白的观察或粗提蛋白的印迹实验检测到目的蛋白的表达[19-20].目前该领域对Gn的表达鉴定方法公认为免疫荧光法[21],因此本研究通过单克隆抗体制备方法获得Gn特异性的小鼠来源的IgG,采取免疫荧光法成功鉴定了单纯和LAMP融合Gn蛋白在真核细胞中的表达.结合初步安全性评价的良好结果,该研究为后续新型汉滩病毒基因疫苗的研究奠定了坚实的基础.
[1]Avic-upanc T,Saksida A,Korva M.Hantavirus infections[J].Clin Microbiol Infect,2015,S1198-743X(15)00536-4.
[2]Song JY,Woo HJ,Cheong HJ,et al.Long-term immunogenicity and safety of inactivated Hantaan virus vaccine(HantavaxTM)in healthy adults[J].Vaccine,2016,34(10):1289-1295.
[3]Szabó R.Antiviral therapy and prevention against hantavirus infections[J].Acta Virol,2017,61(1):3-12.
[4]Schmaljohn C.Vaccines for hantaviruses[J].Vaccine,2009,27 (Suppl 4):D61-D64.
[5]Schmaljohn CS.Vaccines for hantaviruses:progress and issues[J].Expert Rev Vaccines,2012,11(5):511-513.
[6]Muyangwa M,Martynova EV,Khaiboullina SF,et al.Hantaviral proteins:structure,functions,and role in Hantavirus infection[J].Front Microbiol,2015,6:1326.
[7]Battisti AJ,Chu YK,Chipman PR,et al.Structural studies of Hantaan virus[J].J Virol,2011,85(2):835-841.
[8]Guardado-Calvo P,Bignon EA,Stettner E,et al.Mechanistic insight into bunyavirus-induced membrane fusion from structure-function analyses of the hantavirus envelope glycoprotein Gc[J].PLoS Pathog,2016,12(10):e1005813.
[9]Boudreau EF,Josleyn M,Ullman D,et al.A Phase 1 clinical trial of Hantaan virus and Puumala virus M-segment DNA vaccines for hemorrhagic fever with renal syndrome[J].Vaccine,2012,30(11):1951-1958.
[10]Marques ET Jv,Chikhlikar P,de Arruda LB,et al.HIV-1 p55Gag encoded in the lysosome-associated membrane protein-1 as a DNA plasmid vaccine chimera is highly expressed,traffics to the major histocompatibility class II compartment,and elicits enhanced immune responses[J].J Biol Chem,2003,278(39):37926-37936.
[11]Anwar A,Chandrasekaran A,Ng ML,et al.West Nile premembrane-envelope genetic vaccine encoded as a chimera containing the transmembrane and cytoplasmic domains of a lysosome-associated membrane protein:increased cellular concentration of the transgene product,targeting to the MHC II compartment,and enhanced neutralizing antibody response[J].Virology,2005,332(1):66-77.
[12]Chikhlikar P,Barros de Arruda L,Maciel M,et al.DNA encoding an HIV-1 Gag/human lysosome-associated membrane protein-1 chimera elicits a broad cellular and humoral immune response in Rhesus macaques[J].PLoS One,2006,1:e135.
[13]Ma Y,Yuan B,Zhuang R,et al.Hantaan virus infection induces both Th1 and ThGranzyme B+cell immune responses that associated with viral control and clinical outcome in humans[J].PLoS Pathog,2015,11(4):e1004788.
[14]Hooper JW,Moon JE,Paolino KM,et al.A Phase 1 clinical trial of Hantaan virus and Puumala virus M-segment DNA vaccines for haemorrhagic fever with renal syndrome delivered by intramuscular electroporation[J].Clin Microbiol Infect,2014,20 Suppl 5:110-117.
[15]Yang K,Sun K,Srinivasan KN,et al.Immune responses to T-cell epitopes of SARS CoV-N protein are enhanced by N immunization with a chimera of lysosome-associated membrane protein[J].Gene Ther,2009,16(11):1353-1362.
[16]Nakanishi Y,Lu B,Gerard C,et al.CD8(+)T lymphocyte mobilization to virus-infected tissue requires CD4(+)T-cell help[J].Nature,2009,462(7272):510-513.
[17]Rowell JF,Ruff AL,Guarnieri FG,et al.Lysosome-associated membrane protein-1-mediated targeting of the HIV-1 envelope protein to an endosomal/lysosomal compartment enhances its presentation to MHC class II-restricted T cells[J].J Immunol,1995,155(4):1818-1828.
[18]Dhalia R,Maciel M Jr,Cruz FS,et al.Membrane and envelope virus proteins co-expressed as lysosome associated membrane protein (LAMP)fused antigens:a potential tool to develop DNA vaccines against flaviviruses[J].An Acad Bras Cienc,2009,81(4):663-669.
[19]Ganaie SS,Mir MA.The role of viral genomic RNA and nucleocapsid protein in the autophagic clearance of hantavirus glycoprotein Gn[J].Virus Res,2014,187:72-76.
[20]Hussein IT,Cheng E,Ganaie SS,et al.Autophagic clearance of Sin Nombre hantavirus glycoprotein Gn promotes virus replication in cells[J].J Virol,2012,86(14):7520-7529.
[21]Taylor SL,Frias-Staheli N,Garcia-Sastre A,et al.Hantaan virus nucleocapsid protein binds to importin alpha proteins and inhibits tumor necrosis factor alpha-induced activation of nuclear factor kappa B[J].J Virol,2009,83(3):1271-1279.
Construction, identification and immune safety of recombinant eukaryotic expression vector through fusing Hantavirus glycoproteinswith lysosome-associated membrane protein
ZHANG Jin-Peng1,2,ZHANG Guan-Wen1,2,XUAN Guo-Yun1,2,MENG Qiang1,2,XIE Wen-Yu1,2,GAO Hong1,2,JIANG Dong-Bo1,YANG Kun1
1Department of Immunology,2Brigade of Cadet,the Fourth Military Medical University,Xi'an 710032,China
AIM:To construct recombinant eukaryotic expression vector of pVAX-Gn、pVAX-LAMP/Gn、pVAX-Gc and pVAXLAMP/Gc through pVAX1,identify the expression of chimeric protein in Hela cells and evaluate the safety of targeting vector.METHODS:The whole Gn and Gc gene were amplified from the HTNV cDNA by polymerase chain reaction.And then Gn,Gc and LAMP1 chimeric constructs were constructed and termed pVAX-Gn,pVAX-LAMP/Gn,pVAX-Gc and pVAX-LAMP/Gc.Then,the restriction enzyme analysis and Sanger sequencing were performed.The recombinant vectors were transiently transfected into HeLa cells with LipofectamineTM2000 transfection reagent.The expression of chimeric protein was detected through immunofluorescence assay.Meanwhile,pVAX-Gc-EGFP and pVAX-LAMP/Gc-EGFP recombinant plasmids were constructed and transfected into HeLa cells by liposome.The expression of the target protein was observed by fluorescence microscopy.The mice were immunized with the recombinant plasmids,which were extracted endotoxin free.Pathological analysis was performed on the important organs of mice.RESULTS:According to the double restriction enzyme digestion and sequence analysis,the target gene Gn,LAMP/Gn,Gc and LAMP/Gc were successfully cloned into vector pVAX1 and they were consistent with the original sequence.Immunofluorescence showed target protein was expressed in transiently transfected HeLa cells.The transfected HeLa cells were observed by fluorescence microscopy,and the expression vector containing EGFP showed green fluorescence.Balb/c mice were used as animal models to evaluate the safety of the vaccine.The results showed that the mice were well tolerated and there was no pathological change after repeated injections.CONCLUSION:The recombinant chimeric vectors were successfully constructed and expressed in eukaryotic cells,showing good safety.It lays foundation for the further study of Hantavirus targeted gene vaccine.
Hantavirus envelope glycoprotein;molecule LAMP; vector construction;protein expression identification;safety evaluation
R392.12
A
2095-6894(2017)08-36-05
2017-04-11;接受日期:2017-04-26
国家自然科学基金面上项目(81171977)
张锦鹏.E-mail:418110759@qq.com 张冠文(共同第一作者).E-mail:1104639827@qq.com 宣国云(共同第一作者).E-mail:1648924456@qq.com
杨 琨.教授.研究方向:病毒疫苗,肿瘤治疗,生物信息学.E-mail:yangkunkun@fmmu.edu.cn 姜东伯(共同通讯作者).硕士生.研究方向:病毒疫苗,生物信息学.E-mail:superjames1991@foxmail.com
——一道江苏高考题的奥秘解读和拓展

