Sensititre YeastOne显色药敏板与微量肉汤稀释法检测阿萨希毛孢子菌体外药物敏感性比较研究
郭莉娜 于淑颖 王贺 徐英春
(中国医学科学院北京协和医院检验科,北京 100730)
·论著·
Sensititre YeastOne显色药敏板与微量肉汤稀释法检测阿萨希毛孢子菌体外药物敏感性比较研究
郭莉娜 于淑颖 王贺 徐英春
(中国医学科学院北京协和医院检验科,北京 100730)
目的 以CLSI微量肉汤稀释法为参考方法,探讨商品化显色药敏板 (Sensititre YeastOne)检测阿萨希毛孢子菌体外药物敏感性的临床应用价值。方法 分别用微量肉汤稀释法和Sensititre YeastOne同时检测62株阿萨希毛孢子菌对临床常用7种抗真菌药物的体外敏感性,MIC值读取时间分别为24 h和48 h。结果 微量肉汤稀释法结果显示卡泊芬净和米卡芬净对阿萨希毛孢子菌无体外活性,二者MIC90均为16 μg/mL;唑类药物对阿萨希毛孢子菌体外活性较好,培养24 h MIC90分别为氟康唑8 μg/mL、伏立康唑0.125 μg/mL、伊曲康唑0.5 μg/mL;4.8% (3/62)阿萨希毛孢子菌对两性霉素B有高MIC值 (4 μg/mL);经24 h培养,Sensititre YeastOne与微量肉汤稀释法检测阿萨希毛孢子菌对7种抗真菌药物的体外MIC一致率 (essential agreement,EA)分别为氟康唑93.5%,伏立康唑98.4%,伊曲康唑98.4%,两性霉素B 98.4%,5-氟胞嘧啶88.7%,卡泊芬净100%,米卡芬净100%;培养48 h后,二者检测两性霉素B和5-氟胞嘧啶MIC一致率有所下降,分别为83.9%和67.7%;对微量肉汤稀释法而言,培养时间对两性霉素B和5-氟胞嘧啶MIC值影响较大,24 h和48 h MIC一致率分别为69.4%和53.2%,对Sensititre YeastOne,MIC值明显受培养时间影响的药物仅见于5-氟胞嘧啶,24 h和48 h MIC一致率为11.3%,其余药物不同MIC读取时间一致率非常好。结论 唑类药物对阿萨希毛孢子菌体外抗菌活性较好,Sensititre YeastOne和微量肉汤稀释法检测阿萨希毛孢子菌体外MIC值一致率较高,用于临床阿萨希毛孢子菌体外药物敏感性检测具有一定的实用价值。
阿萨希毛孢子菌;药敏试验;微量肉汤稀释法;Sensititre YeastOne
毛孢子菌属 (Trichosporon)广泛存在于自然界中,引起人类感染的毛孢子菌有几十种,其中阿萨希毛孢子菌最多见。阿萨希毛孢子菌不仅引起浅部感染,如毛发、指甲、皮肤的白毛结节病,还导致免疫受损人群系统性感染。毛孢子菌血流感染已成为血液肿瘤患者真菌血症的第2位非念珠菌酵母菌,其中导管相关性菌血症最常见,临床诊断中易与念珠菌型菌血症相混淆[1-2]。毛孢子菌血流感染严重威胁患者生命,死亡率高达43%~76%[2],感染早期选择合适的抗真菌药物对提高患者生存率至关重要。毛孢子菌野生株对唑类抗真菌药物一般是敏感的,部分菌株对两性霉素B体外MIC值偏高[3]。近年来随着抗真菌药物大范围预防应用,在药物选择性压力下,毛孢子菌唑类耐药性及泛耐药菌株的报道在增多[4-6],临床微生物实验室积极开展抗真菌药物体外敏感性检测,对临床医生合理使用抗真菌药物并进行有效治疗具有重要指导意义。
目前,真菌体外药物敏感性试验方法有多种,包括微量肉汤稀释法、纸片扩散法及多种商品化试剂盒,如ATB fungus 3,Etest试条等,其中美国国家临床试验标准化委员会 (CLSI)推荐的微量肉汤稀释法准确性高、重复性好,存在的主要问题是操作繁琐,耗时耗力,临床实践应用中有一定的局限性。本研究采用商品化的药敏板条Sensititre YeastOne和CLSI推荐的微量肉汤稀释法同时测定62株阿萨希毛孢子菌对7种抗真菌药物的体外MIC值,以微量肉汤稀释法为参考方法,探讨Sensititre YeastOne对阿萨希毛孢子菌体外药物敏感性的检测能力。
1 材料与方法
1.1 菌株来源
本研究所用62株阿萨希毛孢子菌来自中国侵袭性真菌监测网 (CHIF-NET2010~2014)和北京地区侵袭性真菌监测网 (BJIF-NET2012~2013),其中分离自血液标本26株,腹水10株,导管10株,脑脊液4株,支气管肺泡灌洗液2株,脓液4株,关节液2株,胸水2株,伤口分泌物2株,质控菌株ATCC22019近平滑念珠菌和ATCC6258克柔念珠菌。
1.2 材料与仪器
氟康唑、伏立康唑、伊曲康唑、5-氟胞嘧啶标准品 (中国食品药品检定研究院);注射用两性霉素B (华北制药股份有限公司);注射用醋酸卡泊芬净 (默沙东公司);注射用米卡芬净钠 (安斯泰来制药中国有限公司);科玛嘉显色培养基 (法国科玛嘉公司);沙堡弱培养基 (英国OXOID公司);RPMI 1640培养基,含谷氨酰胺不含碳酸氢盐并以酚红为指示剂,使用0.165 mol/L MOPS缓冲液调pH7.0±0.1 (德国sigma-aldrich公司);无菌U型96孔板 (江苏省海门盛泰实验器材厂);Sensititre YeastOne药敏板及接种肉汤 (赛默飞世尔科技公司);全自动加样仪器Sensititre AIM○R(赛默飞世尔科技公司)。
1.3 方法
菌种鉴定 所有菌株纯培养物采用核糖体rDNA IGS1区序列分析的方法准确定种,引物序列见文献[7]。
微量肉汤稀释法药敏试验 参考方法操作严格按照CLSI M27-A3[8]进行,结果读取时间分别为24 h和48 h。
Sensititre YeastOne药敏试验 试验方法严格按照说明书进行,从经24 h分离纯化培养的沙氏培养基 (SDA)上挑取若干单个菌落至无菌生理盐水中,使用标准比浊管将菌悬液调节至 (1~5)×106CFU/mL (即0.5 McF arland);取20 μL上述菌悬液接种至11 mL YeastOne接种肉汤,得到终浓度为 (1.5~8)×103CFU/mL的菌悬液;使用全自动加样仪器Sensititre AIM○R,向Sensititre YeastOne药敏板每孔加上述菌悬液100 μL;菌落计数质控,取10 μL阳性对照孔内的菌液接种至SDA上进行培养,正常的接种应得10~80菌落数;用黏性封膜密封所有孔,置35℃的空气孵育箱中孵育24 h和48 h;结果读取,酵母菌生长可通过反应孔明显颜色变化进行识别,通常由蓝色 (阴性)变成红色 (阳性),与生长对照孔相比第1个出现明显颜色变化的孔的药物浓度判读为MIC值。
质量控制 质控菌株ATCC22019近平滑念珠菌和ATCC6258克柔念珠菌随试验菌株平行操作,微量肉汤稀释法和Sensititre YeastOne所测得的MIC结果均应在规定的范围内。
结果分析 按照文献[9]报道的方法,总一致率 (Essential Agreement,EA):实验方法与参考方法MIC值差异不超过两个稀释度 (包含)的菌株占总测定株数的比例,并将两种方法检测所得的MIC50、MIC90进行比较。
2 结 果
2.1 质控结果
菌落计数 Sensititre YeastOne药敏试验中随机抽取5块药敏板阳性对照孔内的菌悬液10 μL接种到SDA平皿进行菌落计数,计数均介于10~80。
质控结果 7种抗真菌药物对质控菌株ATCC22019近平滑念珠菌和ATCC6258克柔念珠菌的MIC检测结果及允许范围见表1。
2.2 体外药物敏感性检测结果
62株阿萨希毛孢子菌对7种抗真菌药物体外药物敏感性结果见表2。微量肉汤稀释法结果显示:卡泊芬净和米卡芬净对阿萨希毛孢子菌无体外抗菌活性,二者MIC90均为16 μg/mL;唑类药物对阿萨希毛孢子菌体外活性较好,培养24 h MIC90分别为氟康唑8 μg/mL、伏立康唑0.125 μg/mL、伊曲康唑0.5 μg/mL;两性霉素B和5-氟胞嘧啶MIC90分别为2 μg/mL和4 μg/mL,其中3株阿萨希毛孢子菌对两性霉素B有高MIC值 (4 μg/mL),由于目前阿萨希毛孢子菌无可参考体外药物敏感性判定折点,故而无法判定敏感和耐药。经24 h培养,两种方法检测一致率非常好,分别为卡泊芬净100%、米卡芬净100%、氟康唑93.5%、伏立康唑98.4%、伊曲康唑98.4%、两性霉素B 98.4%及5-氟胞嘧啶88.7%;对氟康唑和伏立康唑,Sensititre YeastOne检测MIC50/MIC90均2倍于微量肉汤稀释法,对伊曲康唑,结果正好相反。随着培养时间的延长,两种方法检测检测阿萨希毛孢子菌MIC一致率有部分降低,主要见于两性霉素B (83.9%)和5-氟胞嘧啶(67.7%)。
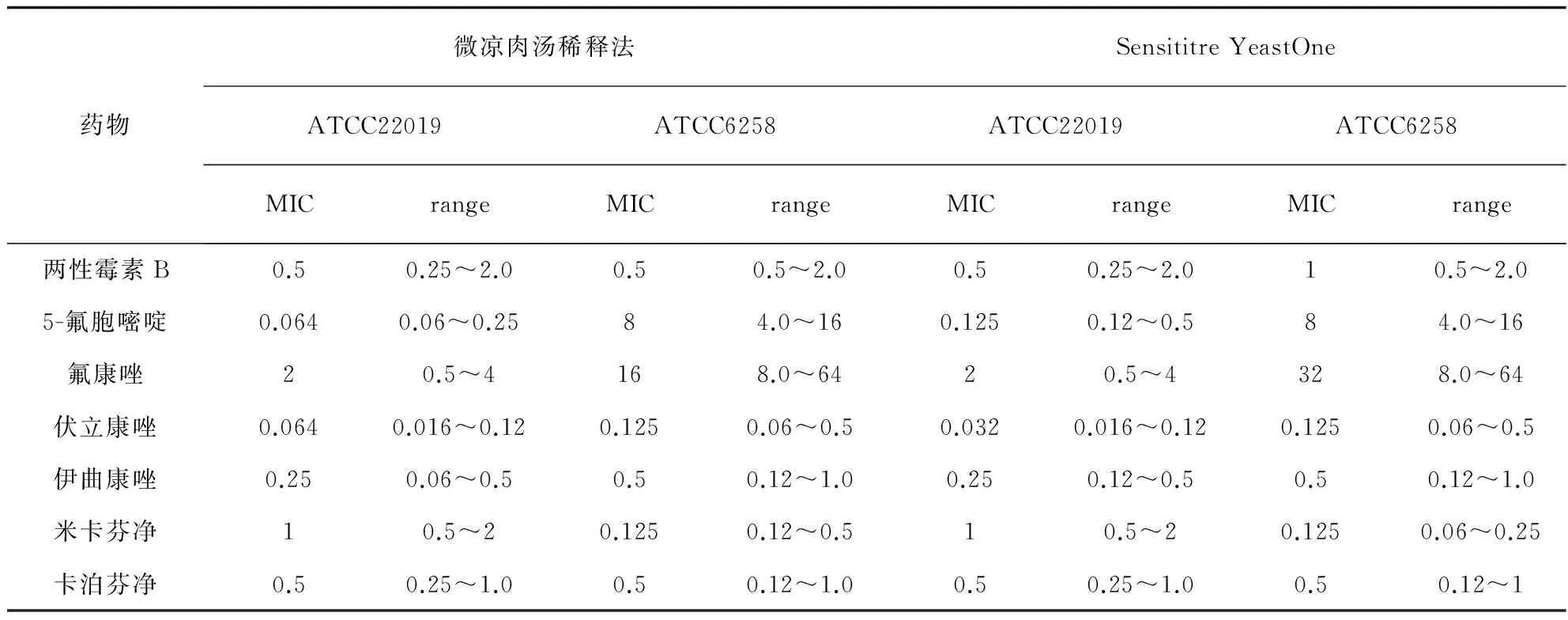
表1 质控菌株MIC允许范围及检测结果-24 h (μg/mL)
2.3 同一种检测方法24 h和48 h MIC值一致率
不同培养时间部分抗真菌药物对阿萨希毛孢子菌MIC值变化较大 (见表3)。本研究中,对于微量肉汤稀释法,两性霉素B和5-氟胞嘧啶培养24 h和48 h MIC值一致率较低,分别为69.4%和53.2%,48 h MIC904~8倍于24 h MIC90值,其余5种抗真菌药物MIC值受培养时间影响较小;对于Sensititre YeastOne,大多数药物培养24 h和48 h MIC值一致率非常高 (96.8%~100%),仅5-氟胞嘧啶一致率为11.3%,48 h MIC9016倍于24 hMIC90值。
表2 Sensititre YeastOne与微量肉汤稀释法检测62株阿萨希毛孢子菌体外药物敏感性比较-24 h/48 h
Tab.2 MIC distribution and essential agreements of 62T.asahiiisolates determined by Sensititre YeastOne and broth microdilution method at 24/48 h

抗真菌药物药敏方法MIC(μg/mL)-24hMIC(μg/mL)-48h50%90%Range50%90%RangeEA(24/48h)氟康唑YST8161-328162~3293.5/93.5BMD480.5~16480.5~32伏立康唑YST0.1250.250.032~10.250.50.064~198.4/98.4BMD0.0640.1250.016~0.50.1250.250.016~0.25伊曲康唑YST0.250.250.125~10.50.50.125~198.4/100BMD0.50.50.125~10.510.125~1两性霉素BYST220.5~41161~1698.4/83.9BMD120.125~44161~325-氟胞嘧啶YST441~12832640.5~12888.7/67.7BMD240.25~168161~32卡泊芬净YST16168~16161616~16100/100BMD16164~1616168~16米卡芬净YST161616~16161616~16100/100BMD161616~16161616~16

表3 同一方法检测阿萨希毛孢子菌体外药物敏感性24 h和48 h MIC值一致率 (EA)
3 讨 论
毛孢子菌病,特别是侵袭性毛孢子菌感染发生率虽低于念珠菌及曲霉菌感染,但近年来有增多的趋势。毛孢子菌感染实验室诊断主要依赖于真菌培养及血培养,鉴定中存在的问题是在显色培养基上易与白念珠菌或热带念珠菌混淆,生化鉴定方法API 20C和Vitek 2 compact对阿萨希毛孢子菌鉴定正确率分别为91.7%和75%,核糖体rRNA IGS序列分析可将阿萨希毛孢子菌准确鉴定到种[10]。血清1,3-beta-D-葡聚糖 (BDG)检测对毛孢子菌感染诊断价值较小,Kei Suzuki等[2]研究显示,25例毛孢子菌血流感染,只有48% (12/25)血清BDG值升高,而先于血培养报警的只有16% (4/25)。
早期及时选择敏感的抗真菌药物对毛孢子菌感染预后有积极影响,临床微生物实验室积极开展毛孢子菌体外药物敏感性检测有利于临床抗真菌治疗。本研究所评估商品化药敏板Sensititre YeastOne,抗真菌药物包埋于96孔板底,只需室温保存,每块板独立包装,随用随取,既免除称量抗真菌药物、配制梯度浓度的药液、手工制作药敏板的系列复杂操作,降低错误概率,又节省了劳动力,相对于微量肉汤稀释法有明显优势。另外,Sensititre YeastOne终点判读是根据反应孔颜色改变来识别,结果判读更为客观,可以很大程度降低假耐药或假敏感情况发生,为临床提供准确的药敏结果,而微量肉汤稀释法结果读取对操作者经验要求很高,更适用于科研机构或大型三甲医院,对于三级以下医院实用性不强。
目前CLSI无专门针对毛孢子菌体外药物敏感性检测的标准文件,现有操作多参照念珠菌属,敏感性判定折点无可参考标准,故无法计算敏感率等指标。从本研究MIC值分布来看,卡泊芬净和米卡芬净无体外抗菌活性,MIC50/MIC90均为16 μg/mL,这与国外报道一致[2,11],体内疗效亦不佳,Kei Suzuki等[2]回顾了日本33例血液肿瘤患者毛孢子菌血流感染,发现一半以上患者毛孢子菌血流感染之前曾使用米卡芬净预防或经验性治疗,米卡芬净抑制了其他敏感性真菌,而对米卡芬净耐药的毛孢子菌被筛选出来,继而发生侵袭性血流感染。
经24 h孵育,Sensititre YeastOne和微量肉汤稀释法分别有82.3% (51/62)和27.4% (17/62)阿萨希毛孢子菌对两性霉素B有高MIC值 (≥2 μg/mL),其中9.7%和4.8%的菌株MIC为4 μg/mL,台湾、日本等也有类似报道[2-4]。本研究中唑类药物对阿萨希毛孢子菌显示了较好的体外抗菌活性,特别是伏立康唑和伊曲康唑,Sensititre YeastOne和微量肉汤稀释法检测的MIC90分别为0.25/0.125 μg/mL和0.25/0.5 μg/mL,Kei Suzuki等[2]比较了使用唑类和两性霉素B治疗毛孢子菌血流感染的临床疗效,6例单独使用两性霉素B治愈率为0,联合两性霉素B和三唑类14例治愈率为35.7%,单独使用唑类8例,治愈率为37.5%,可见三唑类药物对治疗毛孢子菌感染的重要地位。
本研究显示,Sensititre YeastOne检测结果与微量肉汤稀释法相比总体一致率较好,介于88.7%~100%,培养时间对5-氟胞嘧啶MIC影响较多,培养48 h后MIC值更高,但由于缺乏相关标准,毛孢子菌体外药物敏感性检测读取MIC值最佳时间仍然未知。不同于念珠菌属,阿萨希毛孢子菌对唑类药物敏感性试验未发现明显拖尾现象,24 h和48 h的MIC值一致率非常高。Sensititre YeastOne用于念珠菌体外药物敏感性检测的报道非常多,其检测的便捷性和准确性已得到广泛的认可[12-13],但专门用于毛孢子菌药敏检测的报道并不多见[14],因此本研究对阐述Sensititre YeastOne应用于阿萨希毛孢子菌体外药物敏感性检测的价值具有一定的实用性。
综上所述,Sensititre YeastOne检测阿萨希毛孢子菌体外药物敏感性与标准化微量肉汤稀释法一致性较好,操作简便、结果易于判读,可望用于临床微生物实验室常规检测。
致谢:非常感谢所有参加CHIF-NET2010-2014和首发专项2012-2013的单位和老师们。
[1] Girmenia C,Pagano L,Martino B,et al.Invasive infections caused byTrichosporonspecies andGeotrichumcapitatumin patients with hematological malignancies:a retrospective multicenter study from Italy and review of the literature[J].J Clin Microbiol,2005,43(4):1818-1828.
[2] Suzuki K,Nakase K,Kyo T,et al.FatalTrichosporonfungemia in patients with hematologic malignancies[J].Eur J Haematol,2010,84(5):441-447.
[3] Yang YL,Liu YW,Chen HT,et al.Genotype analysis based on intergenic spacer 1 sequences ofTrichosporonasahiicollected in Taiwan[J].Med Mycol,2013,51(8):880-883.
[4] Iturrieta-González IA,Padovan AC,Bizerra FC,et al.Multiple species ofTrichosporonproduce biofilms highly resistant to triazoles and amphotericin B[J].PLoS One,2014,9(10):e109553.
[5] Kushima H,Tokimatsu I,Ishii H,et al.Antifungal susceptibility and drug-resistant mechanism ofTrichosporon[J].Med Mycol J,2015,56(4):J123-J128.
[6] Basu S,Tilak R,Kumar A.Multidrug-resistantTrichosporon:an unusual fungal sepsis in preterm neonates[J].Pathog Glob Health,2015,109(4):202-206.
[7] Sugita T,Nakajima M,Ikeda R,et al.Sequence analysis of the ribosomal DNA intergenic spacer 1 regions ofTrichosporonspecies[J].J Clin Microbiol,2002,40(5):1826-1830.
[8] Clinical and Laboratory Standards Institute.Reference method for broth dilution antifungal susceptibility testing of yeasts;approved standard M27-A3,3rd ed[S].Clinical and Laboratory Standards Institute,Wayne,PA,2007.
[9] Pfaller MA,Chaturvedi V,Diekema DJ,et al.Clinical evaluation of the Sensititre YeastOne colorimetric antifungal panel for antifungal susceptibility testing of the echinocandins anidulafungin,Caspofungin,and micafungin[J].J Clin Microbiol,2008,46(7):2155-2159.
[10] Guo LN,Xiao M,Kong F,et al.Three-locus identification,genotyping,and antifungal susceptibilities of medically importantTrichosporonspecies from China[J].J Clin Microbiol,2011,49(11):3805-3011.
[11] Ruan SY1,Chien JY,Hsueh PR.Invasive trichosporonosis caused byTrichosporonasahiiand other unusual Trichosporon species at a medical center in Taiwan[J].Clin Infect Dis,2009,49(1):e11-e17.
[12] 郭莉娜,徐英春,范欣,等.Sensititire YeastOne显色药敏板检测念珠菌属体外药物敏感性临床应用研究[J].中华医院感染学杂志,2016,26(10):2221-2214.
[13] Alexander BD,Byrne TC,Smith KL,et al.Comparative evaluation of Etest and Sensititre YeastOne Panels against the Clinical and Laboratory Standards Institute M27-A2 Reference Broth Microdilution Method for testing Candida Susceptibility to seven antifungal agents[J].J Clin Microbiol,2007,45(3):698-706.
[14] Espinel-Ingroff A,Pfaller M,Messer SA,et al.Multicenter comparison of the sensititre YeastOne Colorimetric Antifungal Panel with the National Committee for Clinical Laboratory standards M27-A reference method for testing clinical isolates of common and emergingCandidaspp,Cryptococcusspp,and other yeasts and yeast-like organisms[J].J Clin Microbiol,1999,37(3):591-595.
[本文编辑] 王 飞
Comparative evaluation of Sensititre YeastOne colorimetric panel with broth microdilution methods for antifungal susceptibility testing ofTrichosporonasahiiisolates
GUO Li-na,YU Shu-Ying,WANG He,XU Ying-chun
(ChineseAcademyofMedicalSciences,PekingUnionMedicalCollegeHospital,DepartmentofClinicalLaboratory,Beijing100730)
Objective To assess the utility of a commercially prepared,colorimetric microdilution panel (Sensititre YeastOne) for testingT.asahiiisolates.Methods A total of 62T.asahiiisolates against seven antifungal agents were detected simultaneously by both Sensititre YeastOne and broth microdilution method.The broth microdilution method was adopted as reference method.MIC endpoints were read after 24 h and 48 h of incubation.Results Susceptibility results by broth microdilution method:caspofungin and micafungin showed noinvitroantifungal activities againstT.asahii,both of their MIC90s were 16 μg/mL.Azoles had good antifungal activities againstT.asahiiisolates,MIC90were fluconazole (8 μg/mL),voriconazole (0.125 μg/mL) and itraconazole (0.5 μg/mL) at 24 h incubation.Three isolates (4.8%,3/62) ofT.asahiihad high MICs (4 μg/mL) against amphotericin B.After 24 h incubation,essential agreement (EA) between broth microdilution method and Sensititre YeastOne in seven agents were fluconazole (93.5%),voriconazole (98.4%),itraconazole (98.4%),amphotericin B (98.4%),5-flucytosine (88.7%),caspofungin(100%),micafungin(100%),respectively;EA between the two methods decreased to 83.9% (amphotericin B) and 67.7% (flucytosine) when MICs were determined at 48 h incubation.For broth microdilution method,poor agreement was observed mainly for amphotericin B (69.4%) and flucytosine (53.2%),while for Sensititre YeastOne,the overall EA of 24 h and 48 h MICs were excellent except for flucytosine (11.3%).Conclusions Azoles had goodinvitroantifungal activities againstT.asahiiisolates.The Sensititre YeastOne appeared to be comparable to the CLSI broth microdilution method in testingT.asahiiisolates and could be used as an alternative for susceptibility testing ofT.asahiiisolates in clinical laboratories.
T.asahii;antifungal susceptibility;broth microdilution;Sensititre YeastOne
198-202]
R 379.9
A
1673-3827(2017)12-0198-05
2016-11-28

