IL-22对口腔白念珠菌感染的保护作用及机制研究
谭静文 何文婧 高志琴 杨虹 章楚光 梁豫琳 杨连娟
(1.上海市皮肤病医院真菌病科,上海 200443;2.上海市皮肤病医院病理科,上海 200443)
·论著·
IL-22对口腔白念珠菌感染的保护作用及机制研究
谭静文1何文婧1高志琴1杨虹1章楚光2梁豫琳2杨连娟1
(1.上海市皮肤病医院真菌病科,上海 200443;2.上海市皮肤病医院病理科,上海 200443)
目的 明确IL-22在口腔白念珠菌感染中的作用及可能机制。方法 建立BALB/c小鼠口腔白念珠菌感染动物模型,使用IL-22特异性抗体阻断小鼠IL-22分泌,观察与IL-22正常分泌小鼠相比,舌体感染情况、局部菌载量,颊黏膜组织病理学改变以及局部细胞因子表达水平的变化。结果 感染48 h后,阻断IL-22分泌的小鼠舌体可见厚的假膜状白斑,舌体菌载量1 700 CFU/mL;未阻断者其舌体局部可见薄的白斑,菌载量为980 CFU/mL。颊黏膜PAS染色后可见,阻断IL-22的小鼠黏膜表面附有较多菌丝并侵入上皮,伴有上皮细胞水肿及炎细胞浸润;未阻断者黏膜局部少量菌丝附着,未见明显炎细胞浸润。颊黏膜Realtime-PCR检测表明,与正常野生型小鼠相比,阻断IL-22分泌的小鼠局部TNF-α、CXCL-9、CXCL-10、CXCL-11表达量分别为升高18.1、0.8、1.2及0.9倍;未阻断者分别升高34.5、1.2、6.1及1.7倍。结论 IL-22可能通过募集驱化因子在口腔白念珠菌感染中发挥保护作用。
口腔念珠菌病;白念珠菌;IL-22
白念珠菌 (Candidaalbicans)是一种广泛存在的条件致病真菌,也是定植在人体皮肤、口腔及胃肠道黏膜处的正常菌群,由其引起的念珠菌病不但常见且危害极大,是临床真菌病防治重点。研究表明,健康人口腔中念珠菌的阳性携带率高达80%,且以白念珠菌为主,当口腔环境改变或机体防御下降时,菌株在口腔内大量繁殖,由寄生转为致病[1]。近年来,随着糖尿病、HIV、移植患者、肿瘤患者等免疫受损人群的逐年增加,口腔念珠菌病的发病率在逐年上升。而长期慢性口腔念珠菌病不但有恶变可能,还可向下发展引起食道念珠菌病,甚至全身播散危害生命[2]。
目前对于该类疾病的治疗手段主要依赖局部及全身抗真菌药物的使用,尽管可以控制大多数的感染,但越来越多耐药菌株的出现以及昂贵的治疗成本和药物毒副作用,使防治该病出现了新的挑战。而了解该病的发病过程、宿主状态,为我们寻找更有效的治疗方法提供了重要依据和新的思路。
白念珠菌感染人体时,首先转化成为致病的菌丝相以完成对角质形成细胞的进一步侵入[3]。在这个过程中,通过树突状细胞呈递抗原,可激活局部黏膜免疫,促使角蛋白细胞分泌抗菌蛋白,在黏膜屏障遭受破坏的时候,募集中性粒细胞发挥杀伤病原菌作用[4]。黏膜免疫反应在控制念珠菌起始感染时发挥重要作用。研究表明,IL-22是局部黏膜免疫的一个关键因素,其最基本的作用就是维持黏膜屏障,保护宿主免受微生物寄生[5]。在一项关于胰腺炎的研究中证明其可以上调生存基因如Reg Ⅲ,抗细胞凋亡及促进组织修复[6]。此外,在一项对肺部肺炎克雷伯杆菌感染的研究表明,IL-22缺陷小鼠菌株的黏附和侵袭性增加,死亡率也更高[7]。而在IL-22敲除小鼠感染柠檬酸杆菌的模型研究表明,其结肠上皮细胞破坏更明显,死亡率也更高[8]。但是IL-22在真菌感染的黏膜免疫是否具有保护作用尚未明确。
因此,我们拟构建BALB/c小鼠口腔念珠菌病感染模型,并通过IL-22特异性抗体阻断小鼠IL-22分泌,观察小鼠口腔念珠菌感染情况以及相关炎症因子如TNF-α等的分泌,以明确IL-22在口腔念珠菌感染中的作用以及其可能的机制。
1 材料和方法
1.1 实验菌株和实验动物
实验菌株 本试验所用菌株为白念珠菌临床菌株22059,菌种保藏于上海市皮肤病医院真菌病科菌种库。实验开始前菌株在马铃薯葡萄糖琼脂 (Potato Dextrose Agar,PDA,Difco Laboratories,Detroit,USA)培养基上35℃活化24 h。
实验动物 BABL/c雌性小鼠,6周龄,购自上海斯莱克实验动物有限公司。食物为购自上海斯莱克实验动物有限公司的标准颗粒饲料,自由饮水,自然光照,饲养1~2周,小鼠活动情况和体征无异常后进行本次实验。实验研究过程遵循动物伦理学的相关要求,优化操作以尽量减少小鼠不必要的痛苦。
1.2 菌株毒力恢复与菌悬液的制备
取上述活化后的菌株,用生理盐水制备成菌悬液,使用血细胞计数板,调整孢子浓度为1×108CFU/mL。将计数后的菌悬液直接经静脉注射0.5 mL至小鼠体内,接种后第4天取小鼠的肾脏,经玻璃研磨器研磨后涂于PDA平板,35℃孵育48 h后,挑取单克隆菌落,转种至PDA培养基,35℃孵育48 h后用生理盐水制备成菌悬液,使用血细胞计数板调整孢子浓度为1×108CFU/mL备用。
1.3 小鼠口腔念珠菌病模型建立
依照处理方法不同,对小鼠进行分组,分别为A组[白念珠菌感染+Anti IL-22抗体 (eBioscience,San Diego,USA,货号16-7222-85)接种],B组 (白念珠菌感染),C组 (空白对照),D组[白念珠菌感染+对照抗体IgG2ακ (eBioscience,San Diego,USA,货号16-4321-85)接种],每组8只小鼠。接种前5 d给予各组小鼠含四环素 (国药集团化学试剂有限公司,上海,中国,货号39502370,浓度0.83 g/L)的饮水。接种前3 d对各组小鼠腹腔注射泼尼松龙 (国药集团化学试剂有限公司,上海,中国,货号40164562)100 mg/kg,接种前1 d对各组小鼠以该剂量再重复注射1次。接种当日,先腹腔注射阿托品注射液 (芜湖康奇制药有限公司,芜湖,安徽,产品批号“国药准字H34023134”)1 μg/只,20 min后再腹腔注射乌拉坦液 (国药集团化学试剂有限公司,上海,中国,货号30191272,浓度1 250 mg/kg)。待小鼠麻醉后用浸有100 μL菌液的棉团置于小鼠口腔中,保持2 h。在该过程中需注意保持室温大于20℃[9]。
1.4 小鼠口腔念珠菌感染临床特征观察
感染48 h后,对小鼠口腔感染程度进行临床症状评估打分。评分标准如下:0分为正常;1分为少量薄的白斑,覆盖舌表面积约为 20%;2分为薄的白斑,覆盖舌表面积大约为20%~90%;3分为薄的白斑,覆盖舌表面积>90%;4分为厚的假膜状白斑,覆盖舌表面积>90%。
1.5 念珠菌菌落培养和计数
感染48 h后,每组取2只小鼠处死,无菌采集舌体,称重,并在含无菌生理盐水的灭菌管中用匀浆器单独进行匀浆。所得匀浆经灭菌注射用水稀释10倍后,分3份涂布到PDA培养基上,在35℃培养48 h后,统计真菌菌落数。组织感染真菌量以每克组织的CFU值表示。
1.6 组织病理学检查
感染48 h后,每组取2只小鼠处死,取颊黏膜上皮组织予组织病理学观察后常规石蜡包埋,4 μm石蜡切片,苏木素-伊红 (HE)和过碘酸-Schiff (PAS)染色,光学显微镜下观察。
1.7 Realtime-PCR检测口腔念珠菌感染后局部黏膜中相关细胞因子表达情况
感染48 h后各组分别处死2只小鼠,取颊黏膜上皮组织、舌体组织,用Realtime-PCR方法检测IL-22、TNF-α、CXCL-9、CXCL-10、CXCL-11的mRNA表达水平。
2 实验结果
2.1 小鼠舌体感染情况及局部菌载量
感染48 h后,观察各组小鼠舌体情况发现,阻断IL-22之后,小鼠舌体可见厚的假膜状白斑,覆盖舌表面积>90%,评分为4分 (见图1A);未阻断IL-22的野生型小鼠,感染白念珠菌48 h后可见薄的白斑,覆盖舌表面积>90%,评分为3分 (见图1B);而未感染白念珠菌的野生型小鼠,舌体正常,评分0分 (见图1C)。对感染后小鼠舌体菌载量检测显示感染白念珠菌后小鼠舌体均可长出白念珠菌,但阻断IL-22后,小鼠舌体菌载量明显增多,为1 700 CFU/mL,而未阻断IL-22小鼠感染白念珠菌后菌载量为980 CFU/mL。注射对照抗体IgG2ακ小鼠与野生型小鼠临床症状及舌体菌载量无差异 (图片文中未显示)。
2.2 小鼠颊黏膜局部组织病理学改变
感染48 h后,观察各组小鼠颊黏膜组织病理学变化可见,IL-22被阻断的感染组小鼠黏膜表面附有较多菌丝并侵入上皮,伴有上皮细胞水肿及炎细胞浸润 (见图2A~C);被感染的野生型小鼠颊黏膜表面亦可见到少量菌丝,但局部菌量少,颊黏膜炎症反应不明显 (见图2D~F);未感染的野生型小鼠可见正常颊黏膜结构,无炎细胞浸润 (见图2G~I)。
2.3 小鼠颊黏膜局部细胞因子表达情况
感染48 h后,处死各组小鼠,取其颊黏膜行Realtime-PCR检测发现:与正常野生型小鼠相比,感染白念珠菌且IL-22被阻断小鼠的IL-22表达量升高6.2倍,感染白念珠菌的野生型小鼠IL-22表达量升高23.7倍。同时,与对正常野生型小鼠相比,感染白念珠菌且IL-22被阻断小鼠的TNF-α、CXCL-9/-10/-11表达量分别为升高18.1、0.8、1.2及0.9倍;感染白念珠菌的野生型小鼠的TNF-α、CXCL-9/-10/-11表达量分别为升高34.5、1.2、6.1及1.7倍 (见图3)。
3 讨 论
IL-22为IL-10家族的细胞因子,1999年由Dumoutier等首先报道[10]。其受体IL-22R是由IL-22R1和IL-10R2组成的异源二聚体,主要分布于非造血干细胞表面[11-12]。在免疫反应中,IL-22首先与IL-22R1结合,经构象变化后才能与IL-10R2结合,进而活化JAK (Janus Kinase)和Tyk2 (Tyrosine Kinase 2)引起STAT3 (Signal Transducer and Activator of Transcription 3)磷酸化,继而引起下游的级联反应。除此之外,IL-22还可通过激活p38激酶,MEK/ERK (Extracellular Signal-Regulated Kinase),JNK (Jun Amino-Terminal Kinases)引起下游免疫反应[5,13]。
其中很重要的一步,就是募集驱化因子。趋化因子为一大类介导炎症和免疫反应的结构相似的低分子量 (8~10 kDa)趋化蛋白,以具有白细胞趋化活性为特点,可以招募白细胞到炎症和感染的部位[14]。如CXCL1、CXCL2、CXCL8可以募集中性粒白细胞,CCL2、CCL7、CCL13,CXCL9、CXCL10、CXCL11可以募集Th1细胞,CCL17和CCL22可以募集Th2细胞,CCL20可以募集Th17细胞,这些趋化因子募集相对应的靶细胞到达创伤、缺血和感染部位[15-16]。由于它们在炎症的条件下被诱导,因此被认为在机体抵抗致病菌的第一线防御中行使其功能。研究证实,CXCL9、CXCL10、CXCL11对大肠杆菌、单核细胞增多性李氏菌具有明显的抗微生物活性[17]。在扁桃体炎中,黏膜局部的CXCL9、CXCL10、CXCL11浓度明显增高[18]。此外,其对隐球菌、白念珠菌也有抗菌的特性[19]。此外,IL-22 还可诱导抗菌肽如β-防御素2 (HBD2)和S100蛋白的产生[20]。
我们的研究表明,在白念珠菌感染的小鼠模型中,IL-22对口腔黏膜具有保护作用,IL-22被阻断的小鼠黏膜破坏更严重,局部菌载量也更多。对颊黏膜细胞因子的Realtime检测结果表明,未感染白念珠菌时,小鼠IL-22表达量极低,在局部受白念珠菌感染刺激后,IL-22表达量上升,但这一过程可被注射AntiIL-22抗体阻断,小鼠颊黏膜局部的IL-22表达量依旧极低。与此相对应的还有TNF-α的表达,其与IL-22表达量变化趋势一致。而感染白念珠菌后小鼠口腔黏膜的CXCL-9/-10/-11有所上升,但IL-22被抗体阻断后,CXCL-10的上升幅度有所减少,CXCL-9/-11甚至出现降低,提示IL-22可能通过募集趋化因子引起下游反应达到保护局部黏膜的目的。
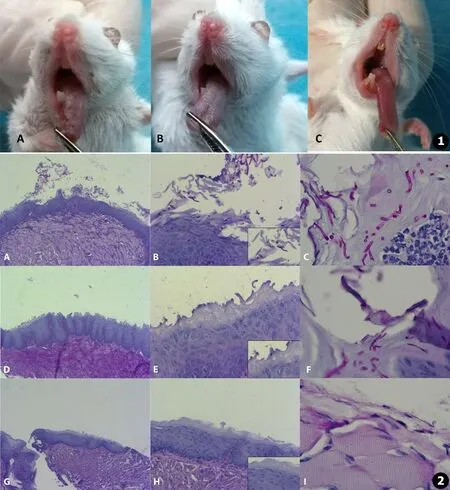
图1 小鼠舌体感染情况:A.感染白念珠菌且IL-22被阻断小鼠,B.感染白念珠菌的野生型小鼠,C.正常野生型小鼠 图2 感染后各组小鼠颊黏膜组织病理改变:A.感染白念珠菌且IL-22被阻断小鼠颊黏膜 (PAS×40),B.感染白念珠菌且IL-22被阻断小鼠颊黏膜 (PAS×200),C.感染白念珠菌且IL-22被阻断小鼠颊黏膜 (PAS×油镜),D.感染白念珠菌的野生型小鼠颊黏膜 (PAS×40),E.感染白念珠菌的野生型小鼠颊黏膜 (PAS×200),F.感染白念珠菌的野生型小鼠颊黏膜 (PAS×油镜),G.正常野生型小鼠颊黏膜 (PAS×40),H.正常野生型小鼠颊黏膜 (PAS×200),I.正常野生型小鼠颊黏膜 (PAS×油镜)(B,E,H中右下角方框内为放大显示部分)
Fig.1 The manifestation of the tough afterC.albicansinfection:A.IL-22 blocked mice withC.albicansinfection,B.Wild type mice withC.albicansinfection,C.Wild type mice Fig.2 Histopathological changes of buccal mucosa:A.Infection of mice which IL-22 were blocked,PAS×40;B.Infection of mice which IL-22 were blocked,PAS×200;C.Infection of mice which IL-22 were blocked,PAS×oil immersion lens;D.Infection of wild type mice,PAS×40;E.Infection of wild type mice,PAS×200;F.Infection of wild type mice,PAS×oil immersion lens;G.Wild type mice,PAS×40;H.Wild type mice,PAS×200;I.Wild type mice,PAS×oil immersion lens (The picture in the bottom frame of B,E,H indicates the zoom in part)
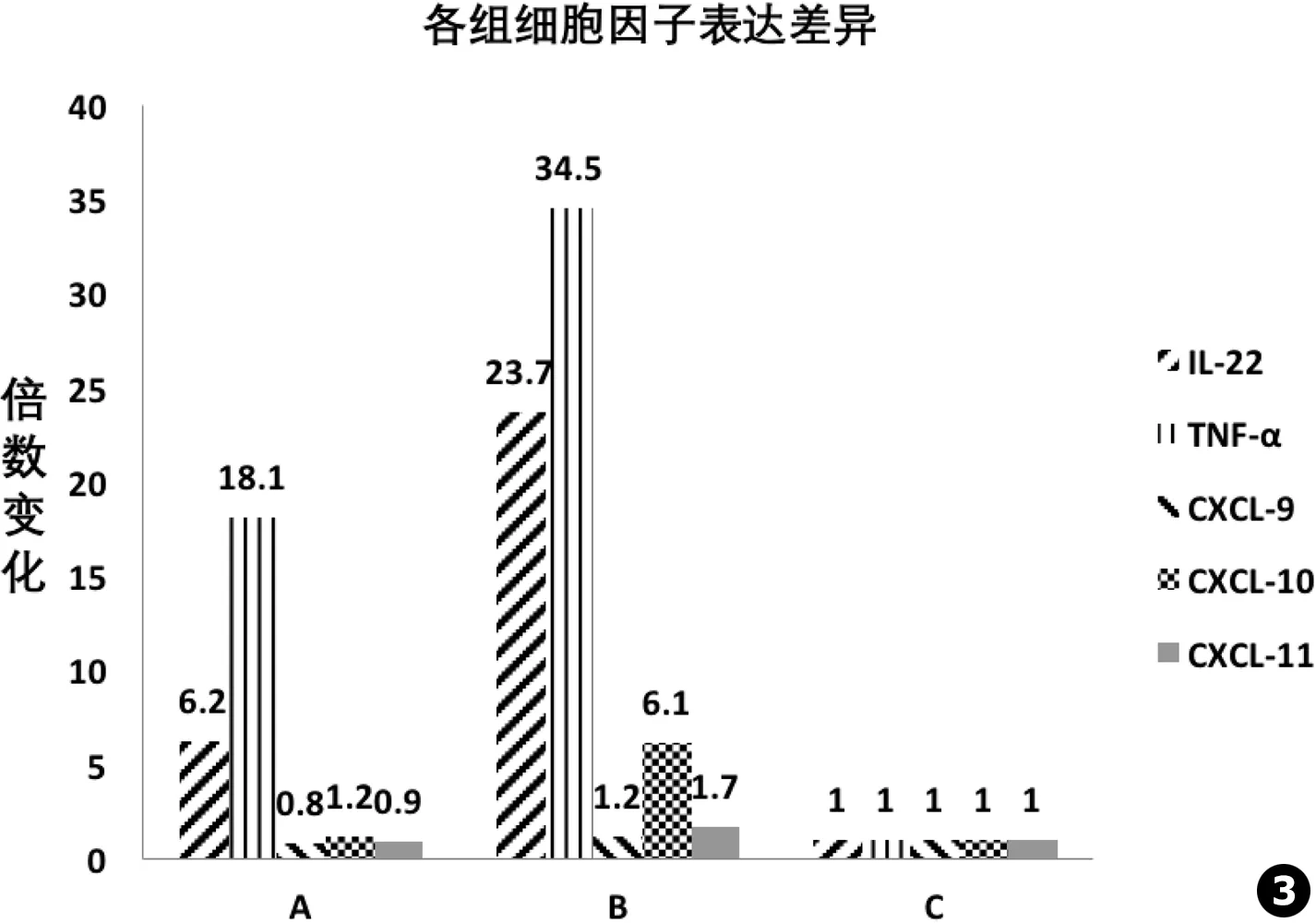
图3 各组细胞因子表达差异:A.感染白念珠菌且IL-22被阻断小鼠,B.感染白念珠菌的野生型小鼠,C.正常野生型小鼠
Fig.3 The cytokine changes in each group:A.IL-22 blocked mice withC.albicansinfection,B.Wild type mice withC.albicansinfection,C.Wild type mice
本研究通过建立小鼠口腔白念珠菌感染模型,并采用抗体阻断的方式研究IL-22在白念珠菌感染小鼠口腔中的作用及其可能机制,丰富了IL-22的功能范围,也为其临床应用提供了新的依据。
[1] Schaller M,Mailhammer R,Grassl G,et al.Infection of human oral epithelia withCandidaspecies induces cytokine expression correlated to the degree of virulence[J].J Invest Dermatol,2002,118(4):652-657.
[2] Villar CC,Dongari-Bagtzoglou A.Immune defence mechanisms and immunoenhancement strategies in oropharyngeal candidiasis[J].Expert Rev Mol Med,2008,10:e29.
[3] Acosta-Rodriguez EV,Rivino L,Geginat J,et al.Surface phenotype and antigenic specificity of human interleukin 17-producing T helper memory cells[J].Nat Immunol,2007,8(6):639-646.
[4] Cua DJ,Tato CM.Innate IL-17-producing cells:the sentinels of the immune system[J].Nat Rev Immunol,2010,10(7):479-489.
[5] Di Lullo G,Marcatti M,Heltai S,et al.Th22 cells increase in poor prognosis multiple myeloma and promote tumor cell growth and survival[J].Oncoimmunology,2015,4(5):e1005460.
[6] PerusinaLanfranca M,Lin Y,Fang J,et al.Biological and pathological activities of interleukin-22[J].J Mol Med (Berl),2016,94(5):523-534.
[7] Zenewicz LA,Yancopoulos GD,Valenzuela DM,et al.Innate and adaptive interleukin-22 protects mice from inflammatory bowel disease[J].Immunity,2008,29(6):947-957.
[8] Sugimoto K,Ogawa A,Mizoguchi E,et al.IL-22 ameliorates intestinal inflammation in a mouse model of ulcerative colitis[J].J Clin Invest,2008,118(2):534-544.
[9] 王乐.小鼠口腔阴道双部位白念珠菌感染模型的构建及不同部位来源白念珠菌的毒力差异研究[D].北京:京协和医学院研究生院,2014:33-36.
[10] Dumoutier L,Louahed J,Renauld JC.Cloning and characterization of IL-10-related T cell-derived inducible factor (IL-TIF),a novel cytokine structurally related to IL-10 and inducible by IL-9[J].J Immunol,2000,164(4):1814-1819.
[11] Li J,Tomkinson KN,Tan XY,et al.Temporal associations between interleukin 22 and the extracellular domains of IL-22R and IL-10R2[J].Int Immunopharmacol,2004,4(5):693-708.
[12] Ciccia F,Guggino G1,Rizzo A,et al.Interleukin (IL)-22 receptor 1 is over-expressed in primary Sjogren's syndrome and Sjgren-associated non-Hodgkin lymphomas and is regulated by IL-18[J].Clin ExpImmunol,2015,181(2):219-229.
[13] Naher L,Kiyoshima T,Kobayashi I,et al.STAT3 signal transduction through interleukin-22 in oral squamous cell carcinoma[J].Int J Oncol,2012,41(5):1577-1586.
[14] Charo IF,Ransohoff RM.The many roles of chemokines and chemokine receptors in inflammation[J].N Engl J Med,2006,354(6):610-621.
[15] Olson TS,Ley K.Chemokines and chemokine receptors in leukocyte trafficking[J].Am J Physiol Regul Integr Comp Physiol,2002,283(1):R7-28.
[16] Singh SP,Zhang HH,Foley JF,et al.Human T cells that are able to produce IL-17 express the chemokine receptor CCR6[J].J Immunol,2008,180(1):214-221.
[17] Cole AM,Ganz T,Liese AM,et al.Cutting edge:IFN-inducible ELR-CXC chemokines display defensin-like antimicrobial activity[J].J Immunol,2001,15:167(2):623-627.
[18] Egesten A,Eliasson M,Johansson HM,et al.The CXC chemokine MIG/CXCL9 is important in innate immunity against Streptococcus pyogenes[J].J Infect Dis,2007,195(5):684-693.
[19] Maerki C,Meuter S,Liebi M,et al.Potent and broad-spectrum antimicrobial activity of CXCL14 suggests an immediate role in skin infections[J].J Immunol,2009,182(1):507-514.
[20] Wolk K,Witte E,Wallace E,et al.IL-22 regulates the expression of genes responsible for antimicrobial defense,cellular differentiation,and mobility in keratinocytes:a potential role in psoriasis[J].Eur J Immunol,2006,36(5):1309-1323.
The role of IL-22 in oral candidiasis which caused byCandidaalbicans
TAN Jing-wen1,HE Wen-jing1,GAO Zhi-qin1,YANG Hong1,ZHANG Chu-guang2,LIANG Yu-lin2,YANG Lian-juan1
(1.Departmentofmedicalmycology,ShanghaiDermatologyHospital,Shanghai200443;2.Departmentofpathematology,ShanghaiDermatologyHospital,Shanghai200443)
Objective To evaluate the role of IL-22 in oral candidiasis which caused byCandidaalbicans.Methods We built the models of experimental oral candidiasis in BALB/c mice firstly.Then we used anti-IL-22 antibody to block the immune response.After that we estimate the manifestation of acute oral candidiasis and colonization ofC.albicansin the tongue.Histopathological study and the cytokine changes of buccal mucosa were detected either.Results Mice which IL-22 were blocked showed thick pseudomembranous substance on the tongue and the fungal burden reached 1 700 CFU/mL.The normal mice showed thin pseudomembranous substance and the fungal burden was 980 CFU/mL.Histopathological examinations showed hyphae existing on the mucosal surface and invading epithelium accompanied by destruction of epithelium and inflammatory infiltration in the IL-22 blocked mice.Meanwhile,in the normal mice,there were less hyphae existing and rare inflammation.The Real-time PCR showed that compare with wild mice,the fold change of TNF-α,CXCL-9,CXCL-10,CXCL-11 in IL-22 blocked one were 18.1,0.8,1.2 and 0.9 times.Which were 34.5,1.2,6.1and 1.7 times in IL-22 normal mice.Conclusions IL-22 can be protective through enhance the secretion of chemotactic factor in oral candidiasis which caused byC.albicans.
Oral candidiasis;Candidaalbicans;IL-22
207-211]
上海市卫生和计划生育委员会面上项目 (20140388);国家自然科学基金面上项目 (81573063)
谭静文,女 (汉族),硕士,住院医师.E-mail:cecilia_88903@163.com
杨连娟,E-mail:lianjuan_yang@aliyun.com
R 519.3
A
1673-3827(2017)12-0207-05
2016-12-18 [本文编辑] 卫凤莲

