大鼠原代脑微血管内皮细胞氧糖剥夺/复氧模型中内参基因的选择*
朱红艳,牛华,符浩,郑永钦,孟强
(1.昆明理工大学附属医院检验科,昆明 650032;2.云南省第一人民医院 a.检验科,b.神经内科,c.临床基础研究所,昆明 650032;3.昆明理工大学医学院,昆明 650032)
·研究生园地·
大鼠原代脑微血管内皮细胞氧糖剥夺/复氧模型中内参基因的选择*
朱红艳1,2a,3,牛华2a,符浩2b,郑永钦2c,孟强2b
(1.昆明理工大学附属医院检验科,昆明 650032;2.云南省第一人民医院 a.检验科,b.神经内科,c.临床基础研究所,昆明 650032;3.昆明理工大学医学院,昆明 650032)
目的 筛选大鼠原代脑微血管内皮细胞氧糖剥夺/复氧(OGD/R)模型中合适的内参基因。方法 实时荧光定量-聚合酶链反应(qRT-PCR)检测3种常用管家基因:3-磷酸甘油醛脱氢酶(GAPDH)、β-肌动蛋白(ACTB)、核糖体蛋白L13A(RPL13A)在大鼠原代脑微血管内皮细胞中的表达水平;并采用GeNorm程序分析得到最稳定的内参基因。结果RPL13A、GAPDH、ACTB基因表达稳定度的平均值(M值)分别为0.590、0.570、0.397。结论 在大鼠原代脑微血管内皮细胞OGD/R模型中表达最不稳定的内参基因是RPL13A,最稳定内参基因是ACTB。
内参基因;GeNorm程序;实时荧光定量PCR;氧糖剥夺/复氧模型;脑微血管内皮细胞
实时荧光定量PCR技术(quantitative real-time polymerase chain reaction, qRT-PCR)是分子生物学和细胞生物学中广泛用来检测基因表达的一种常用方法。但是在实际研究过程中,由于易受到细胞数量、标本大小、不同实验条件的影响,必须使用内参基因进行校正才能获得更为真实可信的结果。由于管家基因在不同的物种,不同组织和不同实验条件下的表达也具有特异性,其表达的稳定性是相对的。因此,研究者需要根据自己的样品类型和实验条件选择合适的管家基因作为内参基因。氧糖剥夺/复氧(oxygen glucose deprive/reoxygenation, OGDR)模型是常用的体外研究脑缺血再灌注模型。本研究旨在筛选最合适的大鼠原代脑微血管内皮细胞(brain microvascular endothelia cells, BMECs )OGD/R模型中内参基因。报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 6只新生SD大鼠乳鼠,日龄3~5 d,购于昆明医科大学动物中心,动物试验遵守国家相关条例规定。
1.1.2 主要试剂及仪器 EastepTM总RNA 提取试剂盒(LS1030),Promega GoScript反转录试剂盒(A5000)购自上海普洛麦格公司,SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒(RR820A, 大连宝生物公司);Nanodrop2000分光光度计、梯度PCR仪(美国Thermo scientific公司),LightCycler 480实时荧光定量PCR仪(德国Roche公司),Forma 3131 三气培养箱(美国Thermo fisher公司)。
1.2 方法
1.2.1 原代脑微血管内皮细胞培养和氧糖剥夺/复氧模型 原代脑微血管内皮细胞培养实验步骤参照Burek等[1]的方法并稍作改进:常规培养并传代脑微血管内皮细胞(消化用酶为0.2% Ⅳ型胶原酶和0.2%中性蛋白酶各3 mL)。取生长状态良好的第3~4代细胞,按1×105/mL细胞密度接种至6孔细胞培养板,待细胞融合度达70%~80%时用于后续实验。实验分别设氧糖剥夺(OGD)组:培养基换成无糖DMEM培养基,置于三气培养箱中低氧培养(94% N2,5% CO2,1% O2)1、2、3、6、24 h;氧糖剥夺/复氧(OGDR)组:先按上述条件低氧培养2 h后恢复正常氧浓度,再用高糖DMEM培养基培养1、2、3、6、24 h;选取与上两组一致的同一代细胞按正常培养条件培养后作为正常对照组。每个时间点做3个复孔。
1.2.2 cDNA合成 参照EastepTM总RNA(LS1030)提取试剂盒说明书操作提取细胞总RNA。用Nanodrop2000分光光度计测定RNA浓度和纯度,取吸光度(A260/280 nm)值在1.8~2.1间的样本用于后续实验。按照Promega GoScript反转录试剂盒说明书进行逆转录反应,RNA和cDNA样本均置于-80 ℃保存。
1.2.3 实时荧光定量PCR(qRT-PCR) 引物由大连宝生物公司设计并合成。引物序列见表1。参照SYBR®Premix Ex TaqTMⅡ试剂盒说明书进行PCR反应。PCR总反应体系为20 μL,包括SYBR®Premix Ex Taq Ⅱ(Tli RNaseH Plus)(2×)10 μL,上、下游引物(10 μmol/L)各0.8 μL,cDNA模板2 μL,灭菌蒸馏水6.4 μL。循环参数: 95 ℃ 30 s; 95 ℃ 5 s,55 ℃ 30 s,72 ℃ 30 s,共40个循环; 95 ℃ 5 s,60 ℃ 60 s,95 ℃,1个循环; 50 ℃ 30 s。经LightCycler 480配套软件对各管家基因的循环阈值(Ct值)和熔解曲线进行分析。结果判读:先找出某一管家基因Ct值最小者(该样本基因表达量为1),求出各样本该管家基因△Ct,△Ct=各样本Ct-最小者Ct值,然后求出各样本该管家基因的相对表达量(2-△Ct值)。
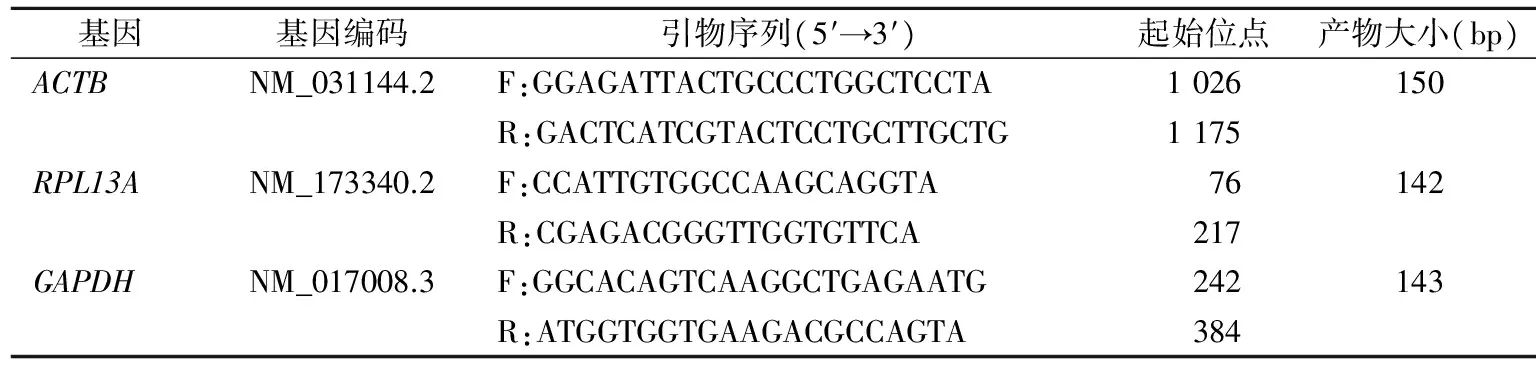
表1 实时荧光定量PCR引物序列
1.3 统计学分析 从GeNorm官网下载GeNorm程序程序,并将这些数值导入程序,计算每个基因的稳定性即平均值(M)(每行代表1个样品,列是待选内参基因, M值越小,表达度越稳定),以M值对管家基因的表达度进行排序,选择M值最高的管家基因,点击删除,软件重新计算剩下基因的稳定性,以此类推,直到在计算阵列中仅剩2个基因,这2个基因就是表达最稳定的基因[2]。
2 结果
2.1 实时荧光定量PCR结果ACTB、RPL13A和GAPDH3种管家基因的Ct值均为10~16,熔解曲线示3种管家基因熔解峰单一,表明PCR扩增出特异性产物。见图1。
2.2 3种基因表达稳定度 GeNorm程序计算得到的RPL13A、GAPDH、ACTB基因的M值分别为0.590、0.570、0.397。ACTB基因M值最小,故而是模型中表达最稳定的基因。
3 讨论
在qRT-PCR实验标准化中,内参基因的选择是一个重要的部分。理想状态下管家基因的表达应该不受试验条件或不同的组织、细胞的影响,然而,这样的基因尚未被发现[3]。目前尚无适合于所有体系作为内参的管家基因,因此,研究者需根据试验样品类型和条件来选择合适的内参基因。
GeNorm是Vandesompele等[2]开发的基于微软Excel平台的VBA宏程序,特别为内参基因的选择而设计,以被广泛验证,并成功应用于多项研究[4]。该程序通过计算某一管家基因与其他所有基因间两两比值的对数转换值的平均变异度(M)值作为基因稳定性的评价指标,M值越小表明其越稳定[5]。通过GeNorm计算分析发现,在本研究中RPL13A最不稳定,ACTB是在所分析3个基因中表达最稳定的,GAPDH处于两者之间。ACTB是一种细胞骨架蛋白,存在于所有的真核细胞中且高度保守[6],有报道称在大鼠心肌梗死模型中ACTB表达最不稳定[5],结果与本研究存在较大的差异,分析原因可能是因为选取的组织细胞来源不同所致。GAPDH是糖酵解、糖异生过程中的关键酶。Zhong等[7]研究证实在缺氧条件下GAPDHmRNA表达量增加,不适合作为内参基因。另有研究发现,7个管家基因:GAPDH,RPS4X,RPLl3A,RNPSl,EEFlAl,TPTl,SRPl4中GAPDH是表达最不稳定的[8]。在本研究中,GAPDH表达稳定性处于ACTB和RPL13A之间。不同研究获得的矛盾结论可能与样本和实验条件的不同有关。因此,在qRT-PCR分析中首先必须根据实验条件确定合适的内参基因。但因实验条件所限,本研究所选的内参基因数量略少,一般文献都推荐同时选5至6个以上管家基因同时筛选得到试验所选最佳内参基因。今后,我们将扩大管家基因的数量,并进行进一步的研究证实。
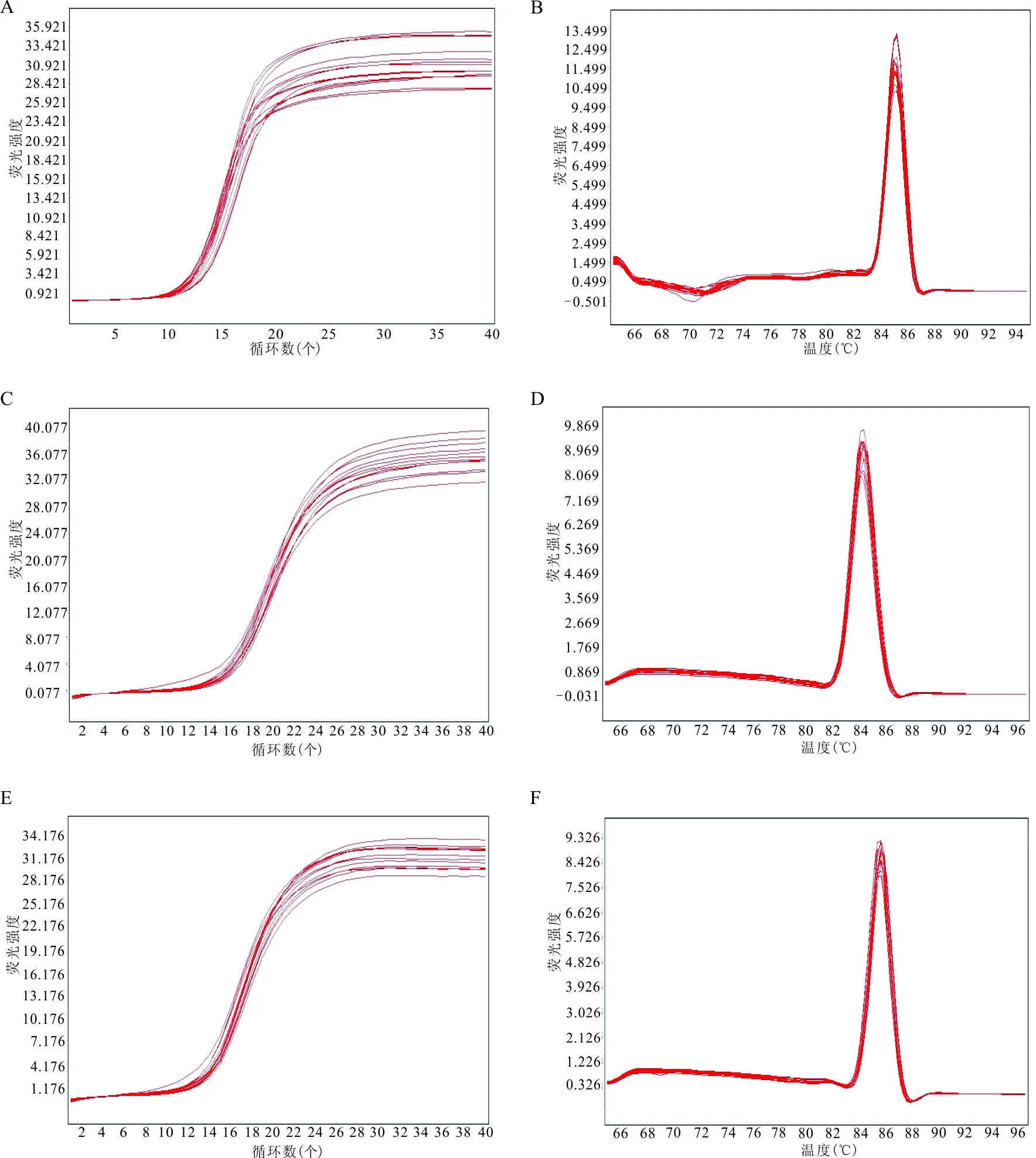
注:A,GAPDH扩增曲线;B,GAPDH熔解曲线;C,ACTB扩增曲线;D,ACTB熔解曲线;E,RPL13A扩增曲线;F,RPL13A熔解曲线。
图1 实时荧光定量PCR仪分析各基因的扩增曲线和熔解曲线
[1]Burek M, Salvador E, Forster CY. Generation of an immortalized murine brain microvascular endothelial cell line as an in vitro blood brain barrier model[J]. J Vis Exp, 2012,66:e4022.
[2]Vandesompele J, De Preter K, Pattyn F,etal. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J]. Genome Biol, 2002,3(7):H34.
[3]Liu DW, Chen ST, Liu HP. Choice of endogenous control for gene expression in nonsmall cell lung cancer[J]. Eur Respir J, 2005,26(6):1002-1008.
[4]Zhang X, Ding L, Sandford AJ. Selection of reference genes for gene expression studies in human neutrophils by real-time PCR[J]. BMC Mol Biol, 2005,6:4.
[5]赵传艳, 王昕, 张春亮, 等. 大鼠心肌梗死模型中管家基因的选择[J]. 国际生物医学工程杂志, 2013,36(4):216-219.
[6]董恩妮, 梁青, 李利, 等. 实时荧光定量PCR内参基因的选择[J]. 中国畜牧杂志, 2013,49(11):92-96.
[7]Zhong H, Simons JW. Direct comparison ofGAPDH, beta-actin, cyclophilin, and 28S rRNA as internal standards for quantifying RNA levels under hypoxia[J]. Biochem Biophys Res Commun, 1999,259(3):523-526.
[8]Pilbrow AP, Ellmers LJ, Black MA,etal. Genomic selection of reference genes for real-time PCR in human myocardium[J]. BMC Med Genomics, 2008,1:64.
(本文编辑:许晓蒙)
10.13602/j.cnki.jcls.2017.08.21
国家自然科学基金(81460188);云南省应用基础研究(昆医联合专项)(2013FB201);云南省中青年学术和技术带头人后备人才(2012HB028);云南省卫生系统学科带头人(D-201235);王陇德院士工作站。
朱红艳,1980年生,女,主管技师,博士研究生,主要从事医学检验工作。
孟强,主任医师,博士研究生导师,E-mail:mq301@sina.com.cn。
R34
A
2017-05-07)

