肠道病毒71型激活人横纹肌肉瘤细胞中JNK1/2信号转导通路*
许超,彭阳,史伟峰
(苏州大学附属第三医院检验科,江苏常州 213003)
·研究生园地·
肠道病毒71型激活人横纹肌肉瘤细胞中JNK1/2信号转导通路*
许超,彭阳,史伟峰
(苏州大学附属第三医院检验科,江苏常州 213003)
目的 探讨c-Jun N端激酶(JNK)信号转导通路在肠道病毒71型(EV71)感染中的作用。方法 台盼蓝染色法检测不同浓度抑制剂SP600125对人横纹肌肉瘤细胞(RD)活性的影响;实时荧光定量PCR及western blot检测EV71感染RD细胞后VP1 mRNA及蛋白质的表达水平;western blot检测JNK1/2、c-Fos、c-Jun蛋白及其磷酸化水平,并分析JNK1/2抑制剂SP600125对EV71复制及JNK1/2信号通路的影响。结果 台盼蓝染色结果表明,与空白对照组比较,5和10 μmol/L实验组存活率差异无统计学意义(P均>0.05),而20 μmol/L抑制剂组细胞存活率明显降低(P<0.05);实时荧光定量PCR及western blot结果表明,与对照组相比,实验组在EV71感染RD细胞8 h后,其VP1 mRNA及蛋白质的表达水平均明显下降(P均<0.01)。此外,western blot检测结果证实EV71感染RD细胞后,其JNK1/2、c-Fos和c-Jun的蛋白质磷酸化水平均明显升高(P均<0.05)。而经抑制剂SP600125处理可明显下调其JNK1/2、c-Fos、c-Jun磷酸化水平(P均<0.05)。结论 JNK1/2信号通路可被 EV71感染有效激活,并与EV71复制有关。
JNK1/2信号通路;肠道病毒71型;人横纹肌肉瘤细胞
肠道病毒71型(EV71)感染严重者可引起无菌性脑炎、脑膜脑炎、脑干脑炎、脊髓灰质炎样麻痹、心肌炎和肺水肿等多种与神经系统相关的疾病,重症患者常导致死亡[1]。研究发现[2],JNK信号通路在介导多种胞外刺激诱导的细胞炎症、应激、凋亡、周期和生长等多种生理和病理过程中具有重要作用。EV71感染细胞后可诱导细胞凋亡,但是在不同的宿主细胞中,其诱导细胞凋亡的机制各不相同[3]。人横纹肌肉瘤(RD)细胞是EV71的易感细胞,主要用于EV71病毒的扩增。目前,JNK信号通路激活与EV71感染性疾病的发生关系密切,但其机制仍不清楚。本研究通过用JNK特异性抑制剂SP600125阻断细胞信号通路,观察JNK信号通路中蛋白质分子的活性变化及VP1蛋白(病毒复制指标)在RD细胞中的表达水平,进一步探讨RD细胞中JNK信号通路活化在EV71复制中的作用,以期为相关的临床应用提供实验依据。
1 材料与方法
1.1 主要试剂和仪器 细胞存活率检测试剂盒(台盼蓝染色法,Beyotime公司),磷酸化蛋白质提取试剂盒(凯基生物公司),SP600125(JNK inhibitor,德国Selleck公司),兔抗人JNK1/2、c-Fos、c-Jun及其磷酸化多克隆抗体、兔抗人GAPDH多克隆抗体及辣根过氧化物酶(HRP)标记的羊抗兔IgG(美国SAB公司),鼠抗人EV71/VP1抗体及HRP标记的羊抗鼠IgG(英国Abcam公司),Trizol试剂(美国Invitrogen公司),逆转录试剂盒、实时定量PCR试剂盒(日本TaKaRa公司);7500型实时荧光定量PCR(美国ABI公司),SMA1000超微量紫外分光光度计(北京普莱恒通公司),CLINX化学发光成像仪(上海勤翔公司)。
1.2 病毒和细胞来源 EV71病毒株GDV083(BrCr)购自中国典型培养物保藏中心;人横纹肌肉瘤(RD)细胞由中国科学院上海生命科学研究院细胞资源中心提供。
1.3 抑制剂制备 SP600125溶解于二甲基亚砜(DMSO),终浓度为10 μmol/L,置于-20 ℃保存。
1.4 台盼蓝染色法测定细胞存活率 取生长状态良好的RD细胞,用含10%胎牛血清(FBS)的DMEM培养基常规培养,待细胞融合度达90%时,弃去培养基。实验设空白对照组(仅加PBS 2 μL)、DMSO组(仅加入DMSO 2 μL)和实验组(加入终浓度分别为5、10、20 μmol/L SP600125),室温温育1 h后,更换为新鲜的培养基继续培养24 h,经2.5 g/L胰蛋白酶消化并1 000 r/min离心5 min,收集细胞,按细胞存活率检测试剂盒说明书操作,并用血细胞计数板进行细胞计数。细胞存活率=(细胞总数-蓝色细胞数)/细胞总数×100%。实验重复3次。
1.5 EV71病毒感染RD细胞 取生长状态良好的RD细胞,用含10%胎牛血清(FBS)的DMEM培养基常规培养,待细胞融合度达90%时,弃去培养基,PBS洗涤2次,用2.5 g/L胰蛋白酶消化细胞,接种至6孔细胞培养板(每孔4×105个),继续培养24 h。实验分为对照组(2 μL DMSO+MOI=5的EV71)和实验组(终浓度为10 μmol/L SP600125+ MOI=5的EV71),室温温育1 h后,加入相应的病毒感染RD细胞,室温温育1 h后,更换为新鲜的DMEM培养基继续培养,经2.5 g/L胰蛋白酶消化并1 000 r/min离心5 min收集培养0、4、8、12、24 h的细胞,用于后续实验。
1.6 RNA提取及逆转录反应 取1.5中的各组细胞,采用Trizol法提取细胞总RNA,SMA1000超微量紫外分光光度计检测提取RNA浓度和纯度,取浓度为300~500 ng/μL,吸光度(A260/280 nm)值为1.80~2.0的样本用于后续实验。按照逆转录试剂说明书操作将RNA逆转录成cDNA。样本置-20 ℃保存。
1.7 引物设计及实时荧光定量PCR 根据GenBank中VP1及GAPDH基因序列(序列号分别为EUO24958和NM_002046),用Primer Premier 5.0软件设计引物,由苏州金唯智公司合成。VP1上游引物序列:5′-GAGTGGCAGATGTGATTGA-3′,下游引物序列:5′-TCCAGTGTCTAAGCGATGA-3′ ,产物大小为215 bp;GAPDH上游引物序列:5′-TATGACAA
CAGCCTCAAGA-3′,下游引物序列:5′- ATGAGTCCT
TCCACGATAC-3′ ,产物大小为101 bp。PCR总体系为20 μL,包括SYBR Green Master mix 10 μL,ROX校正染料Ⅱ 0.4 μL,10 μmol/L上、下引物各0.4 μL, cDNA 2 μL,RNA Free ddH2O补足体积。PCR循环参数: 95 ℃ 10 s;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 15 s,共40个循环。在60 ℃时用7500 v2.0.6软件收集荧光信号。采用2-△△Ct法计算相VP1 mRNA的对表达水平,△△Ct=(Ct目的基因-Ct内参基因)实验组-(Ct目的基因- Ct内参基因)对照组。每个样本做3个复孔,实验重复3次。
1.8 western blot 取上述各组细胞,经2.5 g/L胰蛋白酶消化并1 000 r/min离心5 min,加入蛋白质裂解液 (1 mL裂解液含蛋白酶抑制剂1 μL、磷酸酶抑制剂10 μL和PMSF 10 μL),冰上裂解40 min,12 000 r/min离心5 min,收集上清,采用BCA法测定总蛋白质浓度。以每孔35 μg的蛋白质量加样至10% SDS-PAGE凝胶电泳(积层胶采用80 V电压,分离胶采用100 V电压)。电泳结束后在300 mA恒流条件下2 h将蛋白质电转移至PVDF膜上;经50 g/L脱脂奶粉中室温封闭1 h,分别加入兔抗人抗JNK1/2、c-Fos、c-Jun、p-JNK1/2、p-c-Fos、p-c-Jun抗体、鼠抗人EV71/VP1抗体(均为1∶1 000稀释)及兔抗人抗GAPDH多克隆抗体(1∶5 000稀释)4 ℃过夜;TBST洗膜3次,每次5 min,加入HRP标记的羊抗兔IgG或羊抗鼠IgG(1∶1 000稀释),室温温育1 h;TBST洗膜3次,每次5 min,采用ECL发光液显色,在CLINX化学发光成像仪中显影,应用凝胶图像分析系统及Image J软件对条带进行灰度扫描进及结果判读。实验重复3次。
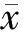
2 结果
2.1 SP600125对RD细胞存活率的影响 空白对照组、DMSO组、实验组(5、10、20 μmol/L)细胞存活率(%)分别为0.914±0.021,0.889±0.019,0.848±0.039,0.839±0.043,0.541±0.024,各组间差异有统计学意义(F=72.37,P<0.05)。组间两两比较结果表明,与空白对照组相比,DMSO组、5、10 μmol/L实验组差异均无统计学意义(t分别为1.53,2.58,2.72,P均>0.05),而20 μmol/L组差异有统计学意义(t=20.26,P<0.05);与20 μmol/L组相比,5、10 μmol/L实验组差异有统计学意义(t分别为11.61,10.48,P均<0.05)。
2.2 SP600125对RD细胞中EV71的复制影响
2.2.1 实时荧光定量PCR检测VP1 mRNA表达水平 与对照组(1.43±0.18,13.14±0.23,14.53±0.11)相比,实验组在感染8、12和24 h后VP1 mRNA的表达水平降低(分别为0.55±0.12,3.51±0.15,4.97±0.13),差异均有统计学意义(t分别为7.05、60.74、97.23,P均<0.01);实验组和对照组在感染0和4 h时的VP1 mRNA都不表达,差异均无统计学意义。
2.2.2 western blot检测VP1蛋白表达水平 与对照组(0.65±0.02,0.79±0.04,1.10±0.04)相比,实验组在EV71感染RD细胞8、12和24 h后VP1蛋白的灰度比值分别为0.14±0.05,0.25±0.06,0.53±0.03,两组间差异均有统计学意义(t分别为16.4,12.97,19.75,P均<0.01 );实验组和对照组在感染0和4 h时的VP1蛋白都不表达。见图1。
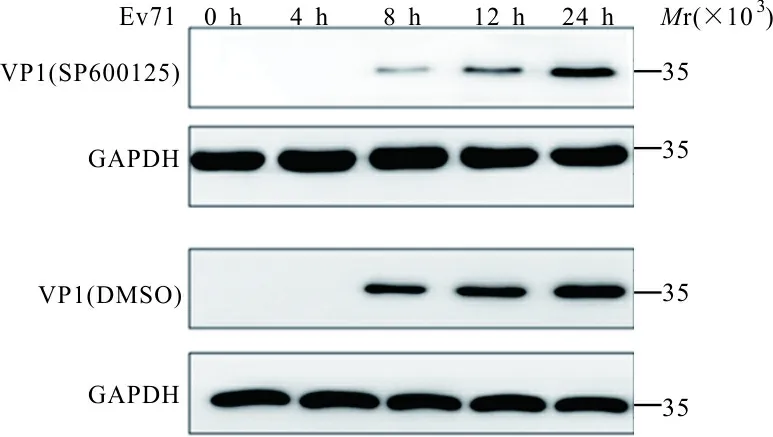
图1 SP600125对EV71感染RD细胞VP1蛋白表达的影响
2.3 EV71感染对激活JNK1/2信号通路的影响 western blot结果表明,对照组在感染EV71病毒0、4、8、12和24 h的p-JNK1/2蛋白灰度比值分别为0.26±0.03,0.57±0.04,0.35±0.06,0.21±0.02,0.18±0.03,而实验组中分别为0.12±0.02,0.14±0.03,0.09±0.01,0.10±0.02,0.08±0.01,两组间差异有统计学意义(t分别为6.73,14.90,7.40,6.74,5.48,P均<0.01);对照组4、8、12和24 h的JNK1/2蛋白灰度比值分别为0.42±0.04,0.73±0,03,1.01±0.05,0.85±0.02, 而实验组分别为0.20±0.02,0.31±0.05,0.35±0.01,0.24±0.03,两组间差异有统计学意义(t分别为8.52,12.48,22.42,29.30,P均<0.01);而对照组和实验组在0 h时JNK1/2蛋白灰度比值(分别为0.10±0.02,0.11±0.01),组间差异无统计学意义(t=0.77,P>0.05)。见图2。

图2 SP600125对对照组(A)和实验组(B)JNK蛋白及其磷酸化蛋白表达的影响
2.4 SP600125对JNK1/2通路下游转录因子的影响 western blot结果表明,与对照组感染EV71病毒4、8、12和24 h相比,实验组c-Fos和c-Jun的蛋白质磷酸化水平差异均有统计学意义(P均<0.05)。见图3和表1。
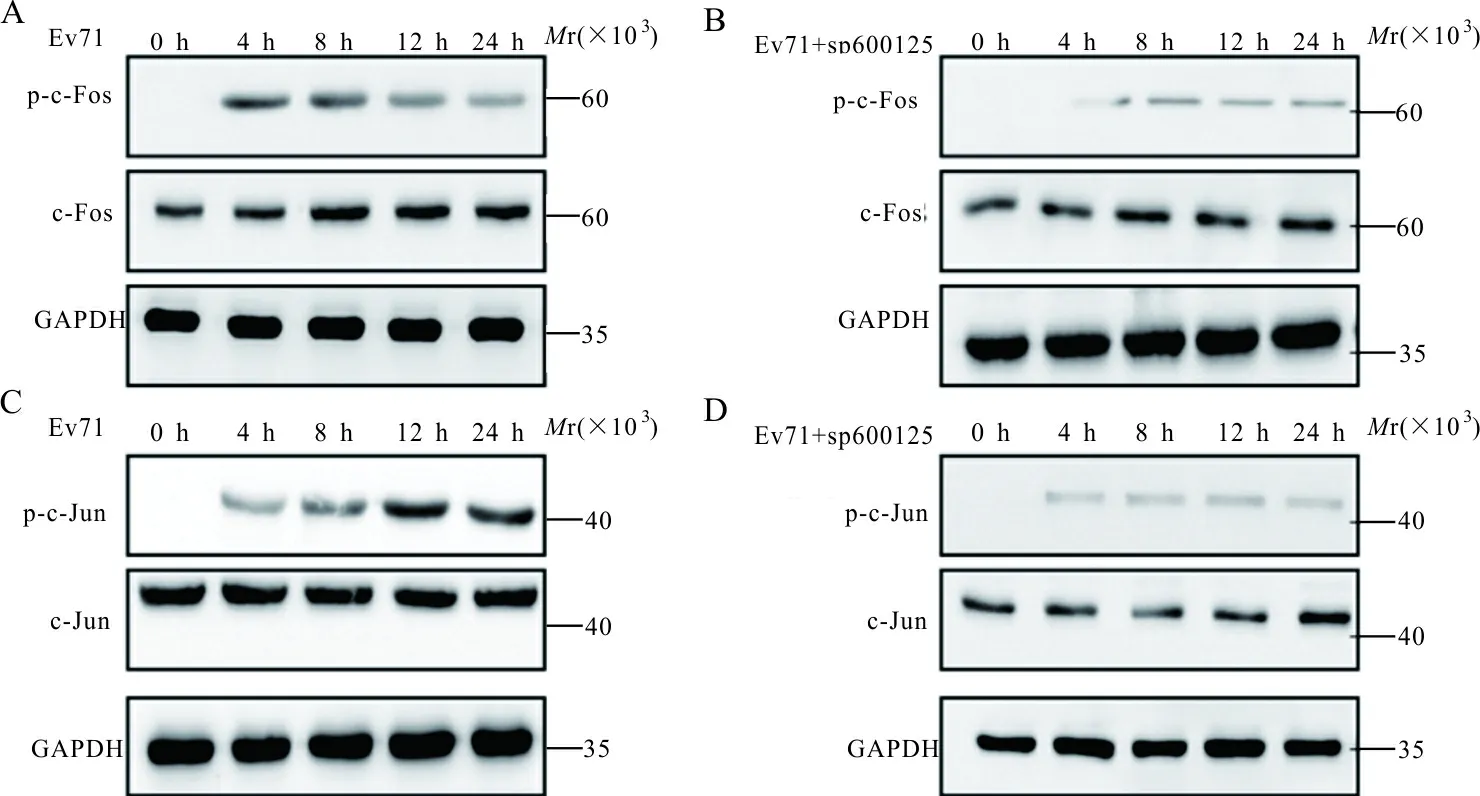
注:A、B,对照组、实验组c-Fos蛋白及其磷酸化的表达水平; C、D,对照组、实验组c-Jun蛋白及其磷酸化的表达水平。

图3 SP600125对c-Fos、c-Jun蛋白及其磷酸化的影响
3 讨论
JNK蛋白家族是丝裂原活化蛋白激酶超家族的成员之一,也被称为应激活化蛋白激酶。JNK可介导多种胞外刺激诱导的细胞抗病毒作用,如应激、Fas、TNF-α等。本课题组前期研究[4]发现,EV71感染RD细胞后,JNK1/2、c-Jun、c-FosmRNA表达水平上调, IL-2、 IL-4、IL-10和TNF-α细胞因子分泌明显增加,表明这些细胞因子的分泌可能促进JNK信号通路的活化。
本研究结果发现, EV71感染RD细胞8 h后,其VP1蛋白的表达水平明显升高。另有研究发现[5],EV71感染Hela细胞6 h即可出现VP1蛋白少量表达。研究表明[6],VP1蛋白的表达水平主要是由病毒的毒力与细胞的抗病毒功能所决定。而JNK信号通路的激活能抑制细胞的抗病毒作用,促进病毒的大量复制;本研究结果表明,用抑制剂SP600125处理EV71感染RD细胞后,可明显下调JNK1/2、c-Fos和c-Jun的蛋白磷酸化,同时EV71/VP1 mRNA及其蛋白质的表达水平明显下降。表明抑制JNK信号通路可抑制感染RD细胞中EV71的增殖和复制。Zhou等[7]在研究Hsa-let-7c-5p对EV71病毒复制的影响时发现,EV71激活JNK信号通路后,其JNK蛋白磷酸化水平明显增强,而在加入抑制剂SP600125后,EV71病毒滴度及VP1 mRNA的表达水平明显降低(P<0.01),与本研究的结果较为一致。Tung等[8]研究发现,EV71感染SK-N-SH细胞后可激活JNK信号通路,下游转录因子c-Fos和c-Jun的蛋白磷酸化水平明显升高,促进环氧化酶-2(COX-2)的表达,从而释放大量的前列素E2(PEG2),更有利于病毒的大量繁殖;当加入抑制剂SP600125后,EV71病毒复制明显受到抑制,表明抑制 JNK信号通路,下游转录因子c-Fos和c-Jun的蛋白磷酸化也相应受到抑制,环COX-2的表达降低, PEG2释放减少,不利于病毒的大量繁殖,与本研究结果较为类似。
综上所述,本研究发现EV71可激活JNK信号通路有利于病毒增殖,SP600125抑制剂可通过抑制JNK信号通路影响EV71的复制,为临床治疗手足口病提供新的实验依据。但SP600125抑制剂对细胞具有一定的毒性作用,且特异性较低,今后我们将针对JNK设计siRNA进行特异性敲减,研究其对EV71复制的影响;此外,本研究仅在细胞分子水平进行分析,下一步我们将研究EV71感染小鼠后JNK信号通路相关基因变化,同时分析在JNK敲除小鼠中EV71感染情况,并检测病毒RNA和蛋白质水平变化,为JNK信号通路影响EV71的复制提供更多的实验依据。
[1]Yang L, Liu Y, Li S,etal.A novel inactivated enterovirus 71 vaccine can elicit cross-protective immunity against coxsackievirus A16 in mice[J]. Vaccine, 2016,34(48):5938-5945.
[2]Liu J, Wang B, Huang P,etal.Microcystin-LR promotes cell proliferation in the mice liver by activating Akt and p38/ERK/JNK cascades[J]. Chemosphere, 2016,163(2):14-21.
[3]Zhang H, Li F, Pan Z,etal.Activation of PI3K/Akt pathway limits JNK-mediated apoptosis during EV71 infection[J]. Virus Res, 2014,19(2):74-84.
[4]Shi W, Hou X, Li X,etal.Differential gene expressions of the MAPK signaling pathway in enterovirus 71-infected rhabdomyosarcoma cells[J]. Braz J Infect Dis, 2013,17(4):410-417.
[5]Peng X, Fang X, Li J,etal.Enhancing immune responses of EV71 VP1 DNA vaccine by co-inoculating plasmid IL-12 or GM-CSF expressing vector in mice[J]. Cell Mol Biol (Noisy-le-grand), 2016,62(4):35-41.
[6]Wu HM, Zhou K, Wu T,etal. Synthesis of pyrazine-1,3-thiazine hybrid analogues as antiviral agent against HIV-1, influenza A (H1N1), enterovirus 71 (EV71), and coxsackievirus B3 (CVB3)[J]. Chem Biol Drug Des, 2016,88(3):411-421.
[7]Zhou B, Chu M, Xu S,etal.Hsa-let-7c-5p augments enterovirus 71 replication through viral subversion of cell signaling in rhabdomyosarcoma cells[J]. Cell Biosci, 2017,7(7):14-28.
[8]Tung WH, Lee IT, Hsieh HL,etal.EV71 induces COX-2 expression via c-Src/PDGFR/PI3K/Akt/p42/p44 MAPK/AP-1 and NF-kappaB in rat brain astrocytes[J]. J Cell Physiol, 2010,224(2):376-386.
(本文编辑:许晓蒙)
Enterovirus 71 activates the JNK1/2 signaling pathway in human rhabdosarcoma cells
XUChao,PENGYang,SHIWei-feng
(DepartmentofClinicalLaboratory,theThirdAffiliatedHospitalofSoochowUniversity,Changzhou213003,Jiangsu,China)
Objective To investigate the role of c-Jun N-terminal kinase (JNK1/2) signaling pathway in enterovirus 71 (EV71) infection. Methods The effects of different concentrations of SP600125 on the activity of human rhabdosarcoma (RD) cells were detected by trypanbalu staining. The levels of VP1 mRNA and protein in EV71-infected RD cells were detected by real time Q-PCR and western blot, respectively. The levels of total and phosphorylated JNK1/2, c-Fos and c-Jun protein were determined by western blot. Last, the effects of JNK1/2 inhibitor SP600125 on EV71 replication and JNK1/2 signaling pathway were analyzed. Results The results of trypanbalu staining showed that 5 and 10 μmol/L of SP600125 didn′t influence on the activity of RD cells (P>0.05), while 20 μmol/L of SP600125 decreased the survival of RD cells significantly (P<0.05). Compared with the control, the expression levels ofVP1 mRNA and protein in EV71-infected RD cells decreased obviously at 8 hours post-infection (P<0.01). In addition, after RD cells were infected EV71, the levels of phosphorylated JNK1/2, c-Fos and c-Jun increased significantly (P<0.05). However, the pretreatment of SP600125 decreased the phosphorylation levels of JNK1/2, c-Fos and c-Jun protein obviously (P<0.05). Conclusion EV71 infection may effectively activate the JNK1/2 signaling pathway in RD cells, which may be related to EV71 replication.
JNK1/2 signaling pathway; enterovirus 71; human rhabdosarcoma cell
10.13602/j.cnki.jcls.2017.08.20
国家自然科学基金(81572052);江苏省自然科学基金(BK20151178)。
许超,1990年生,男,硕士研究生,主要从事临床微生物与免疫研究。
史伟峰,主任技师,副教授,硕士研究生导师,E-mail:swf67113@163.com。
R512.5
A
2017-04-21)

