Keap1与食管鳞状上皮细胞癌淋巴结转移和浸润深度的关系
马兰英,王华,唐勇
(1.新疆医科大学附属肿瘤医院消化内科,乌鲁木齐 830000;2.新疆医科大学基础医学院,乌鲁木齐 830000)
·临床实验研究·
Keap1与食管鳞状上皮细胞癌淋巴结转移和浸润深度的关系
马兰英1,王华2,唐勇1
(1.新疆医科大学附属肿瘤医院消化内科,乌鲁木齐 830000;2.新疆医科大学基础医学院,乌鲁木齐 830000)
目的 分析Keleh样环氧氯丙烷相关蛋白1(Keleh-like ECH-associated protein 1,Keap1)的表达水平与食管鳞状上皮细胞癌(esophageal squamous cell carcinoma,ESCC)淋巴结转移和浸润深度的关系。方法 采用免疫组化SP法检测ESCC患者的癌组织和癌旁组织中Keap1的表达水平,通过单因素和多因素分析及趋势χ2检验分析其与ESCC淋巴结转移和浸润深度的关系。结果 Keap1高表达与淋巴结转移(OR=3.945,95%CI:1.485~9.147)和浸润深度(OR=4.683,95%CI:1.692~10.275)有关;Keap1高表达是ESCC淋巴结转移的危险因素(Waldχ2=23.579,P<0.01),趋势χ2检验结果显示,ESCC患者淋巴结转移的风险随Keap1表达水平的升高而升高(χ2=5.173,P=0.023);Keap1的表达是ESCC侵及浆膜的危险因素(Waldχ2=26.587,P<0.01),趋势χ2检验结果显示,ESCC侵及浆膜的风险随Keap1表达水平的升高而升高(χ2=9.788,P=0.002)。结论 Keap1的表达与ESCC的发生、发展有关,Keap1的表达可促进ESCC的淋巴结转移和浸润。
Keleh样环氧氯丙烷相关蛋白1;食管鳞状上皮细胞癌;淋巴结转移;浸润深度;单因素分析;多因素分析;趋势χ2检验
Keap1-Nrf2-ARE信号通路是机体抗氧化应激和损伤的重要调节通路,能够诱导机体的内源性抗氧化应答,其主要由Keleh样环氧氯丙烷相关蛋白1(Keleh-like ECH-associated protein 1,Keap1) 和核转录因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)等组成[1]。研究显示,Keap1在肺癌、前列腺癌、胃癌、喉癌、卵巢癌和食管鳞状上皮细胞癌(esophageal squamous cell carcinoma, ESCC)等组织中的表达存在异常,提示其可能与肿瘤的发生、发展有关[2-5]。针对ESCC的研究显示,Keap1在癌组织中的阳性率明显高于正常食管黏膜组织[5]。基于此,本研究拟检测ESCC癌组织和癌旁组织中Keap1的表达水平,明确其与ESCC患者临床病理参数之间的相关性,并进一步分析其与ESCC淋巴结转移和浸润深度的关系,以期探讨Keap1在ESCC发生、发展过程中的作用。
1 材料与方法
1.1 研究对象 以2011年3月至2016年3月于新疆医科大学附属肿瘤医院手术切除且临床资料完备的196例ESCC患者为研究对象,男104例,女92例,年龄34~76岁,中位年龄60岁,均来自新疆及周边地区;纳入标准:(1)经组织病理学检查确诊的ESCC初治患者;(2)均进行手术切除;(3)手术切除前均未进行放、化疗;(4)临床资料完整。排除标准:(1)合并第2原发癌的患者;(2)患有乙肝、丙肝和梅毒等传染病的患者;(3)因其他原因存在肝功损害的患者;(4)不同意参加本研究的患者。其中有淋巴结转移者113例,无淋巴结转移者83例;高中分化鳞状上皮细胞癌156例,低分化鳞状上皮细胞癌40例。采集各研究对象的癌组织,并随机选取31例患者的癌旁食管组织(距离癌组织5 cm以上,且经病理组织学证实无癌细胞)为对照组,男16例,女15例,年龄34~74岁,中位年龄59岁;其中有淋巴结转移者19例,无淋巴结转移者12例;高中分化鳞状上皮细胞癌25例,低分化鳞状上皮细胞癌6例。本研究经医院医学伦理学委员会批准,患者知情同意。
1.2 主要试剂和仪器 兔抗人Keap1多克隆抗体(BA4479-1,武汉博士德公司),通用型SP试剂盒(PV-9000)和DAB显色剂(ZLI-9018)购自北京中杉金桥公司,BX46光学显微镜(日本Olympus公司)。
1.3 免疫组化SP法检测 ESCC癌组织标本和癌旁组织标本用10%甲醛固定,常规石蜡包埋,以4 μm的厚度切片。石蜡切片于60 ℃恒温箱中烘烤20 min,用二甲苯浸泡25 min进行脱蜡;无水乙醇脱水各2 min, 95%、80%、70%乙醇脱水各2 min;抗原修复后加入过氧化氢(H2O2)封闭内源性过氧化氢酶;加入兔抗人Keap1多克隆抗体(1∶100稀释)室温静置1 h;DAB显色液显色5~10 min,苏木精复染2 min,常规脱水、透明、封片和镜检。以PBS代替一抗作为阴性对照,以出现淡黄色或棕黄色反应判断为阳性。染色结果的判定采用双盲法,由2位病理科医师分别进行阅片。Keap1抗原阳性反应定位于细胞质内。随机选取5个高倍镜视野(×200),每个视野分别记数200个细胞,共计数1 000个。阳性结果的判定参照Li等[6]的评判标准,按染色强度分为:0分,无染色;1分,染色呈淡黄色;2分,染色呈棕黄色;3分,染色呈棕褐色;阳性细胞比例<5%记为0分,5%~25%记为1分,26%~50%记为2分,51%~75%记为3分,>76%记为4分,按照染色强度和阳性细胞比例乘积判定免疫组织化学表达水平。接Keap1蛋白的表达水平分为:Keap1高表达组(5~12分)和Keap1低表达组(0~4分)。
1.4 统计学分析 采用SPSS 17.0统计软件进行。单因素分析采用χ2检验或t检验,多因素分析采用Logistic回归分析,表达水平与淋巴结转移和浸润深度之间的关系采用趋势χ2检验。以P<0.05为有统计学意义。
2 结果
2.1 ESCC患者癌组织和癌旁组织中Keap1的表达水平 196例ESCC患者癌组织中140例表达Keap1蛋白(阳性率71.4%),31例癌旁组织中5例表达Keap1蛋白(阳性率16.1%),两组间差异有统计学意义(χ2=35.474,P<0.01)。
2.2 Keap1的表达水平与ESCC患者临床病理参数之间的关系 单因素分析显示,年龄、肿瘤大小、淋巴结转移、分化程度和浸润深度在Keap1高表达组与Keap1低表达组间的差异均具有统计学意义(表1)。多因素分析显示,Keap1的高表达与淋巴结转移和浸润深度有关,与年龄、肿瘤大小和分化程度无关(表2)。
2.3 Keap1的表达水平对淋巴结转移的影响 Logistic回归分析显示,调整年龄、性别、肿瘤大小、TNM分期、分化程度、浸润深度和肿瘤部位后,Keap1表达是ESCC淋巴结转移的危险因素(表3)。趋势χ2检验显示,ESCC患者淋巴结转移的风险随Keap1的表达水平的升高而升高(χ2=5.173,P=0.023)。
2.4 Keap1的表达水平对浸润深度的影响 Logistic回归分析显示,调整年龄、性别、肿瘤大小、TNM分期、分化程度、淋巴结转移和肿瘤部位后,Keap1表达是ESCC侵及浆膜的危险因素(表4)。趋势χ2检验显示,ESCC侵及浆膜的风险随Keap1的表达水平的升高而升高(χ2=9.788,P=0.002)。
表1 Keap1表达水平与ESCC患者临床病理参数的单因素分析结果
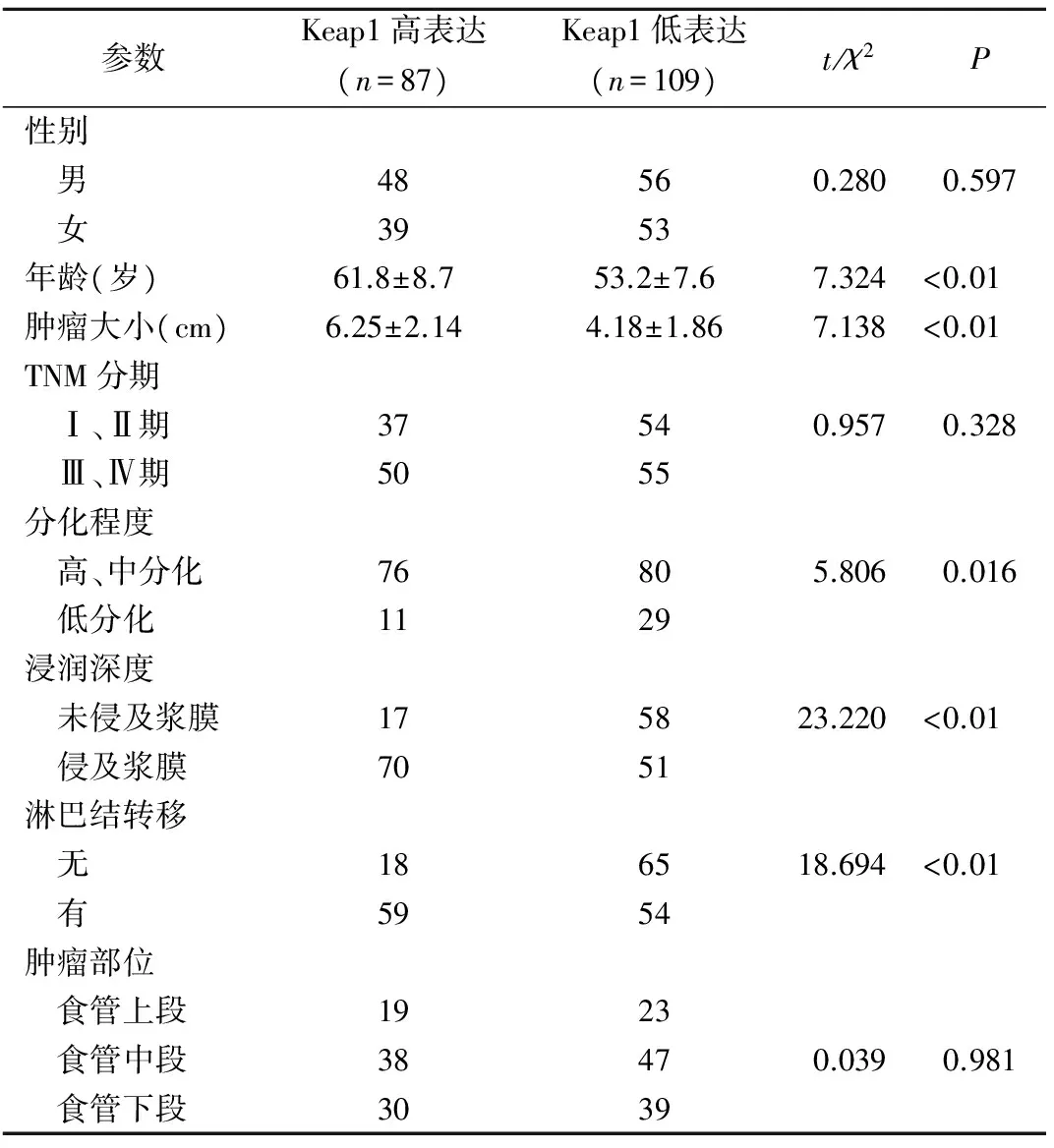
参数Keap1高表达(n=87)Keap1低表达(n=109)t/χ2P性别 男48560.2800.597 女3953年龄(岁)61.8±8.753.2±7.67.324<0.01肿瘤大小(cm)6.25±2.144.18±1.867.138<0.01TNM分期 Ⅰ、Ⅱ期37540.9570.328 Ⅲ、Ⅳ期5055分化程度 高、中分化76805.8060.016 低分化1129浸润深度 未侵及浆膜175823.220<0.01 侵及浆膜7051淋巴结转移 无186518.694<0.01 有5954肿瘤部位 食管上段1923 食管中段38470.0390.981 食管下段3039
3 讨论
Keap1可通过与Nrf2的结合来抑制Nrf2的活性[7]。正常情况下,机体内的Keap1处于“关闭”状态,可使Nrf2泛素化而被降解,从而减少胞质中的Nrf2向核内转移[8]。致瘤因素的刺激和氧自由基(reactive oxygen species,ROS)的攻击可使Keap1的部分结构被修改,导致Nrf2结合部位的构象改变,从而引起Nrf2与其解离,转移至细胞核内,并与解毒Ⅱ相酶启动子区域的抗氧化反应元件(antioxidant response element,ARE) 结合[9]。Nrf2与ARE结合后可以调控下游产物的表达,包括血红素加氧酶1(hemeoxygenase-1,HO-1)、谷胱甘肽S转移酶(glutathione S-transferase,GSTs)和超氧化物歧化酶(superoxide dismutase,SOD)等具有抗炎、抗氧化作用的蛋白质和酶,从而保护机体免受致病因素的损伤。机体恢复平衡后,Keap1又会回到“关闭”状态,使细胞核内/外的Nrf2恢复到原来的水平,维持细胞的氧化还原稳态。由此可见,Keap1是Keap1-Nrf2-ARE信号通路激活的“分子开关”,但Keap1易发生突变,失去对Nrf2 的负性调节,从而导致Nrf2的核定位、表达上调及下游基因的转录激活,同时Nrf2 在细胞核中的累积是肿瘤获得耐药性的重要原因之一。因此,Keap1-Nrf2-ARE信号通路具有双重性。
白美玲等[5]的研究显示,Keap1在ESCC组织中的阳性率明显高于正常的食管组织;杨海虹等[7]的研究显示,晚期非小细胞肺癌患者癌组织中Keap1 mRNA的表达明显升高。本研究结果表明,ESCC组织中Keap1的表达率明显高于癌旁食管组织,与白美玲等[5]的研究结果类似,说明Keap1的表达与ESCC的发生、发展有关。推测其机制可能与高表达的Keap1抑制Nrf2的活化有关。通过进一步分析癌组织中Keap1的表达水平,本研究还发现Keap1的表达是ESCC淋巴结转移和侵及浆膜的危险因素,且ESCC淋巴结转移和侵及浆膜与Keap1的表达水平之间存在剂量-反应关系。进一步证实Keap1的表达与ESCC的发生、发展有关,Keap1的表达可促进ESCC的淋巴结转移和浸润。
本研究的不足之处主要在于没有检测癌组织中Nrf2的表达,因此无法明确解释Keap1促进ESCC的发生、发展的机制,此外,本研究人群主要来源于新疆及周边地区,但并未对不同民族进行分类检测。在下一步的工作中,我们将对Keap1-Nrf2-ARE信号通路与ESCC发生、发展之间的关系进行深入的研究,并纳入民族、地域分布等因素,明确该信号通路在ESCC发生、发展中的作用及其机制。
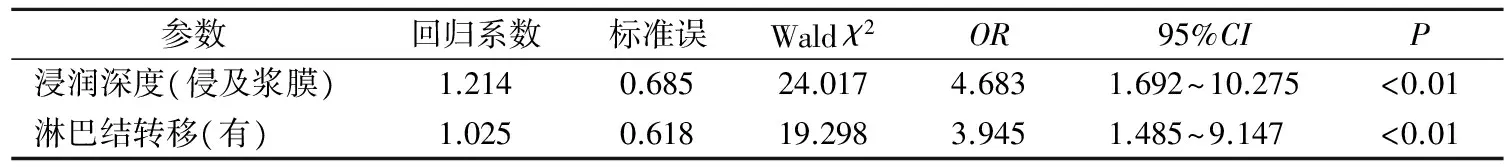
表2 ESCC患者癌组织中Keap1表达水平的多因素分析结果

表3 Keap1的表达与ESCC淋巴结转移的危险因素分析

表4 Keap1的表达与ESCC侵及浆膜的危险因素分析
[1]Lu MC, Ji JA, Jiang ZY,etal. The Keap1-Nrf2-ARE pathway as a potential preventive and therapeutic target:an update [J]. Med Res Rev, 2016, 36(5):924-963.
[2]曹宝山, 朱翔, 陈森, 等.Keap1在非小细胞肺癌中的表达及与化疗疗效相关性的研究[J].中国肺癌杂志, 2012, 15(10):591-596.
[3]Li C, Wu H, Wang S,etal. Expression and correlation of NRF2, KEAP1, NQO-1 and HO-1 in advanced squamous cell carcinoma of the larynx and their association with clinicopathologic features[J]. Mol Med Rep, 2016, 14(6):5171-5179.
[4]Cho HY, Kim K, Kim YB,etal. Expression patterns of Nrf2 and Keap1 in ovarian cancer cells and their prognostic role in disease recurrence and patient survival[J]. Int J Gynecol Cancer, 2017, 27(3):412-419.
[5]白美玲, 郝秀轻, 李峰, 等.食管鳞状上皮细胞癌中Keap1、Nrf2和HO-1的表达及临床病理意义[J]. 临床与实验病理学杂志, 2016, 32(8):914-916.
[6]Li HT, Ma J, Luo L,etal. Expression of Cyclooxygenase-2 and independent factors associated with its over-expression in Uygur and Han breast cancer patients in Xinjiang, China[J]. Int J Clin Exp Med, 2016, 9(8):15942-15948.
[7]杨海虹, 郜靓, 张亚雷, 等.NRF2、Keap1基因及蛋白在非小细胞肺癌肿瘤组织中的表达[J]. 山东医药, 2010, 50(13):57-58.
[8]Ohkoshi A, Suzuki T, Ono M,etal. Roles of Keap1-Nrf2 system in upper aerodigestive tract carcinogenesis[J]. Cancer Prev Res (Phila), 2013, 6(2):149-159.
[9]Liu X, Zhang X, Ma K,etal. Matrine alleviates early brain injury after experimental subarachnoid hemorrhage in rats:possible involvement of PI3K/Akt-mediated NF-κB inhibition and Keap1/Nrf2-dependent HO-1 induction[J]. Cell Mol Biol (Noisy-le-grand), 2016,62(11):38-44.
(本文编辑:许晓蒙)
10.13602/j.cnki.jcls.2017.08.16
马兰英,1983年生,女, 主治医师,硕士,主要从事消化系统肿瘤研究。
唐勇,主任医师,E-mail:mly801021@126.com。
R735.1
A
2017-04-17)

