基于3′/5′端表达不平衡策略的荧光定量PCR法检测非小细胞肺癌患者血浆游离循环RNA中ALK融合基因*
童永清,顾剑,郑红云,刘航,李锋,李艳
(武汉大学人民医院检验医学中心,武汉 430060)
·液体活检与临床实验研究·
基于3′/5′端表达不平衡策略的荧光定量PCR法检测非小细胞肺癌患者血浆游离循环RNA中ALK融合基因*
童永清,顾剑,郑红云,刘航,李锋,李艳
(武汉大学人民医院检验医学中心,武汉 430060)
目的 分析非小细胞肺癌(NSCLC)患者血浆游离循环RNA(cfRNA)中的ALK融合基因的表达水平,为指导临床个体化用药提供依据。方法 选取经高通量测序验证的已知ALK融合基因的NSCLC患者13例、ALK融合基因阴性的NSCLC患者16例和30例体检健康者,采集各组血液样本并分离血浆cfRNA,用荧光定量PCR检测各组ALK基因3′端第20外显子(E20)和5′端3外显子(E3)的表达量,并计算ALK融合基因的表达水平。结果 已知ALK融合基因的NSCLC患者、ALK融合基因阴性的NSCLC患者和体检健康者血浆cfRNA中ALK融合基因表达水平分别为278.3(45.3,987.4),4.08(0.38,9.04),3.77(0.34,8.37),各组间差异有统计学意义(H=29.93,P<0.01);组间两两比较结果表明,已知ALK融合基因的NSCLC患者血浆中ALK融合基因的表达水平高于ALK融合基因阴性的NSCLC患者或体检健康者(U分别为0,0,P均<0.01),而后两组间差异无统计学意义(U=232,P=0.86)。结论 基于3′/5′端表达不平衡策略的荧光定量PCR法可以快速检测NSCLC患者血浆cfRNA中ALK融合基因。
非小细胞肺癌;血浆游离循环RNA;融合基因;4-间变淋巴瘤激酶
非小细胞肺癌(NSCLC)患者存在多种ALK融合基因,如EML4-ALK、KIF5B-ALK、KLC1-ALK和BIRC6-ALK等[1]。新的ALK融合基因如BCL11A-ALK等也相继被发现,为中晚期NSCLC患者使用克唑替尼或色瑞替尼等靶向治疗药物提供了有效的分子依据[2]。目前ALK融合基因的检测标本多为手术切除的肿瘤组织、活检组织或恶性胸水等,但晚期或经放化疗治疗的NSCLC患者往往无法获得上述组织标本,造成ALK融合基因的检测困难。本研究拟建立基于3′/5′端表达不平衡策略的荧光定量PCR法检测NSCLC患者血浆游离循环RNA(cfRNA)中ALK融合基因,可以避免因组织标本难以获得而导致荧光原位杂交(FISH)或逆转录定量PCR(qRT-PCR)等等造成检测失败[3],为NSCLC患者靶向治疗提供实验依据。
1 材料和方法
1.1 研究对象 选取2016年1月至2017年3月于武汉大学人民医院肿瘤科就诊且按照中国原发性肺癌诊疗规范(2015年版)诊断为NSCLC的住院患者236例,纳入标准:(1)中晚期的NSCLC患者,(2)经高通量测序检测ALK融合基因;排除标准:(1)EGFR基因突变阳性;(2)KRAS基因突变阳性。筛选获取符合标准的NSCLC患者29例,男18例,女11例,年龄43.6~71.3岁,中位年龄53.8岁。其中ALK融合基因阳性的NSCLC患者13例,男7例,女6例,年龄45.8~69.4岁,中位年龄55.7岁。ALK融合基因阴性的NSCLC患者16例,男11例,女5例,年龄43.6~71.3岁,中位年龄52.9岁。随机选取同期就诊于我院体检中心的体检健康者30例,男16例,女14例,年龄42.3~75.2岁,中位年龄45.7岁。
1.2 主要仪器及试剂 血浆游离RNA分离试剂盒(批号:73404,德国凯杰生物公司);cDNA第一链合成试剂盒(批号:6210A,中国大连宝生物公司);Nanodrop2000c微量分光光度计(美国赛默飞生物公司);LightCycler 480荧光定量PCR仪(瑞士Roche公司)。
1.3 样本采集 NSCLC患者于确诊且检测了ALK融合基因后采集,体检健康者于体检时采集,均采集空腹静脉血5 mL,EDTA-K2抗凝,按照血浆游离RNA分离试剂盒说明书操作分离血浆cfRNA,Nanodrop2000c微量分光光度计测定吸光度(A260/280 nm)值,取A260/280 nm值为1.8~2.1的RNA样本,按照cDNA第一链合成试剂盒说明书操作将RNA逆转录为cDNA,置-80 ℃保存。
1.4 普通PCR及荧光定量PCR 根据3′/5′表达不平衡策略[4],采用Primer Express 3.01荧光定量PCR软件分别设计ALK基因的第20外显子(E20)
和第3外显子(E3)区域的引物和探针,并以ACTB基因第3外显子(E3)为内参基因(表1),引物由美国赛默飞世尔科技公司合成。PCR反应体系总反应体系为20 μL,包括10 μL /molALK基因E20、E1或ACTB基因E3上、下游引物,各0.5 μL,PCR mix 10 μL,cDNA模板1 μL,去离子水8 μL。普通PCR循环参数:94 ℃ 3 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃ 10 min。反应结束后,PCR产物经20 g/L琼脂糖DNA凝胶电泳分析。荧光定量PCR总反应体系为30 μL,包括5 μmol/LALK基因E20、E1和ACTB基因E3上、下游引物各1 μL,2.5 μmol/LALK基因E20、E1和ACTB基因E3的探针各1 μL,PCR mix 15 μL,cDNA模板2 μL,去离子水4 μL。荧光定量PCR循环参数:94 ℃ 10 min;94 ℃ 30 s,62 ℃ 45 s,共45个循环,在62 ℃采集荧光信号并记录。ALK基因E20和E3表达水平采用2-△Ct法计算,公式:2-△Ct=2-[Ct(ALKE20)/(ALKE3)-Ct(ACTB)]。ALK融合基因的表达水平采用2-△△Ct计算,公式:2-△△Ct=2-[(Ct(ALKE20)- Ct(ACTB)-(Ct(ALKE3)-Ct(ACTB)]。

表1 荧光定量PCR检测ALK基因的引物与探针

2 结果
2.1ALK基因3′/5′端表达验证结果 普通PCR的琼脂糖DNA凝胶电泳结果显示,ALK基因的3′/5′端扩增片段大小与设计大小一致(图1A),提示设计的引物均能有效地进行扩增。进一步用荧光定量PCR检测3′端和5′端ALK基因表达,结果亦表明设计的引物均能有效进行扩增(图1B和1C)。
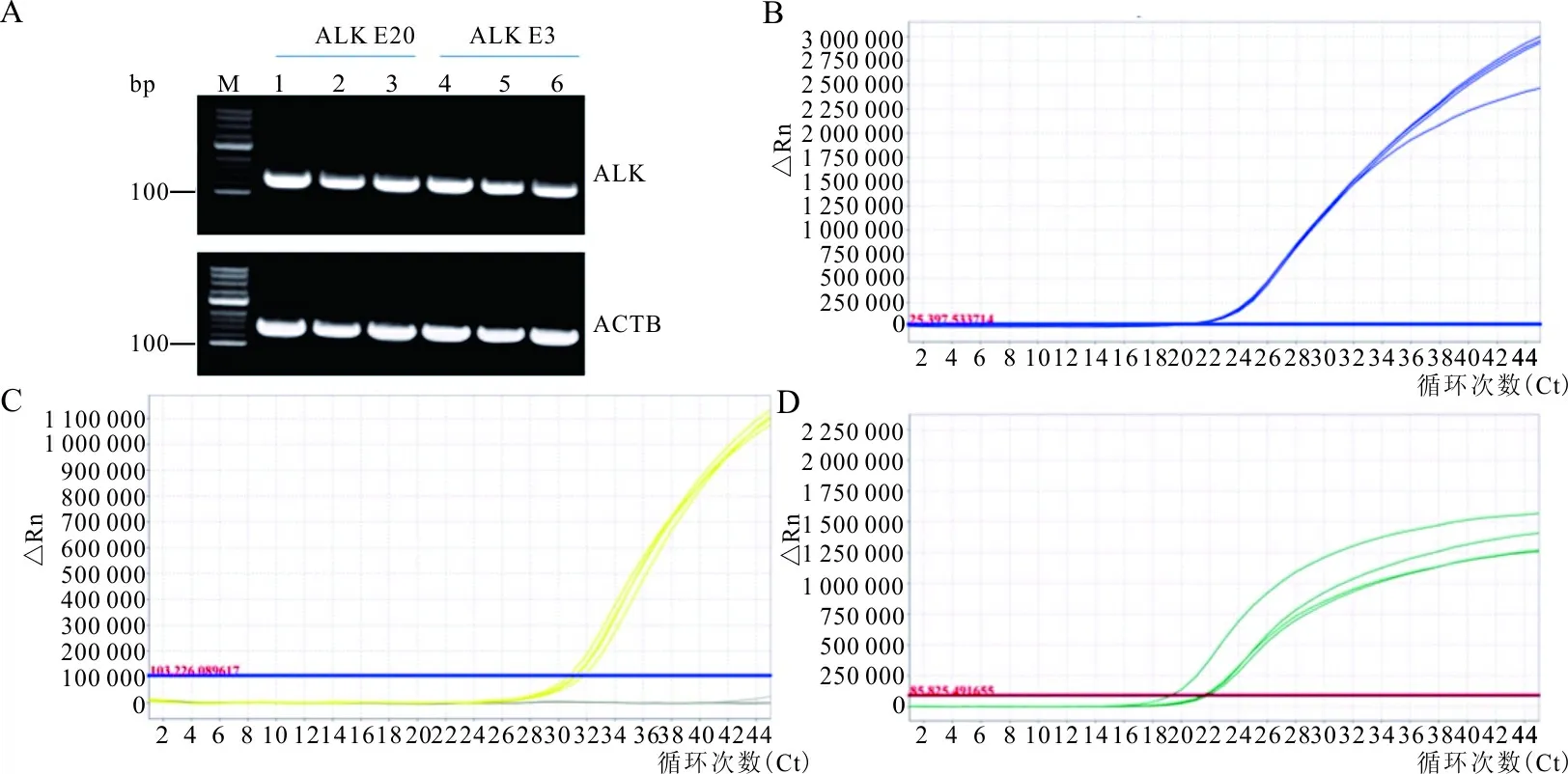
注:A,普通PCR检测ALK基因3′端和5′端结果;B~D分别为荧光定量PCR检测ALK基因3′端、5′端及ACTB基因结果。
图1 普通PCR及荧光定量PCR检测ALK基因3′端和5′端及ACTB基因的表达
2.2 NSCLC患者外周血血浆游离RNA中ALK融合基因检测 qRT-PCR检测结果表明,已知ALK融合基因的NSCLC患者、ALK融合基因阴性的NSCLC患者和体检健康者中血浆cfRNA中ALK融合基因表达水平分别为278.3(45.3,987.4),4.08(0.38,9.04),3.77(0.34,8.37),各组间差异有统计学意义(H=29.93,P<0.01);组间两两比较结果表明,已知ALK融合基因的NSCLC患者血浆中ALK融合基因的表达水平高于ALK融合基因阴性的NSCLC患者或体检健康者(U分别为0,0,P均<0.01),而后两组间差异无统计学意义(U=232,P=0.86)。
3 讨论
研究表明,在NSCLC患者中ALK融合基因的频率约3%~7%[4],超过90%的NSCLC患者不能从使用克唑替尼或色瑞替尼等酪氨酸激酶抑制剂中获益[5]。因此,在使用抑制剂前,应该先进行ALK融合基因的检测,ALK融合基因阳性的NSCLC患者方可使用[6]。传统的qRT-PCR检测ALK融合基因是将上、下游引物分别设计在融合基因中的2个不同基因上,1对引物只能检测特定的融合基因的亚型,同一融合基因的不同亚型之间难以通过同一对引物进行检测,且不能检测已知融合基因新的亚型和新的融合基因。本研究建立的基于3′端和5′端的表达水平不平衡策略的qRT-PCR方法,通过检测ALK基因在3′端和5′端的表达差异,分析二者之间的不平衡现象,预测是否存在ALK融合基因,该方法尽管不能确定是ALK基因与哪个基因发生了融合或融合的亚型,但可以检测出所有ALK融合基因,即只要存在ALK融合基因就可以检测到,无论是已知的ALK融合基因,还是新的ALK融合基因。
在本实验中,通过3′端和5′端的表达水平不平衡策略的qRT-PCR方法检测结果发现,在ALK阳性的NSCLC患者血浆中ALK融合基因表达水平为278.3(45.3,987.4),明显高于ALK阴性的NSCLC患者血浆中ALK融合基因表达水平4.08(0.38,9.04),并且能有效地将二者区分开,二者之间不存在重叠区域,检测结果与高通量测序结果一致,提示3′端和5′端的表达水平不平衡策略的qRT-PCR方法检测NSCLC患者血浆中ALK融合基因较为可靠。Wang等[4]通过该方法检测了NSCLC患者肿瘤组织中ALK融合基因的表达,证实与其他检测方法如FISH、高通量测序、染色体核型分型等结果一致,进一步说明基于3′端和5′端的表达水平不平衡策略的qRT-PCR方法预测NSCLC患者血浆中ALK融合基因的可靠性。
综上所述,本研究建立的基于3′端和5′端的表达水平不平衡策略的qRT-PCR方法检测NSCLC患者血浆中ALK融合基因,有效地弥补了因肿瘤组织不足、缺乏或治疗过程中靶向药物耐药性监测及疗效评价时无法采集肿瘤组织的问题。同时该方法与肿瘤靶基因高通量测序、FISH等比较,其检测时间更短,对仪器设备和人员要求更低,便于临床推广。然而,本研究收集的样本例数较少,且只收集到了EML4-ALK融合基因阳性的NSCLC患者样本,此外,仅初步评价了通过3′端和5′端的表达水平不平衡策略可以检测EML4-ALK融合基因,但没有验证该策略是否可以检测KIF5B-ALK、KLC1-ALK和TFG-ALK等形式的ALK融合基因。因此,需要进一步收集不同形式的ALK融合基因及其亚型,便于验证该方法的灵敏度、特异性和检测的线性范围等,为临床检测NSCLC患者血浆中ALK融合基因提供依据。
[1]van de Krogt JA, Vanden Bempt M, Finalet Ferreiro J,etal.ALK-positive anaplastic large cell lymphoma with the variant RNF213-, ATIC- and TPM3-ALK fusions is characterized by copy number gain of the rearrangedALKgene[J]. Haematologica. 2017. pii: haematol.2016.146571
[2]Tian Q, Deng WJ, Li ZW. Identification of a novel crizotinib-sensitiveBCL11A-ALKgene fusion in a nonsmall cell lung cancer patient[J]. Eur Respir J, 2017,49(4). pii: 1602149.
[3]Kim H, Shim HS, Kim L,etal. Guideline recommendations for testing ofALKgene rearrangement in lung cancer: a proposal of the Korean Cardiopulmonary Pathology Study Group[J]. Korean J Pathol, 2014,48(1):1-9.
[4]Wang R, Pan Y, Li C,etal. The use of quantitative real-time reverse transcriptase PCR for 5′ and 3′ portions ofALKtranscripts to detectALKrearrangements in lung cancers[J]. Clin Cancer Res, 2012, 18(17):4725-4732.
[5]Santarpia M, Daffinà MG, D′Aveni A,etal. ASpotlight on ceritinib in the treatment ofALK+ NSCLC: design, development and place in therapy[J]. Drug Des Devel Ther, 2017,11:2047-2063
[6]Kerr KM, Lopez-Rios F. Precision medicine in NSCLC and pathology: how doesALKfit in the pathway? [J].Ann Oncol, 2016, 27(Suppl 3):iii16-iii24.
(本文编辑:许晓蒙)
10.13602/j.cnki.jcls.2017.08.07
国家自然基金(81502087)。
童永清,1975年生,男,副主任医师,博士,研究方向为肿瘤个体化医疗与临床分子诊断。
李艳,教授,博士研究生导师,E-mail:yanlitf@gmail.com。
R730.43
A
2017-06-07)

