人参皂苷Rg3聚合物胶束的工艺优化研究
荆 鸣 朱春璐 袁子民 李学涛 林彦馨 马雨晨 孔 亮
辽宁中医药大学,辽宁 大连 116600
人参皂苷Rg3聚合物胶束的工艺优化研究
荆 鸣 朱春璐 袁子民*李学涛 林彦馨 马雨晨 孔 亮
辽宁中医药大学,辽宁 大连 116600
目的:对人参皂苷Rg3聚合物胶束的制备工艺进行优化。方法: 采用薄膜水化法,以DSPE-PEG2000为胶束的载体材料,通过正交试验及包封率的测定,对人参皂苷Rg3与DSPE-PEG2000的质量比、水化时间、水化温度及水化体积的四个因素进行考察优化。结果:药物与载体的比为1∶10,水化体积为5mL,水化温度50℃,水化时间为20min,平均包封率为77.9%。结论:该工艺重复性良好,可用于人参皂苷Rg3聚合物胶束的制备。
人参皂苷Rg3;薄膜水化法;聚合物胶束
人参含有40余种人参皂苷类成分,其中人参皂苷Rg3(20(R)-人参皂苷Rg3)是人参中具有抗肿瘤作用的活性成分之一[1],对肺癌、胃癌、肝癌、脑胶质瘤等肿瘤细胞具有较好的抑制效果[2],其对大鼠C6胶质瘤肿瘤干细胞的增殖有显著影响,可能是人参皂苷Rg3 抗胶质瘤的作用机理之一[3]。目前,人参皂苷Rg3已开发成参一胶囊,但Rg3油水分配数较大,口服生物利用度较低,为提高其体内生物利用度及靶向性,目前采用固体分散技术、脂质体制备技术的报道较多[4-6],笔者采用聚合物胶束制备技术,以二硬脂酰磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000)为胶束载体材料,将其制成人参皂苷Rg3聚合物胶束,旨在提高其体内生物利用度及抗脑胶质瘤作用的靶向性,为人参皂苷Rg3制剂的深入研究与开发奠定基础。
1 仪器与材料
1.1 仪器 RE-52A旋转蒸发器(上海亚荣生化仪器厂);Agilent 1100 高效液相色谱仪;HC-2062 高速离心机(安徽中科中佳科学仪器有限公司)。
1.2 材料 20(R)-人参皂苷Rg3原料药(自制,含量>90%);20(R)-人参皂苷Rg3对照品(批号:YAO417YA14,上海源叶生物科技有限公司,含量>98%);DSPE-PEG2000(批号:20150922,上海艾韦特医药科技有限公司);乙腈、甲醇为色谱纯,水为娃哈哈纯净水,其余均为分析纯。
2 方法与结果
2.1 人参皂苷Rg3原料药聚合物胶束的制备 分别取人参皂苷Rg3原料药及二硬脂酰磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000),精密称定,共置烧瓶中,加甲醇20 mL使其溶解,摇匀,40℃旋蒸除去甲醇,于烧瓶内形成一层薄膜,加入适量的pH值为7.4的PBS缓冲液,在一定温度的水浴中水化一定时间,冷却至室温,经0.2μm的聚碳酸酯膜滤过,即得人参皂苷Rg3原料药聚合物胶束[7-8]。同法制备不加人参皂苷Rg3原料药的空白聚合物胶束溶液。
2.2 包封率的测定
2.2.1 色谱条件 色谱柱:Diamonsil TMC18(250mm×4.6mm,5μm);流动相:乙腈-水(50∶50);流速1.0mL/min;柱温:30℃;检测波长:203nm。
2.2.2 对照品溶液的制备 取人参皂苷Rg3对照品适量,精密称定,加甲醇制成0.75mg/mL的对照品溶液,即得。
2.2.3 线性关系考察 分别精密量取“2.2.2”项下对照品溶液0.1、0.25、0.5、1.0、1.5、2.5mL于10mL量瓶中,分别加甲醇稀释至刻度,摇匀,分别精密吸取10μL,注入液相色谱仪,记录峰面积。以对照品浓度为横坐标,峰面积为纵坐标,绘制标准曲线,得回归方程Y=3.3802X+0.9931,r=0.9996。结果人参皂苷Rg3浓度在7.5~187.5μg·mL-1范围内与峰面积呈良好线性关系。
2.2.4 供试品溶液的制备及包封率的测定 精密量取人参皂苷Rg3原料药聚合物胶束0.5mL置10mL量瓶中,加入适量甲醇溶解并稀释至刻度,摇匀,过0.45μm微孔滤膜,测定胶束中总的药物量(W1),并同法制备空白胶束对照液。另精密量取人参皂苷Rg3原料药聚合物胶束2.0mL于5mL离心管中,离心(5000r/min)5min,精密量取上清液0.5mL置10mL量瓶中,按上述载药胶束供试品溶液的制备方法,同法测定离心后胶束中包封的药物量(W2),计算包封率(EE):EE%=W2/W1×100%[8]。
2.2.5 空白干扰试验 精密吸取对照品溶液、载药胶束供试品溶液、空白胶束对照液各10 μL,按“2.2.1”项下的色谱条件测定,结果空白胶束对本品含量测定无干扰。色图谱见图1。
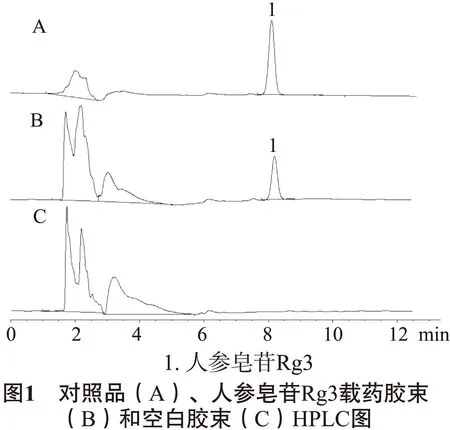
2.2.6 精密度试验 分别精密吸取同一供试品溶液10μL,连续进样6次,记录峰面积,计算RSD为2.02%,表明精密度良好。
2.2.7 重复性试验 取同一载药胶束样品,按“2.2.4”项下的载药胶束供试品溶液的制备方法,分别制备6份,依法测定含量。结果胶束中人参皂苷Rg3的平均含量为0.934mg/mL,RSD为2.36%,表明重复性良好。
2.2.8 稳定性试验 精密吸取同一供试品溶液,分别在0、2、4、6、8、10 h进样10μL,记录峰面积,结果RSD为1.88%,表明人参皂苷Rg3在10 h内稳定。
2.2.9 回收率试验 分别精密量取6份已知含量的载药胶束0.5mL(0.934mg·mL-1),分别置10mL容量瓶中,各精密加入0.6mL人参皂苷Rg3对照品溶液(0.75mg/mL),其余按胶束供试品溶液制备方法及上述色谱条件依法测定,计算回收率,结果平均加样回收率为98.2%,RSD为1.36%,符合规定。
2.3 载药聚合物胶束处方及工艺优化 经单因素考察,本实验以包封率为指标,选取人参皂苷Rg3与DSPE-PEG2000的质量比(A)、水化体积(B)、水化温度(C)、水化时间(D)作为考察因素,因素水平见表1;实验中人参皂苷Rg3量为5 mg,正交试验设计及结果见表2,方差分析结果见表3。
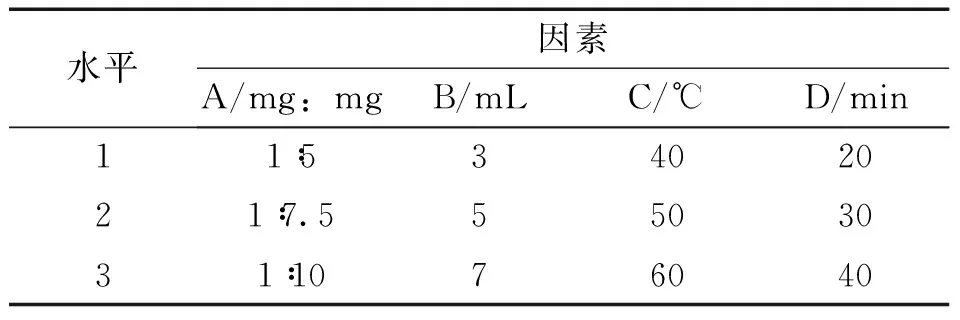
表1 因素水平表

表2 L9(34)正交试验设计及结果 (n=3)
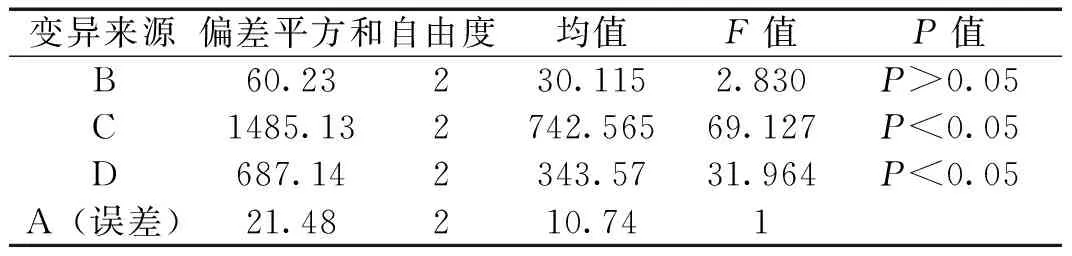
表3 方差分析表(F0.05(2,2)=19.00)
由表2、表3可知,各因素的影响顺序为C>D>B>A,其中C、D因素对工艺的影响具有显著性,确定的最佳工艺条件为A3B2C2D1,即人参皂苷Rg3与DSPE-PEG2000的质量比为1∶10,水化体积为5mL,水化温度为50℃,水化时间为20min。
2.4 制备工艺的验证 按上述的最佳工艺条件,精密称取人参皂苷Rg3原料药 5mg,制备三批载药聚合物胶束,并计算包封率,结果三批载药胶束的包封率分别为76.4%、78%、79.3%,平均包封率为77.9%,表明优化的处方及制备工艺合理、可行、重复性好,且包封率在75%以上,因此,本实验所确定的薄膜水化法的工艺条件,可用于人参皂苷Rg3聚合物胶束的制备。
3 讨论
3.1 介质pH值的选择 实验中曾使用pH值为6.8PBS缓冲液作为水化介质,该介质与pH值为7.4PBS缓冲液介质相比,对包封率影响不大,但含量测定时在203nm波长下基线波动较大,色谱图峰形不佳,故选择pH值为7.4PBS缓冲液作为本实验的水化介质。
3.2 包封率测定方法的选择 由于人参皂苷Rg3在pH值为7.4PBS缓冲液中溶解度较低,因此,本实验采用高速离心法,将未包封的药物离心除去,测定包封率,方法快速、重复性好。
[1]薛丽莉,周海彤,李龙华,等.酶转化人参皂苷中间产品Rg3皂苷的分析[J].大连轻工业学报,2007,26(1):1-4.
[2]谭世强,许永华,王丽芝.人参皂苷Rg3抗肿瘤作用的研究新进展[J].人参研究,2016(3):46-48.
[3]廖丹琼,张建平,付银根,等.人参皂苷Rg3对大鼠脑胶质瘤肿瘤干细胞增殖的影响[J].河南职工医学院学报,2011,23(2):131-133.
[4]潘翠珊,王风华,翁艺芳,等.人参皂苷Rg3脂质体的处方优化及制备工艺研究[J].中药新药与临床药理,2015,26(1):113-117.
[5]叶菲菲,代旸,徐缓,等.人参皂苷Rg3脂质体的制备、表征及对黑色素瘤细胞的生长抑制作用[J].中国新药杂志,2014,23(21):2542-2545.
[6]吴超,赵宗哲,鲁明,等.人参皂苷Rg3 固体分散体渗透泵片的研制及体外释放度考察[J].中草药,2014,45(11):1561-1565.
[7]袁子民,高春华,王静,等.β-榄香烯聚合物胶束的制备工艺研究[J].中国现代应用药学,2016,33(10):1280-1282.
[8]马文转,王金铃,屠鹏飞.黄芩苷纳米胶束的制备、表征及其对MCF-7 细胞抑制作用的研究[J].中草药,2015,46(4):507-512.
Preparation of Gensenoside Rg3 Nano Polymeric Micelles
JING Ming ZHU Chunlu YUAN Zimin*LI Xuetao LIN Yanxin MA Yuchen KONG liang
Liaoning University of TCM,Dalian 116600,China
Objective To optimize the preparation technology of Gensenoside Rg3 Nano Polymeric Micelles. Methods With poly(ethylene glycol-2000)-grafted distearoy lphosphosphatidylethanolamine(DSPE-PEG2000) as the carrier materials, thin film hydration method was used to prepare ginsenoside Rg3 Nano Polymeric Micelles;through orthogonal design and entrapment efficiency of ginsenoside Rg3 determination, it was adopted to optimize four factors of the mass ration ginsenoside Rg3 and DSPE-PEG2000, hydration time,hydration temperature and hydration volume.Results the mass ration ginsenoside Rg3 and DSPE-PEG2000 of 1∶10,hydration volume of 5 mL,hydration temperature of 50℃,hydration time of 20min,entrapment efficiency of 77.9% on average. Conclusion The repeatability of preparation established in this optimization method is good, and it could be used for the preparation of ginsenoside Rg3 Nano Polymeric Micelles .
Ginsenoside Rg3;Thin Film Hydration Method;Nano Polymeric Micelles
辽宁中医药大学大学生创新创业训练计划项目(201610162036)。
荆鸣(1996-),女,汉族,本科在读,研究方向为药物新科技。E-mail:1761541292@qq.com
袁子民(1975-),男,汉族,副教授,研究方向为中药新技术与新剂型。E-mail:yuanzmin@163.com
R283.6
A
1007-8517(2017)15-0021-03
2017-05-23 编辑:程鹏飞)

