肾移植术后抗体介导的排斥反应的新进展
王 维 综述 陈劲松 审校
·肾脏移植·
肾移植术后抗体介导的排斥反应的新进展
王 维 综述 陈劲松 审校
抗体介导的排斥反应(AMR)是肾移植术后常见的严重并发症。近年来大量研究探讨了抗体特征与临床表现、移植肾预后之间的关系。针对非抗HLA抗体的研究更加明确了这些抗体在肾移植中的意义和作用。AMR的诊断也在经历了巨大变革。与排斥诊断、预后相关的生物学标志物不断被发现及验证。小样本研究报道硼替佐米、利妥昔单抗、C1q单抗治疗AMR的疗效,初步表明这些药物的有效性和安全性。此外,在动物实验中多种药物显示了良好的预防/治疗AMR的效能。
肾移植 抗体介导的排斥反应 诊治
肾移植是目前终末期肾病患者最佳的肾脏替代治疗方式,能够提高患者的生活质量和预期寿命。抗体介导的排斥反应(AMR)是危害肾移植长期预后的一个主要原因,也是导致移植肾加速失功的重要推动因素。因此,肾移植领域的科研热点已经从易于治疗、预后较好的细胞性排斥反应转变为治疗棘手的AMR。
近年来,已有大量的研究探讨AMR的发病机制、治疗及预后的生物标志物,有关抗供体特异性抗体(DSA)参与AMR的发病机制亦有大量的相关研究。本文拟简述近年来该领域的研究进展。
DSA特点及其与临床表现的相关性
DSA是受者体内移植前预存的或者是移植术后新发的抗供体器官抗原的抗体,主要针对组织相容性抗原。针对其他抗原的抗体也会介导AMR的发生,如抗内皮细胞抗体、抗人类主要组织相容性复合体(MHC)Ⅰ类链相关基因A抗体。近年来肾移植术前和术后已常规筛查DSA,可有效地识别出高风险受者,以便及时干预。
抗体的特点及其与临床表现的相关性 虽然DSA在AMR发病中起了举足轻重的作用,但是存在DSA并非意味着肯定发生AMR,DSA的平均荧光强度越高也并非意味着临床表现越严重。虽然实验室检查常报告抗体的平均荧光强度,并且一般认为平均荧光强度值4 300~5 300是抗体有临床意义的阈值,但是并非平均荧光强度值本身与AMR是否发生以及临床表现具有很好的相关性。已有研究人员试图通过检测抗体的其他特点来更好地反映抗体的特性及与临床具有更高的关联性。
抗体滴度、平均荧光强度和C1q结合能力是最常用反映DSA抗体属性的方法。Wiebe 等[1]研究了新发抗体的滴度、C1q结合能力与移植肾组织学改变和移植肾存活的关系。他们发现抗体C1q结合能力与AMR是否发生无关,而抗体滴度与AMR是否发生有关。在另外一项实验中,Tambur等[2]发现抗体滴度能够更好地反映抗体的亲和力。此外,抗体的C1q亲和力也和抗体亲和力相关,但是其特异度和灵敏度均较低,因此难以检测低滴度抗体。也有些学者研究抗体的特征与亚临床AMR的关系。Yamamoto等[3]发现新发DSA荧光值>3 000、具有C1q结合能力是亚临床AMR的重要因素。然而,在一项包含611例肾移植受者的回顾性研究发现,新发DSA是否C1q阳性并不影响移植肾存活[4],表明DSA C1q结合能力并不能很好地预测移植肾的预后。
有意思的是,最新的研究表明DSA抗体的类型也与AMR的临床表现相关。Lefaucheur等[5]证实IgG3和IgG4 型DSA与AMR的发生紧密相关。此外,IgG3 与急性AMR相关,IgG4与亚临床AMR相关。
固定补体C3d的能力也是预测AMR的发生及其移植肾预后。在一项包含114例儿童肾移植受者的研究中,有25例新发具有C1q结合能力的 DSA,9例具有结合C3d能力的DSA[6]。随访观察发现,DSA获得C1q和C3d结合能力预示移植肾预后差。与C1q结合能力相比,抗体结合C3d的能力更能准确地将患者移植肾失功的风险进行分层,即能够结合C3d的 DSA的受者更有可能会发生AMR及移植肾失功。
HLA-C、HLA-DP及HLA-DQ位点的意义 最近有几项研究探讨了针对HLA-C、HLA-DP及HLA-DQ抗原的抗体的临床意义。Redondo-Pachón等[7]发现其所分析的所有肾移植术前具有HLA抗体的受者中,有39.7%的受者抗体是针对HLA-DP抗原的;对于术前有DSA的肾移植患者,47.7%的是针对HLA-DP;肾移植术后新发HLA-II类抗体的受者中,56%是针对HLA-DP。另一研究小组发现抗HLA-DP抗体常与抗其他抗原的抗体共存,这就使得明确HLA-DP DSA在AMR发病中的具体作用变得困难[8]。
与HLA-DP不同,HLA-DQ位点在AMR,尤其是慢性AMR的发病中发挥重要作用。虽然DQ位点的DSA(DQ-DSA)和非DQ-DSA的患者组织学上代表体液免疫的形态改变,如小球炎和管周毛细血管C4d沉积并无明显差别,但是DQ-DSA的患者肾小球硬化的比例高于非DQ-DSA的患者,这表明DQ-DSA与AMR明显相关,发现DQ-DSA预示着发生慢性AMR及移植物失功[9]。
抗HLA-C抗体在肾移植中的作用鲜有研究,因为既往有文献指出HLA-C抗原的免疫源性极弱,在肾移植中的作用有限。然而最近这一观点正受到挑战。Bachelet等[10]在一回顾性分析中发现48例预存HLA-C/DP抗体的肾移植受者同104例无DSA的肾移植受者相比,随访2年,前组受者的肾脏无排斥存活更差,因此提议应将HLA-C和HLA-DP位点纳入常规移植位点配对,术前具有HLA-C和HLA-DP位点抗体的受者应该接受去抗体化治疗。
非HLA位点抗体的作用 虽然大多数DSA都是针对HLA位点,但是随着检测手段的进步以及对AMR发病机制的深入理解,Dragun等[11]研究发现抗其他抗原的抗体能够独立性地或与抗HLA抗体协同导致AMR。近两年尤其加深了对抗血管紧张素ⅡⅠ型受体抗体(AT1R-Ab)在肾移植作用的认识。该抗体首先发现于16例临床表现为难治性血管性排异反应和恶性高血压的肾移植受者[11]。目前文献中关于AT1R-Ab在AMR中的报道有出入,这可能是由于合并了其他HLA抗体。Lee等[12]在12例无HLA抗体的AMR患者中发现有10例AT1R-Ab阳性,这反映了AT1R-Ab在AMR中具有重要的作用。实际上AT1R-Ab在AMR中的阳性率各家报道不一,这可能是由于不同研究团队对AT1R-Ab阳性值的设定不同。
此外,与AT1R-Ab同家族的抗内皮素-1A型受体抗体(ETAR)也可介导移植肾排斥反应。有研究发现,47.4%的肾移植受者术前ETAR阳性,该抗体阳性的受者更容易发生排斥反应且并发血管内膜炎的比例较高(7.2%)[13]。术前ETAR阳性患者的远期预后更差。
AMR发病机制
虽然有大量关于DSA导致移植肾功能损害的研究,但是目前对于这些信号通路中的具体分子机制尚不太清楚。传统观点认为补体、巨噬细胞、血小板及自然杀伤细胞在抗体介导的排斥反应发生过程中具有相当重要的作用[14]。新近研究认为,血管内皮-间质转化(EndMT)在此过程中也具有举足轻重的地位[15]。有研究发现,间质细胞的指标,如Fascin-1,vimentin以及热休克蛋白47(HSP47)在AMR时上调。此外,利用这些分子标志物进行AMR的诊断具有相当高的灵敏度(100%)和特异度(85%)。但不得而知的是,内皮细胞进行的EndMT是由DSA直接诱导还是间接作用导致。
AMR的治疗
传统观点认为DSA在AMR中具有极其重要的作用,因此既往的治疗方法主要是围绕如何去除抗体或者是阻止抗体发挥作用。最近利妥昔单抗和硼替佐米使用较多。前者可以去除CD20阳性的淋巴细胞,后者可直接杀伤浆细胞,均减少抗体的产生。随着对AMR发病机制的理解,一些补体抑制剂也正处于试验性使用之中。目前关于AMR治疗方案的研究归纳于表1。
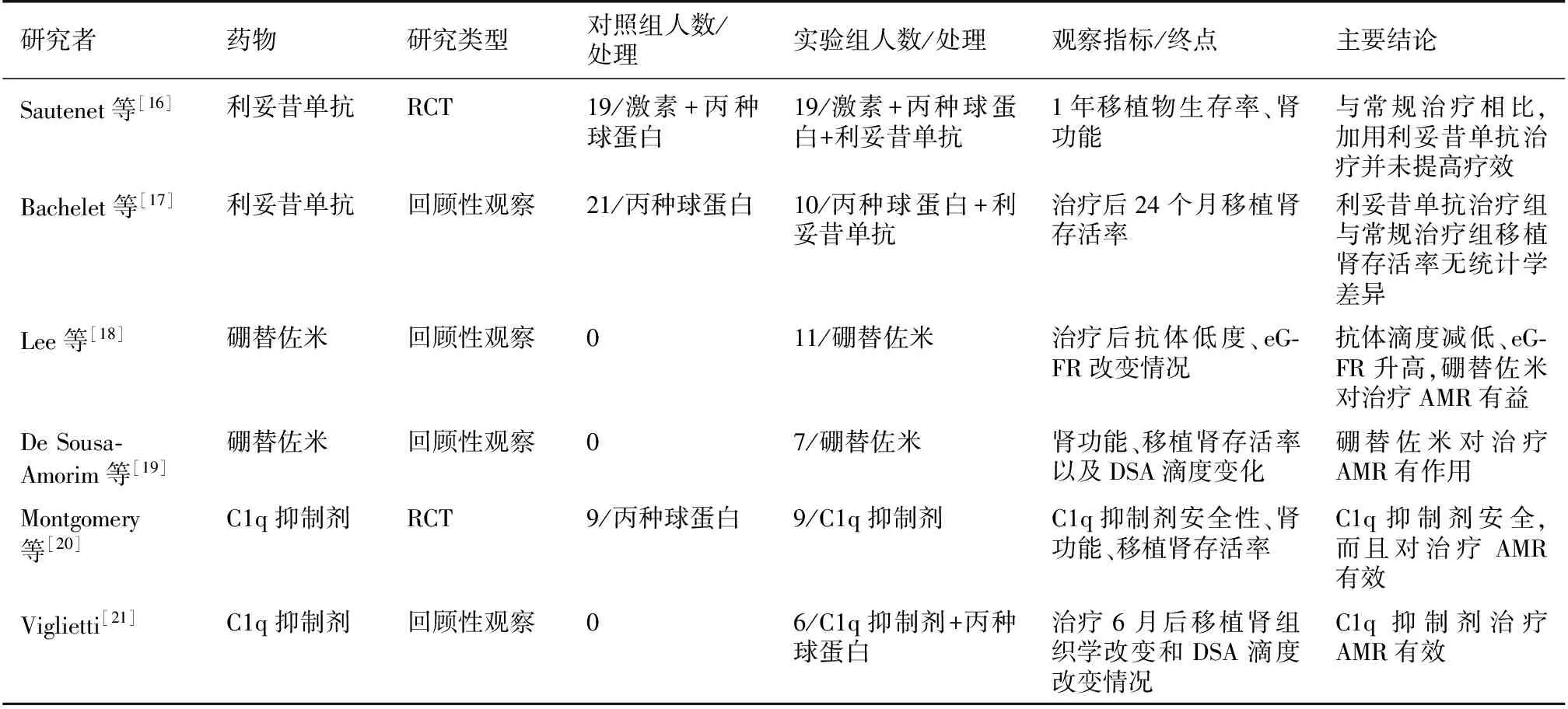
表1 关于AMR治疗方案的研究
AMR:抗体介导的排斥反应;RCT:随机对照研究
近期有两项研究探讨了利妥昔单抗在急性AMR和慢性AMR中的疗效。Sautenet等[16]进行了一项多中心、双盲的随机对照研究以明确利妥昔单抗是否可以有效地阻止移植肾因急性AMR而失功,发现与常规治疗(血浆置换、大剂量激素/丙种球蛋白冲击)相比,利妥昔单抗治疗组在1个月和6个月时的肾脏组织学改善并无统计学意义。由于该项研究利妥昔单抗治疗组仅纳入38例患者,因此有可能是病例数量不足导致统计学上无意义。另一研究小组比较了利妥昔单抗+大剂量丙种球蛋白冲击在治疗慢性AMR中的作用,发现21例治疗组患者与10例对照患者移植肾存活时间并无统计学差异[17]。此外,也有研究指出,病情较重的AMR患者(蛋白尿较多、移植肾功能下降等)对利妥昔单抗的反应较病情较轻的患者反应差[22]。因此,病程早期给予利妥昔单抗可能疗效更佳。
硼替佐米在AMR中的使用均是小样本观察性研究。Lee等[18]观察了11例使用硼替佐米治疗AMR的情况,8例抗体低度明显降低。总体上,在治疗3月后,肾小球滤过率较初诊时明显改善。此外,11例中6例早期AMR的患者肾功能得到完全恢复,而5例迟发的AMR中仅3例肾功能有一定程度改善。De Sousa-Amorim等[19]也报道了他们使用硼替佐米治疗7例难治性AMR的经验,5例患者肾功能稳定而另外2例患者肾功能持续恶化。所有患者经治疗后抗体低度明显下降。虽然这些小样本研究显示具有一定的疗效,但是唯有大的前瞻性研究才能最终解答这一问题。
近年有两项临床研究观察了C1q抑制剂治疗肾移植术后AMR有效性和安全性。Montgomery等[20]进行了一项RCT研究,共入组18例AMR患者(9例对照组使用血浆置换+大剂量丙种球蛋白治疗,9例治疗组使用血浆置换+大剂量丙种球蛋白+C1q抑制剂治疗)。在研究期间,未发生C1q抑制剂相关的严重不良反应(主要是深静脉血栓)。治疗20d后肾穿刺活检病理显示两组组织学改善程度相似,但是6个月穿刺活检显示C1q抑制剂治疗组受者未发生移植物肾小球病,而对照组有3例发生移植物肾小球病。因为移植物肾小球病强烈提示移植肾预后不良,该研究组认为C1q抑制剂治疗AMR安全且有效。Viglietti 等[22]进行了一项前期研究,主要是观察C1q抑制剂+大剂量丙种球蛋白冲击治疗难治性AMR的有效性。该研究共入组6例患者,主要观察指标是治疗后6个月组织学改变和DSA改变情况。在此期间发生了1例下肢深静脉血栓。组织学层面,除了C4d染色程度降低外,其他指标并无明显改善。综合分析目前有限的临床研究数据,C1q抑制剂治疗AMR相对安全、有一定的疗效。但是这些研究也都是小样本研究[23]。此外,不同试验所使用的具体的C1q抑制剂有所差别,因此在推广使用C1q抑制剂前大样本、多中心RCT研究很有必要。
此外,动物实验证实了一些药物的疗效。Brownet 等[24]开发了一种新的免疫毒性药物,能使MHC错配的肾移植小鼠无限期存活并减少抗体产生。该药物主要结构是抗MHC II类分子单克隆抗体F(ab’)2片段。Young等[25]发现对小鼠实验模型使用CTLA4-Ig能够抑制B细胞反应及抗体产生。Doirier等[26]报道CD28的拮抗剂——FR104能够阻滞效应T细胞的活化和增殖,继而抑制B细胞的活化和抗体的生成。
AMR标志物
目前肾活检依旧是诊断AMR的金标准,但是其本身为一种有创性检查方法。此外,一些形态学指标本身具有一定的局限性。2015年版的Banff分类引入了分子病理,提出其可能的应用前景[27]。近几年来移植界对AMR相关的分子改变兴趣浓厚,研究人员利用各式各样的平台探讨AMR中相关的基因及分子改变。
不同的研究小组探究了BAFF用以诊断肾移植后急性排斥的潜在价值。已有研究发现BAFF是一种抗体产生的生物学标志物,其与狼疮活动相关。Pongpirul等[28]根据围手术前血浆中BAFF浓度将68例患者分为BAFF高低两组,高BAFF组患者术后更容易发生急性排斥反应(风险比:7.30)。另一研究小组也得到了相似地结论,移植前BAFF水平与术后发生AMR显著相关,但是术后BAFF水平与AMR无关[29]。
Maehana等[30]发现,发生急性排斥反应的患者HSP 90明显增高。体外研究表明,HSP 90在经抗体处理的人主动脉内膜细胞分泌的血清中明显增加。因而,HSP 90具有成为辅助诊断急性排斥反应的潜在价值。Rabant等[31]发现患者尿液中一种γ干扰素依赖的趋化因子——C-X-C模体趋化因子10(CXCL10)与肾脏微循环炎症有关,使用尿液中CXCL10/肌酐来诊断AMR具有很高的准确率,并与移植物预后相关。
小结:随着强效免疫抑制剂在肾移植后的常规使用,AMR已经取代细胞介导的排斥反应成为严重影响移植肾存活的术后并发症。近年来针对非传统抗原的抗体和非抗HLA抗体亦有不少研究和报道。与此同时,越来越多与排斥诊断、预后相关的生物学标志物被发现及验证。蛋白酶体抑制剂和补体抑制剂正试验性的用于临床治疗AMR,但疗效不一。现有资料多为小样本研究,仍需大样本多中心临床试验来评估这些药物治疗AMR的有效性和安全性。还有一些药物在动物实验中显示了预防/治疗AMR的良好前景,有望揭示AMR的发病机制并应用于临床。
1 Wiebe C,Gareau AJ,Pochinco D,et al.Evaluation of C1q status and titer of De Novo Donor-specific antibodies as predictors of allograft survival.Am J Transplant,2016,17(3):703-711.
2 Tambur AR,Herrera ND,Haarberg KM,et al.Assessing antibody strength: comparison of MFI,C1q,and titer information.Am J Transplant,2015,15(9): 2421-2430.
3 Yamamoto T,Watarai Y,Takeda A,et al.De novo anti-HLA DSA characteristics and subclinical antibody-mediated kidney allograft injury.Transplantation,2016,100(10):2194-2202.
4 Kauke T,Oberhauser C,Lin V,et al.De novo donor-specific anti-HLA antibodies after kidney transplantation are associated with impaired graft outcome independently of their C1q-binding ability.Transpl Int,2017,30(4):360-370.
5 Lefaucheur C,Viglietti D,Bentlejewski C,et al.IgG donor-specific anti-human HLA antibody subclasses and kidney allograft antibody-mediated injury.J Am Soc Nephrol,2016,27(1):293-304.
6 Comoli P,Cioni M,Tagliamacco A,et al.Acquisition of C3d-binding activity by de novo donor-specific HLA antibodies correlates with graft loss in nonsensitized pediatric kidney recipients.Am J Transplant,2016,16(7):2106-2116.
7 Redondo-Pachón D,Pascual J,Pérez-Sáez MJ,et al.Impact of preformed and de novo anti-HLA DP antibodies in renal allograft survival.Transpl Immunol,2016,34:1-7.
8 Hörmann M,Dieplinger G,Rebellato LM,et al.Incidence and impact of anti-HLA-DP antibodies in renal transplantation.Clin Transplant,2016,30(9):1108-1114.
9 Carta P,Di Maria L,Caroti L,et al.Anti-human leukocyte antigen DQ antibodies in renal transplantation: Are we underestimating the most frequent donor specific alloantibodies? Transplant Rev (Orlando),2015,29(3):135-138.
10 Bachelet T,Martinez C,Del Bello A,et al.Deleterious impact of donor-specific anti-HLA antibodies toward HLA-Cw and HLA-DP in kidney transplantation.Transplantation,2016,100(1):159-166.
11 Dragun D,Müller DN,Bräsen JH,et al.Angiotensin II type 1-receptor activating antibodies in renal-allograft rejection.N Engl J Med,2005,352(6):558-569.
12 Lee J,Park Y,Kim BS,et al.Clinical implications of angiotensin II type 1 receptor antibodies in antibody-mediated rejection without detectable donor-specific HLA antibodies after renal transplantation.Transplant Proc,2015,47(3):649-652.
14 Amore A.Antibody-mediated rejection.Curr Opin Organ Transplant,2015,20(5):536-542.
15 Xu-Dubois YC,Peltier J,Brocheriou I,et al.Markers of endothelial-to-mesenchymal transition: Evidence for antibody-endothelium interaction during antibody-mediated rejection in kidney recipients.J Am Soc Nephrol,2016,27(1):324-332.
16 Sautenet B,Blancho G,Büchler M,et al.One-year results of the effects of rituximab on acute antibody-mediated rejection in renal transplantation: RITUX ERAH,a multicenter double-blind randomized placebo-controlled trial.Transplantation,2016,100(2):391-399.
17 Bachelet T,Nodimar C,Taupin JL,et al.Intravenous immunoglobulins and rituximab therapy for severe transplant glomerulopathy in chronic antibody-mediated rejection: a pilot study.Clin Transplant,2015,29(5):439-446.
18 Lee J,Kim BS,Park Y,et al.The Effect of bortezomib on antibody-mediated rejection after kidney transplantation.Yonsei Med J,2015,56(6):1638-1642.
19 De Sousa-Amorim E,Revuelta I,Diekmann F,et al.Bortezomib for refractory acute antibody-mediated rejection in kidney transplant recipients: A single-centre case series.Nephrology (Carlton),2016,21(8):700-704.
20 Montgomery RA,Orandi BJ,Racusen L,et al.Plasma-derived C1 esterase inhibitor for acute antibody-mediated rejection following kidney transplantation: results of a randomized double-blind placebo-controlled pilot study.Am J Transplant,2016,16(12):3468-3478.
21 Viglietti D,Gosset C,Loupy A,et al.C1 Inhibitor in acute antibody-mediated rejection nonresponsive to conventional therapy in kidney transplant recipients: a pilot study.Am J Transplant,2016,16(5):1596-1603.
22 Ejaz NS,Shields AR,Alloway RR,et al.Randomized controlled pilot study of B cell-targeted induction therapy in HLA sensitized kidney transplant recipients.Am J Transplant,2013,13(12):3142-3154.
23 Haririan A.Current status of the evaluation and management of antibody-mediated rejection in kidney transplantation.Curr Opin Nephrol Hypertens,2015,24(6):576-581.
24 Brown K,Nowocin AK,Meader L,et al.Immunotoxin against a donor MHC class II molecule induces indefinite survival of murine kidney allografts.Am J Transplant,2016,16(4):1129-1138.
25 Young JS,Chen J,Miller ML,et al.Delayed cytotoxic T lymphocyte-associated protein 4-Immunoglobulin treatment reverses ongoing alloantibody responses and rescues allografts from acute rejection.Am J Transplant,2016,16(8):2312-2323.
26 Poirier N,Dilek N,Mary C,et al.FR104,an antagonist anti-CD28 monovalent fab′ antibody,prevents alloimmunization and allows calcineurin inhibitor minimization in nonhuman primate renal allograft.Am J Transplant,2015,15(1):88-100.
27 Loupy A,Haas M,Solez K,et al.The Banff 2015 kidney meeting report: current challenges in rejection classification and prospects for adopting molecular pathology.Am J Transplant,2017,17(1):28-41.
28 Pongpirul W,Chancharoenthana W,Pongpirul K,et al.B-Cell Activating Factor (BAFF),a predictor of antibody mediated rejection in kidney transplantation recipients.Nephrology (Carlton),2016.
29 Min JW,Kim KW,Kim BM,et al.Clinical significance of Pre- and Post-transplant BAFF levels in kidney transplant recipients.PLoS One,2016,11(9):e0162964.
30 Maehana T,Tanaka T,Kitamura H,et al.Heat shock protein 90α is a potential serological biomarker of acute rejection after renal transplantation.PLoS One,2016,11(9):e0162942.
31 Rabant M,Amrouche L,Lebreton X,et al.Urinary C-X-C motif chemokine 10 independently improves the noninvasive diagnosis of antibody-mediated kidney allograft rejection.J Am Soc Nephrol,2015,26(11):2840-51.
(本文编辑 律 舟)
Antibody-mediated rejection in kidney transplantation: an update
WANGWei,CHENJinsong
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
The main conundrum complicating long-term survival of transplanted kidney is antibody-mediated rejection (AMR).Intense research intended to correlate antibody characteristics with clinical manifestations and graft prognosis.Research regarding antibodies against non-HLA antigens improved appreciation of their significance in kidney transplantation.The diagnosis of AMR changed dramatically and a host of bio-markers for kidney rejection and graft survival have been discovered and validated.The efficacy and safety profiles of bortezomib,rituximab and C1q monoclonal antibody use in the treatment of AMR have been reported with small number of patients.Furthermore,some drugs have been found to be effective in AMR prevention and treatment in animal studies.
kidney transplantation antibody-mediated rejection update
10.3969/j.issn.1006-298X.2017.04.019
南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2017-03-14

