肾组织慢性化病变分级及非典型溶血尿毒综合征和C3肾病的最新专家共识
侯金花 梁丹丹 丁 吟 蒋 琦 张丽华 曾彩虹 刘志红
·亮点关注·
肾组织慢性化病变分级及非典型溶血尿毒综合征和C3肾病的最新专家共识
侯金花 梁丹丹 丁 吟 蒋 琦 张丽华 曾彩虹 刘志红
众所周知,在肾活检病理中慢性化病变程度的评估对于判断预后、指导治疗具有重要意义,但目前尚缺乏统一规范的分级标准。2017年Kidney International(KI)杂志刊登了由多名国际知名肾脏病理专家共同提出的一种评分分级系统,具体方法为对肾小球硬化(GS)、肾小管萎缩(TA)、间质纤维化(IF)、动脉硬化(CV)进行半定量评分,计算慢性化分级的总分,并最终在肾活检报告中如实记录。
改善全球肾脏病预后组织(KDIGO)2015年召集全球专家,围绕非典型溶血尿毒综合征(aHUS)和C3肾病(C3G)的肾脏病理、临床表型和评估、治疗策略、遗传因素、后天因素和治疗策略展开讨论。这两种疾病虽然是不同的疾病实体,但均涉及到补体系统异常,无论在发病机制还是临床表现都有交叠,甚至可同时发生。此次报告具有提高对两者的认识和诊治作用,并对争议性问题提出研究建议。报告整理后近期发表在KI上。
本文精选新近两篇来自权威专家组的共识,希望对了解这两个领域的信息有所帮助。
肾组织慢性化病变的分级标准[1]
目前肾活检报告对肾组织慢性化病变程度评估并不完善。由于慢性病变的不可逆性,其对肾功能的影响意义重大。慢性病变在预测疾病的预后、指导治疗、评估治疗反应等方面的重要性和明确病因具有同样的重要性。因此,提出一种规范的肾组织慢性病变程度分级系统非常必要。
肾组织皮质和髓质均可出现慢性化改变,但评估时主要看皮质,皮质慢性病变包括GS、TA、IF和CV。慢性化改变可能出现在急性肾脏病发生的数周或数月后,亦可在无任何急性病变的情况下缓慢发展而成。GS定义为肾小球毛细血管袢球性或节段塌陷、细胞外基质增多,并导致毛细血管袢腔闭锁。GS多表现为节段病变,可见于多种情况:炎性病变后形成瘢痕,肾单位减少引起的代偿性改变,原发性局灶节段性肾小球硬化中足细胞损伤所致,以及其他肾小球疾病如IgA肾病。如果整个肾小球均受累则称为肾小球球性硬化。缺血的肾小球毛细血管袢完全或接近完全皱缩,常伴包囊壁相对扩张,亦归为球性硬化。TA定义为肾小管基膜皱缩伴不同程度的增厚,肾小管上皮细胞扁平。IF定义为肾小管之间的纤维组织增多,与TA几乎同时发生。CV定义为动脉内膜纤维性增厚和(或)透明变性。无论是萎缩区还是非萎缩区的间质炎症都不是慢性病变,而是潜在的能促进肾脏慢性病变进展的因素。
慢性病变已被证实对多种肾脏疾病的预后有影响,包括狼疮性肾炎、抗中性粒细胞胞质抗体相关性血管炎、IgA肾病。近期一项654例患者的研究,纳入了狼疮性肾炎、IgA肾病、糖尿病肾病、其他原发性肾小球疾病以及非肾小球疾病,该研究证实GS、IFTA、中/重度CV均是影响预后的独立危险因素。慢性病变在移植肾的预后判断中也很关键,移植肾报告的Banff分类中也强调了慢性病变的重要性。
2015-02-20肾脏病理学家和肾病学家提出“梅奥诊所/肾脏病理学会关于肾小球肾炎病理分类、诊断及报告共识”。该共识指出需将慢性病变附于报告中,包括肾小球球性硬化比例、IFTA比例、动脉硬化程度等。然而,仅仅列出这些结果并不能反映肾组织慢性化程度。病理学家一般选择重复性好的慢性化指标,而不是急性病变如系膜增生和毛细血管内增生。已有研究证实病理学家对纤维化的半定量与TA和IF的定量分析相关性最好。
将球性和节段GS评分0~3分,TA评分0~3分,IF评分0~3 分,CV分为0和1(表1),然后将所有评分累加,即得出肾组织总慢性评分,再根据总分分级:轻微(0~1分),轻度(2~4分)、中度(5~7分)和重度(≥8分)。不同疾病中已证实GS和IFTA提示肾脏预后不良,但CV的预测作用未得到证实,因此CV在积分中占权重少,此外动脉透明变性也未纳入动脉硬化的评分中。建议将慢性病变分级作为独立项目记录在报告中。因此基于“梅奥诊所/肾脏病理学会关于肾小球肾炎病理分类、诊断及报告共识”,诊断不仅包括主要诊断、肾小球病变损伤类型、其他特征、次要诊断外,还需包括慢性病变分级。部分肾脏疾病已有相应的评分系统,且已对慢性病变进行半定量评分,比如IgA肾病牛津分型中S和T评分,狼疮性肾炎的CI评分,这种情况下不需要再另外行慢性病变分级。
综上所述,COPD急性加重期患者持续给予盐酸氨溴索治疗16d的疗效优于8d,也能增强抗炎作用,值得临床推广。
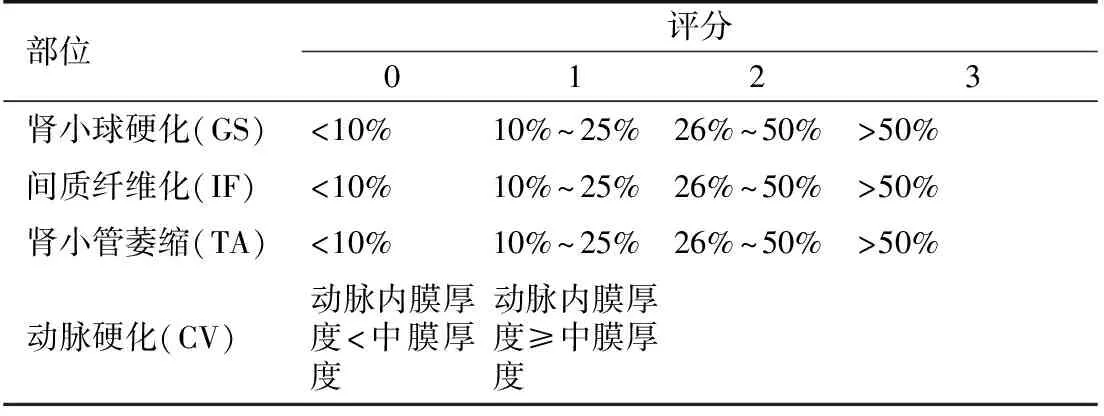
表1 肾活检组织慢性病变程度评分
GS计分包括球性和节段硬化肾小球,及缺血肾小球;IF/TA指皮质区;CV指动脉内膜厚度
慢性病变分级必须注意以下三个问题。首先,进行评分和分级需要充足的皮质组织。参考移植肾Banff分类,符合评估要求的肾皮质要包含至少10个肾小球和2条动脉。肾包膜下皮质的病变不建议纳入分级区域,因为这可能会加重慢性病变分级,而不能反映真实情况。因此进行慢性病变分级时需说明取材是否达到要求。其次,随着年龄增长,健康成人肾脏也可出现慢性病变。年龄>50岁的健康人肾小球球性硬化的95百分位数超过10%。老龄化导致的慢性化病变与疾病引起的,两者不易区分。第三,有些慢性病变并非完全由主要诊断的疾病导致,可能是由之前已存在的高血压、糖尿病所致。因此如果患者临床有合并疾病,往往很难鉴别慢性病变的具体病因。但是,不管具体病因为何,慢性病变本身即是肾脏影响预后的重要因素。慢性病变程度的临床意义重大,单独列出非常必要。
慢性病变评分和分级并不是分类,而是一个系统性、半定量的方法来评估和报告慢性病变。慢性病变不具疾病特异性,在不同肾脏病具有不同的预后预测和治疗提示作用。需基于循证医学的预后研究来判断这个分级系统是否广泛适用于所有肾脏病或是否具有疾病特异性。
建议在GS、TA、IF和CV各病变程度的基础上,再计算出总慢性病变评分,并作为诊断的一部分。这个分级系统提供评价治疗反应和预后的统一标准,尤其适用于临床试验和观察性研究。但是,后续还需更多的研究去判断这个评分分级系统对预后的预测价值,明确各个指标的重要性,并进一步改进调整该评分系统。
aHUS和C3G最新专家共识[2]
aHUS和C3G是典型的补体介导的肾脏疾病。aHUS极其罕见,发病率仅为0.5/百万,临床主要表现为急性肾损伤、血小板减低和微血管病性溶血性贫血,约半数患者存在基因缺陷,多数患者预后不良,发病2年内进展至终末期肾病。C3G是一种罕见病变(发病率1/百万),特征是补体异常活化致C3沉积于肾小球。依据电镜结果,C3G分为致密沉积物(DDD)和C3肾小球肾炎(C3GN)。
肾脏病理
aHUS aHUS是一种血栓性微血管病变(TMA),病理特征是内皮损伤反应。如果仅有非血栓性病变,就不能称作是血栓性微血管病,建议改为微血管病变,并标注有无血栓。补体异常、药物毒性及造血干细胞移植所致的微血管病变可伴C5b-9沉积,但检测结果可信度尚待商榷。组织病理改变不能明确病因,建议对恶性高血压患者和补体旁路途径异常患者在组织学形态和免疫组化特点上进行比较研究,以更好地区分两者。
C3G C3G光镜表现多样,免疫荧光以补体C3沉积为主(强度至少比其他免疫球蛋白和补体成分高2个级别)。初次活检表现不典型者,需重复肾活检。部分C3G可伴驼峰样沉积。急性渗出性肾小球肾炎中合并肾小球基底膜双轨征时应高度怀疑C3G。鉴于有单克隆免疫球蛋白沉积抗原被遮蔽的报道,因此推荐所有经标准免疫荧光染色后考虑C3GN的患者(尤其是成人)需用链霉蛋白酶消化后的石蜡切片重染IgG和轻链。
C4d区分C3G和免疫复合物相关肾小球肾炎的价值尚需验证。免疫荧光偏主观,可信度和可重复性欠佳,尚不清楚能否用电镜下沉积物的密度来区分DDD和C3GN。免疫荧光或者激光微分离质谱可以鉴别肾小球内的补体成分,但还不确定组织中特殊片段(比如C5b-9)能否作为特殊用药指征(如抗C5单抗治疗)。
临床表型和评估 目前将存在潜在补体旁路途径调节异常的HUS定义为原发性aHUS。此类患者往往在自身免疫异常、移植、怀孕、感染、药物、代谢异常等因素的刺激下发病。触发因素激发放大潜在的补体缺陷的机制尚不清楚(图1)。患者终生有急性复发的风险。年龄>70岁人群的外显率高达64%。病理和临床表现有时并不一致,如病理为血栓性微血管病变,临床可不伴血小板减少。20%的aHUS患者有肾外表现。虽aHUS和老年黄斑变性有很多共同的补体因子H(CFH)和补体因子I(CFI)基因罕见变异,但玻璃膜疣在aHUS患者中并不常见。
C3G大多起病隐匿、进展相对缓慢,10年肾存活率约50%,也有部分患者以快速进展性肾小球肾炎起病。部分患者合并获得性部分脂肪营养不良和视网膜玻璃膜疣。前者最常见于C3肾炎因子阳性患者。
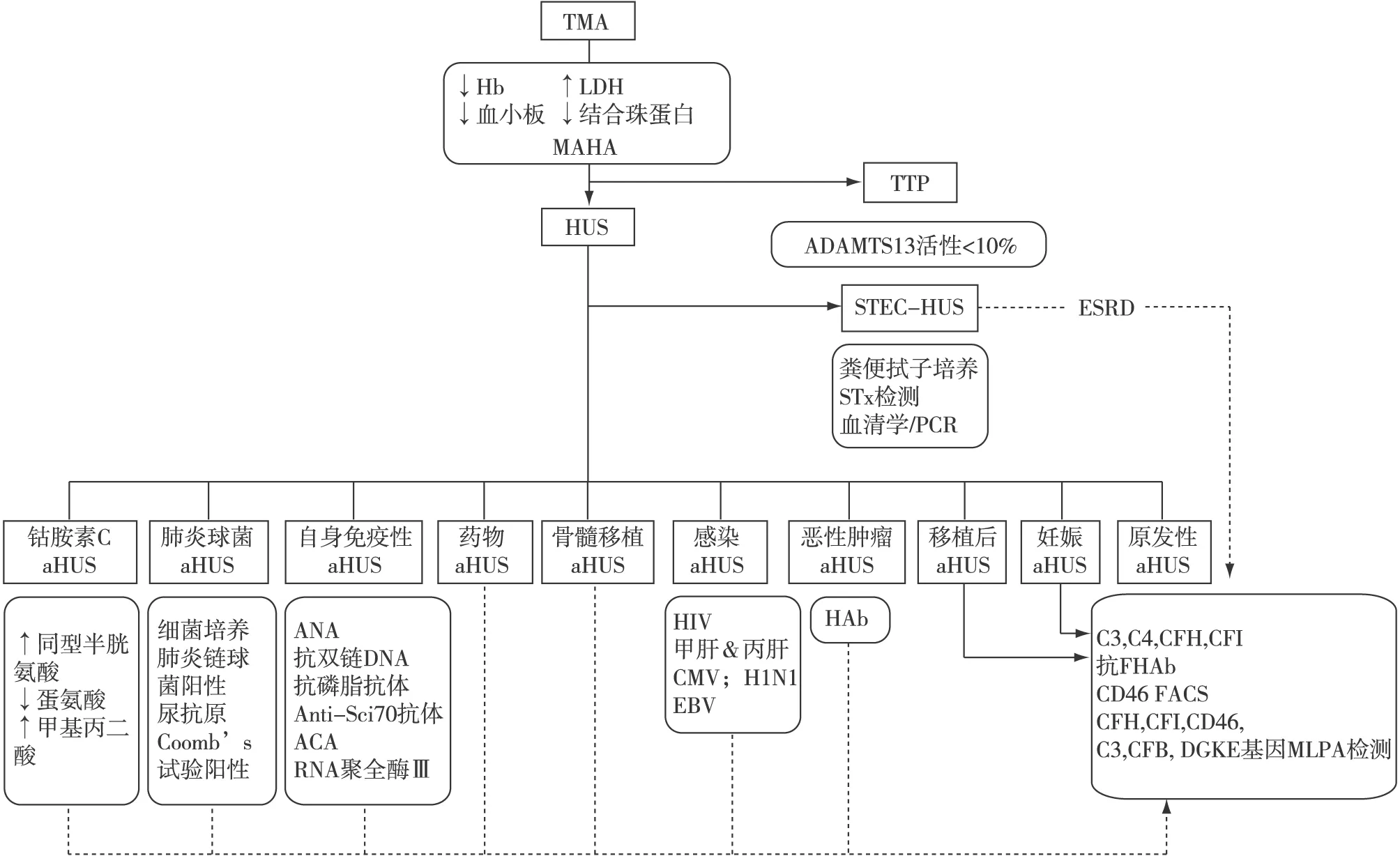
图1 aHUS诊断流程图ACA:抗着丝点抗体;aHUS:非典型溶血尿毒综合征;HUS:溶血尿毒综合征;STEC-HUS:产志贺毒素大肠杆菌相关溶血性尿毒综合征;ANA:抗核抗体;CMV:巨细胞病毒;CFH:补体因子H;CFI:补体因子I;CFB:补体因子B;DGKE:甘油二酯激酶ε; EBV:EB病毒;ESRD:终末期肾病;STx:志贺毒素;FACS:流式细胞术;Hb:血红蛋白;LDH:乳酸脱氢酶;MAHA:微血管病性溶血性贫血;MLPA:多重连接依赖探针扩增技术; PCR:聚合酶链反应;HAb:H因子抗体;TMA:血栓性微血管病;TTP:血栓性血小板减少性紫癜;诊断为TMA后,需行临床和实验室评估以确定病因。成人患者使用依库珠单抗前需检测ADAMTS13活性以排除TTP。所有怀疑aHUS 的患者均应进行STEC-HUS检查。儿童aHUS患者需进行血清、尿液检测钴胺素是否缺乏。怀疑原发性aHUS的患者需进行补体介导检测。妊娠相关性aHUS和移植相关性 aHUS 需全面检测补体水平。其他原因导致的继发性aHUS推荐基因检测
疾病先天遗传/后天获得性因素 aHUS(包括移植后和妊娠相关)和C3G都需要检测血补体蛋白水平,筛查CFH,CD46,CFI,C3,补体因子B(CFB),THBD,CFHR1,CFHR5和DGKE基因。条件允许时需进行拷贝数变异、融合基因等复杂的FH/CFHRs区域基因重组分析。aHUS还需行风险单倍型CFH-H3和MCPggaac基因分型。
所有aHUS患者还应行ADAMTS13活性及志贺毒素大肠杆菌相关检查。aHUS常见的获得性因素为抗H因子自身抗体,C3G则为C3肾炎因子、抗H因子抗体。年长者还需检查血清游离轻链。先天或获得性因素不明确的aHUS和C3G,要积极查找发病诱因(图1)。
aHUS患者基因型和表型的关系可以预测疾病预后、治疗反应和移植后复发风险。而C3G的基因型和表型的关系认识有限,无法用来判断预后以及优化治疗方案,建议全面基因检测,纵向观察获得性自身抗体如C3肾炎因子和抗H因子抗体在疾病演变中的作用。
治疗方案
aHUS 补体抑制剂适用于所有原发性aHUS患者,代表药物为依库珠单抗(表2)。无条件使用依库珠单抗者,可以尝试血浆疗法。抗H因子抗体相关aHUS需抗细胞治疗,并根据抗体效价适时调整。血浆置换也可用于抗H因子阳性者(图2),或危重TMA患者(如昏迷或惊厥),及怀疑血栓性血小板减少性紫癜(TTP)伴残留ADAMTS13活性>10%的患者。血浆置换和依库珠单抗联合疗法可能在一定程度上提高疗效,但有推迟单抗起效的可能。建议尽可能缩短治疗期,不建议终生血浆置换或补体抑制治疗(图3)。有补体抑制剂成功治疗继发性aHUS的个案报道,但缺少临床试验支持。

表2 依库珠单抗疗效评估
aHUS:非典型溶血尿毒综合征;C3:补体成分3;C5;补体成分5;EGTA: 乙二醇四乙酸; ELISA:酶联免疫吸附测定;sC5b-9:可溶性C5b-9;sMAC:可溶性补体攻击复合物;TCC:终末补体复合物
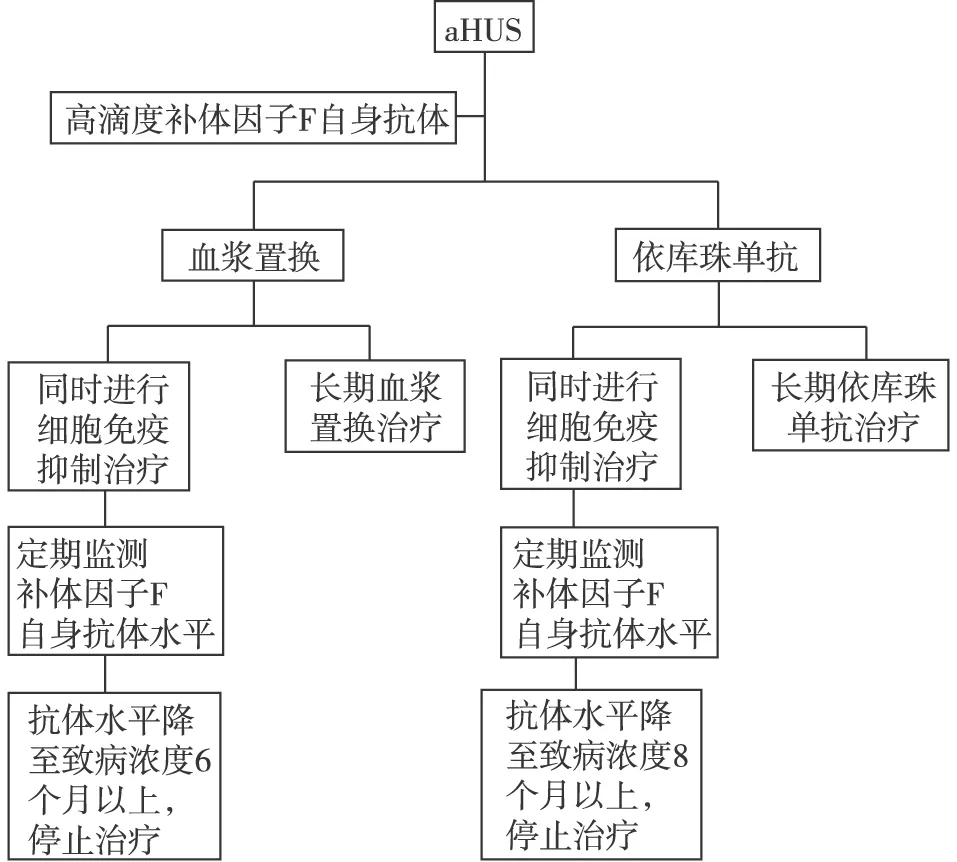
图2 抗H因子自身抗体相关性非典型溶血尿毒综合征(aHUS)的治疗
肾移植需在透析最少6个月后且TMA血液学特征和肾外表现缓解时才能实施,期间要根据复发风险权衡补体抑制剂的使用(表3)。行活体亲属供肾移植时,需要对供体和受体行遗传分析。理想的供体应不携带任何致病突变基因,并排除补体旁路途径基因缺陷。由于补体蛋白主要在肝脏内合成,因此肝移植能够更好地纠正补体蛋白异常,可用于依库珠单抗疗效不佳的aHUS患者。依库珠单抗改变aHUS患者的自然病程,但用药方案和治疗周期还需要进一步研究。
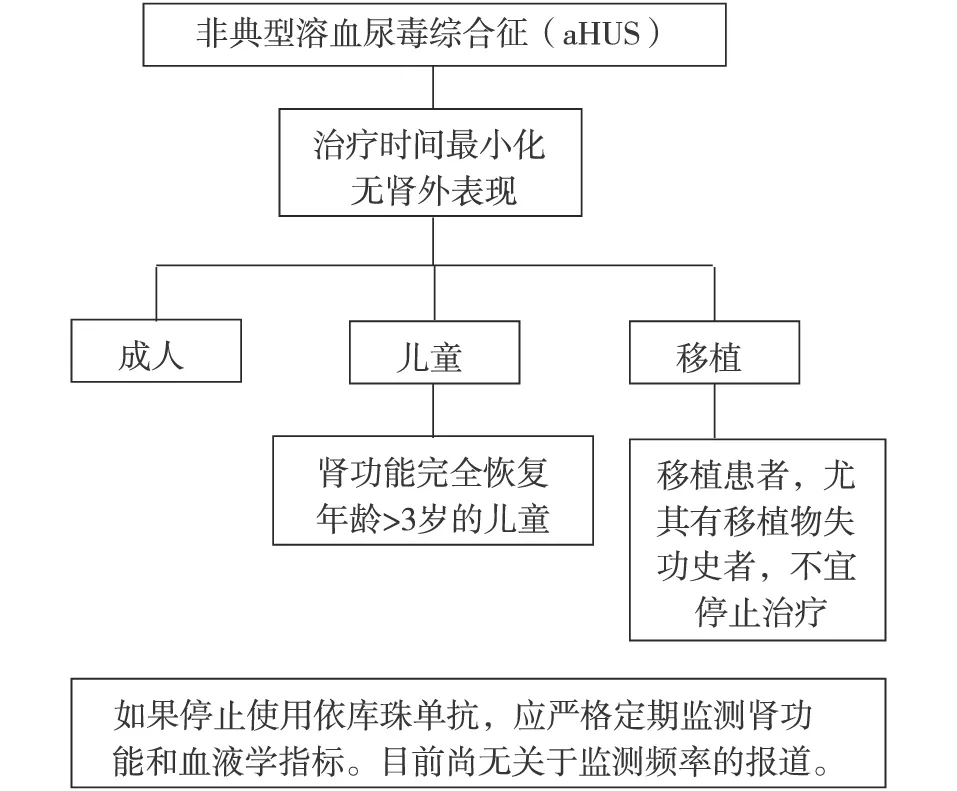
图3 补体抑制剂停用建议单抗治疗至少6~12月,持续>3个月肾功能正常或者肾脏慢性病变进展缓慢者建议停用依库珠单抗。透析患者在停用之前最少维持治疗4~6个月。携带MCP致病突变的患者(尤其是儿童)如果在治疗期间肾功能迅速缓解可考虑在3个月时提前中止治疗。停用期间密切关注肾脏纤维化改变程度。移植受者,尤其是既往有移植物功能丧失史者,不宜停止治疗

表3 基于风险评估预防移植后aHUS复发
aHUS:非典型溶血尿毒综合征;MCP:膜辅助蛋白;a:要求对所有相关基因进行筛查;b:预防性治疗要符合当地医疗条文规定,目前并没有临床试验能支持单一化单抗治疗优于其他方案;c:肾移植受者的肝脏合成异常补体蛋白、依库珠单抗疗效欠佳或者长期使用经济负担太重时可以考虑肝移植;d:由临床医生权衡是否进行预防性血浆置换或者补体抑制治疗
C3G 回顾性研究显示霉酚酸酯治疗C3G有效,但缺少前瞻性研究。血浆置换与利妥昔单抗治疗不作推荐。C3G肾移植后复发率高达50%,因此不推荐肾移植。补体抑制剂的疗效需要大规模前瞻性临床研究来验证(表4)。
关于C3G治疗的研究有限,补体抑制剂的使用和临床试验亟待开展。回顾性研究显示DDD和C3GN的肾存活率有差别,但仅凭电镜表现还不能够预测临床疗效预后,需收集病例开展临床相关研究。目前还缺少临床数据支持sC5b-9水平作为末端补体抑制剂治疗的评价参数和根据C5b-9肾组织沉积情况进行病理学分层。

表4 C3肾病a治疗指南
a:基于单中心、小样本的回顾性研究,病例报道和专家意见
1 Sethi S,D′Agati VD,Nast CC,et al.A proposal for standardized grading of chronic changes in native kidney biopsy specimens.Kidney Int,2017,91(4):787-789.
2 Goodship TH,Cook HT,Fakhouri F,et al.Atypical hemolytic uremic syndrome and C3 glomerulopathy:conclusions from a "Kidney Disease:Improving Global Outcomes" (KDIGO) Controversies Conference.Kidney Int,2017.91(3):539-551.
(本文编辑 律 舟)
10.3969/j.issn.1006-298X.2017.04.014
南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2017-06-25

