胶原酶消化法、组织块贴壁法培养的大鼠RASMCs生长、增殖及分化对比观察
赵志敏,王国坤,王杨,杨帆,龚德军,徐志云
(第二军医大学附属长海医院,上海200433)
胶原酶消化法、组织块贴壁法培养的大鼠RASMCs生长、增殖及分化对比观察
赵志敏,王国坤,王杨,杨帆,龚德军,徐志云
(第二军医大学附属长海医院,上海200433)
目的 比较胶原酶消化法、组织块贴壁法培养的大鼠胸主动脉平滑肌细胞(RASMCs)生长、增殖及分化的影响。方法 选择6~8周龄雄性SD大鼠6只,取胸主动脉及主动脉弓部,保留中膜备用。分别采用胶原酶消化法、组织块贴壁法培养RASMCs。采用α-肌动蛋白免疫荧光染色法鉴定RASMCs,并比较两种方法培养第0、24、36、48、60、72、84、96 h RASMCs生长情况。采用CCK-8法检测细胞增殖情况,流式细胞术检测细胞周期。采用实时定量PCR法检测细胞表型标志基因表达,包括收缩型标志基因α-平滑肌肌动蛋白(α-SMA)、转胶蛋白(TAGLN)、肌球蛋白重链11(MYH-11)、转录因子1(SP-1)及合成型标志基因骨桥蛋白(OPN)。结果 胶原酶消化法、组织块贴壁法均成功分离出RASMCs,细胞纯度均在95%以上。培养36、48、60、72 h时,组织块贴壁法分离、培养的RASMCs计数多于胶原酶消化法(P均<0.05)。培养36、48、60、72 h时,胶原酶消化法分离、培养的RASMCs活力优于组织块贴壁法(P均<0.05)。两种方法分离、培养的RASMCs G1、G2、S期细胞所占比例比较差异均无统计学意义(P均>0.05)。胶原酶消化法分离、培养的RASMCs中α-SMA、TAGLN、MYH-11 mRNA相对表达量均高于组织块贴壁法,OPN mRNA相对表达量低于组织块贴壁法(P均<0.05)。结论 胶原酶消化法、组织块贴壁法均成功分离、培养出RASMCs。胶原酶消化法分离、培养的RASMCs生长、增殖较慢,但保持收缩表型;组织块贴壁法分离、培养的RASMCs生长、增殖较快,但有向合成表型转化的趋势。
血管平滑肌细胞;胸主动脉;胶原酶消化法;组织块贴壁法;细胞生长;细胞增殖;细胞分化;大鼠
主动脉夹层(AD)是一类病死率较高的疾病[1,2]。研究显示,约80%未经医学干预的Stanford A型AD患者在发病2周内会因主动脉夹层破裂死亡[3]。目前关于AD的发病机制尚不明确。血管平滑肌细胞(VSMCs)是构成血管壁中膜的主要结构及物质基础,可保持血管壁完整性、维持血管壁张力[4],同时在血管内膜增生、血管重塑、血管外膜基质的分泌和降解等病理生理过程中具有重要作用[5]。VSMCs的增殖、凋亡及表型改变与AD的发生密切相关,其生物学特征的改变可能是AD发生、发展的病理生理机制之一[6]。VSMCs主要有收缩表型和合成表型两种。病理状态下,VSMCs会由正常成年人的收缩表型向合成表型转化,并参与动脉粥样硬化、主动脉瘤等多种心血管疾病的发展[7,8]。α-平滑肌肌动蛋白(α-SMA)、转胶蛋白(TAGLN)、肌球蛋白重链11(MYH-11)、转录因子1(SP-1)是常用的收缩表型标志基因,骨桥蛋白(OPN)是常用的合成表型标志基因。组织块贴壁法和胶原酶消化法是VSMCs经典的培养方法[9,10],但目前关于不同方法培养的VSMCs生物学表型是否有差异鲜见报告。2015年1月~2016年3月,我们对比观察胶原酶消化法、组织块贴壁法培养的大鼠胸主动脉平滑肌细胞(RASMCs)生长、增殖及分化情况。现将结果报告如下。
1 材料与方法
1.1 实验动物、试剂及仪器 6~8周龄、雄性SD大鼠6只,体质量150~200 g,由上海西普尔-必凯实验动物技术有限公司提供。DMEM培养基、FBS、青霉素、链霉素、胰蛋白酶均购自美国Gibco公司,Ⅰ 型胶原酶、牛血清白蛋白(BSA)、DAPI均购自美国Sigma公司。兔抗鼠α-肌动蛋白(α-actin)抗体购自武汉博士德生物工程有限公司;FITC标记的羊抗兔二抗、TRITC标记的羊抗兔二抗购自美国Santa Cruz公司。倒置显微镜(IX-70)、荧光正置显微镜(BX-60)购自日本Olympus公司;细胞培养箱(BB5060UV)购自美国Heraeus公司;超净工作台(ZHJH-C1214B)购自上海智城分析仪器制造有限公司;离心机(ST 16R)购自美国Thermo Scientfic公司;荧光定量PCR仪(LC480Ⅱ)购自瑞士Roche公司。
1.2 RASMCs分离 所有大鼠10%水合氯醛0.4 mL/100 g腹腔注射麻醉,颈椎脱臼处死,75%乙醇浸泡1 min,无菌条件下迅速分离胸主动脉及主动脉弓,并置于0.01 mol/L D-Hanks培养皿中。转移至超净工作台,D-Hanks漂洗数次,显微器械仔细剥离胸主动脉及主动脉弓,将胸主动脉外膜纤维结缔组织剥离干净,眼科剪纵向剪开主动脉,内膜面朝上,用刀片来回轻刮2~3次,去除内膜,保留中膜备用。
1.3 RASMCs培养 分别采用胶原酶消化法、组织块贴壁法培养RASMCs。胶原酶消化法:将处理好的主动脉壁中膜用眼科剪剪成1 mm×1 mm大小的组织块,放入培养皿中,加入0.2 mg/mL Ⅰ型胶原酶2 mL,37 ℃、5 % CO2孵育箱中培养约12 h,待组织块消化成絮状物时用移液器充分吹打均匀,100目无菌滤网过滤。留取滤液,加入15 mL离心管中,200×g离心7 min,弃上清。加入5 mL含20%FBS的DMEM培养液重悬细胞,移入培养皿,37 ℃、5 % CO2孵育箱中培养。每2天更换1次培养液。RASMCs呈圆形并悬浮于培养液中,培养48 h细胞贴壁呈梭形生长(见插页Ⅰ图1A)。组织块贴壁法:将处理好的主动脉壁中膜用眼科剪剪成1 mm×1 mm大小的的组织块,边缘整齐光滑,用弯头镊夹取组织块,蘸取少量FBS后均匀贴放于培养瓶底面,翻转培养瓶,37 ℃、5% CO2的细胞培养箱中孵育1 h,待组织块贴壁后轻轻翻转,加入少量含20%FBS的DMEM培养液,37 ℃、5% CO2的细胞培养箱中孵育,待细胞从组织块边缘爬出。每2天更换1次培养液。RASMCs在贴壁3~4天从组织块边缘爬出,6~8天细胞呈长梭形并在组织块边缘呈放射状生长(见插页Ⅰ图1B)。
1.4 RASMCs鉴定及其生长、增殖、分化观察
1.4.1 RASMCs鉴定 采用α-actin免疫荧光染色法[10]。分别取胶原酶消化法、组织块贴壁法培养的传2代RASMCs,接种于内置有细胞爬片的24孔板中,2×104个/孔;培养24 h待细胞自然贴壁,PBS冲洗3 min×3次;加入4%多聚甲醛,室温固定30 min,PBS冲洗3 min×3次;加入Triton-X-100,4 ℃孵育15 min,PBS冲洗3 min×3次;加入5%山羊血清,室温封闭1 h;加入兔抗鼠α-actin抗体(稀释倍数1∶400)200 μL/孔,4 ℃杂交过夜,PBS冲洗3 min×3次;加入FITC标记的羊抗兔二抗(稀释倍数1∶400),室温杂交1 h,PBS冲洗3 min×3次;加入DAPI,避光复染细胞核10 s,PBS冲洗3 min×3次;50%甘油封片,荧光显微镜下观察两种方法培养的细胞表面是否表达α-actin抗体,并计算细胞纯度。
1.4.2 RASMCs生长观察 ①分别取胶原酶消化法、组织块贴壁法培养的传2代RASMCs,接种于24孔板中,2×104个/孔。分别于培养第0、24、36、48、60、72、84、96 h收集细胞,消化计数。每个时间点设4个复孔,取其平均值。以培养时间为横坐标、细胞数为纵坐标绘制细胞生长曲线,观察细胞生长情况。②采用CCK-8法[11]。分别取胶原酶消化法、组织块贴壁法培养的传2代RASMCs接种于96孔板中,5×103个/孔。每孔加入100 μL培养液培养12 h,加入CCK-8溶液10 μL,培养箱内孵育1~4 h。分别于培养第0、24、36、48、60、72、84、96 h,酶标仪450 nm波长处检测各孔的光密度(OD)值。以OD450值代表细胞生长情况。
1.4.3 RASMCs细胞周期[12]观察 分别取胶原酶消化法、组织块贴壁法培养的70%~80%融合后传3代RASMCs,消化、洗涤,离心,弃上清,用预冷的70%乙醇固定24 h,PBS冲洗3 min×3次,加入200 μL PI染色液,避光反应30 min,BDFACS Calibur流式细胞仪观察、Modfit软件分析细胞周期分布情况。
1.4.4 RASMCs表型标志基因α-SMA、TAGLN、MYH-11、SP-1、OPN检测 采用实时定量PCR法。分别取胶原酶消化法、组织块贴壁法培养的传2代RASMCs,加入1 mL TRIzol试剂,反复吹打,按试剂盒说明书提取细胞总RNA,紫外分光光度计检测总RNA质量。以500 ng总RNA为模板,将α-SMA、TAGLN、MYH-11、SP-1、OPN的上下游引物[13,14],按逆转录试剂盒说明书进行逆转录。适当稀释逆转录产物,按SYBR Green实时定量PCR试剂盒说明书进行进行PCR扩增。以2-ΔΔCt法计算目的基因mRNA相对表达量。
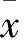
2 结果
胶原酶消化法、组织块贴壁法分离、培养的RASMCs胞质均有明显红色荧光标记,说明两种方法均成功分离、培养出RASMCs,细胞纯度均在95%以上。见插页Ⅰ图2。
2.1 两种方法分离、培养的RASMCs生长情况 两种方法分离、培养的RASMCs计数及其活力比较见表1、2。胶原酶消化法分离、培养的RASMCs培养第36、48、60、72 h细胞活力明显高于组织块贴壁法同时间(P均<0.05)。
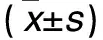
表1 两种方法分离、培养的RASMCs计数比较
注:与组织块贴壁法培养同时间比较,*P<0.01。

表2 两种方法分离、培养的RASMCs细胞活力比较±s)
注:与组织块贴壁法培养同时间比较,*P<0.05。
2.2 两种方法分离、培养的RASMCs细胞周期比较 胶原酶消化法分离、培养的RASMCs G1、G2、S期细胞分别占(80.44±1.32)%、(6.56±0.68)%、(11.24±3.71)%,组织块贴壁法分离、培养的RASMCs G1、G2、S期细胞分别占(80.69±1.47)%、(5.33±1.18)%、(13.77±0.29)%。两种方法分离、培养的RASMCs细胞周期中各期细胞所占比例比较差异均无统计学意义(P均>0.05)。
2.3 两种方法分离、培养的RASMCs中α-SMA、TAGLN、MYH-11、SP-1、OPN mRNA表达比较 两种方法分离、培养的RASMCs中α-SMA、TAGLN、MYH-11、SP-1、OPN mRNA相对表达量比较见表3。胶原酶消化法分离、培养的RASMCs中α-SMA、TAGLN、MYH-11 mRNA相对表达量均高于组织块贴壁法, OPN mRNA相对表达量低于组织块贴壁法(P均<0.05)。
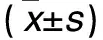
表3 两种方法分离、培养的RASMCs α-SMA、TAGLN、MYH-11、SP-1、OPN mRNA相对表达量比较
注:与组织块贴壁法比较,*P<0.05。
3 讨论
近年来,随着对VSMCs的生物学特征,尤其是细胞增殖、分化、调亡和对细胞外基质影响等方面研究的不断深入,其表型转化在各种疾病中作用的研究正越来越受到人们关注。由于在表型转化过程中,VSMCs的各种特性会发生明显变化,并且对血管壁微环境也有显著影响,而这些表型及生物学功能的改变与高血压、动脉粥样硬化、肺动脉高压等多种心血管疾病的发生密切相关[7]。
VSMCs来自胚胎发育时期的中胚层,由胚胎时期的合成表型逐渐分化为具有成年特征的收缩表型,进而构成成年个体血管壁的重要组分,其组织学功能主要是保持血管壁的弹性和维持血管壁的张力。收缩表型的VSMCs多呈梭形或带状,其增殖、迁移能力差或无[14]。而在某些病理生理因素,如炎症、应激及环境改变等刺激下,VSMCs会向分泌表型转化,由于分泌表型的VSMCs主要存在于胚胎时期,与细胞增殖、迁移等多种功能密不可分[15]。因此,在某些病理条件刺激下,合成表型的VSMCs增多会导致血管壁增厚、重构、弹性降低等一系列病理改变,从而诱发各类心血管疾病的发生[16]。
经典的VSMCs原代培养方法主要有组织块贴壁法和胶原酶消化法,针对两种不同的细胞分离方法进行鉴定,证实两种方法均能便捷、高效地分离VSMCs[9,10]。本研究结果发现,两种方法分离、培养的原代平滑肌细胞在倒置相差显微镜下观察均呈梭形并形成特征性的“峰—谷”状生长,α-actin免疫荧光染色鉴定获得纯度>95%的RASMCs。本研究结果还显示,经胶原酶消化法分离、培养的传2代RASMCs培养36~72 h细胞增殖较快;而组织块贴壁法分离、培养的传2代RASMCs培养24~60 h细胞增殖较快,培养72 h后进入停滞期。由此可见,在传2代RASMCs中,胶原酶消化法分离、培养的RASMCs增殖速度较组织块贴壁法明显减慢。而对传3代的RASMCs进行细胞周期检测发现,两种方法分离、培养的RASMCs细胞周期中各期细胞所占比例比较差异均无统计学意义。证实两种方法分离、培养的RASMCs在传3代后细胞增殖能力均较高。
以上结果可能是由多种原因造成的,我们推测可能与VSMCs的表型变化有关[17,18]。文献报道,在某些刺激因素的作用下,收缩表型的VSMCs会向合成表型转化,以适应细胞损伤及内环境改变等[19]。本研究观察了两种方法分离、培养的RASMCs收缩表型和合成表型标志基因变化,结果发现,胶原酶消化法分离、培养的RASMCs中收缩表型标志基因α-SMA、TAGLN、MYH-11 mRNA相对表达量均高于组织块贴壁法,合成表型标志基因OPN mRNA相对表达量低于组织块贴壁法。其中,α-SMA是国内外研究已证实的VSMCs重要标志,并可作为其收缩表型的重要标志物[20~22]。说明胶原酶消化法分离、培养的RASMCs在培养过程中保持着收缩表型,成活率高,增殖较慢,而组织块贴壁法分离、培养的RASMCs具有向合成表型转化的趋势。
综上所述,胶原酶消化法、组织块贴壁法均可在体外分离、培养RASMCs。胶原酶消化法分离、培养的RASMCs在培养过程中保持着收缩表型,成活率高,增殖较慢;组织块贴壁法分离、培养的RASMCs生长、增殖较快,具有向合成表型转化的趋势。因此,在针对以VSMCs为靶细胞的疾病研究时采用胶原酶消化法分离、培养获得的细胞更佳。
[1] Lacolley P, Regnault V, Nicoletti A, et al. The vascular smooth muscle cell in arterial pathology: a cell that can take on multiple roles[J]. Cardiovasc Res, 2012,95(2):194-204.
[2] Meszaros I, Morocz J, Szlavi J, et al. Epidemiology and clinicopathology of aortic dissection[J]. Chest, 2000,117(5):1271-1278.
[3] Criado FJ. Aortic dissection: a 250-year perspective[J]. Tex Heart Inst J, 2011,38(6):694-700.
[4] Wagenseil JE, Mecham RP. Vascular extracellular matrix and arterial mechanics[J]. Physiol Rev, 2009,89(3):957-989.
[5] Owens GK, Kumar MS, Wamhoff BR. Molecular regulation of vascular smooth muscle cell differentiation in development and disease[J]. Physiol Rev, 2004,84(3):767-801.
[6] Wang L, Zhang J, Fu W, et al. Association of smooth muscle cell phenotypes with extracellular matrix disorders in thoracic aortic dissection[J]. J Vasc Surg, 2012,56(6):1698-1709.
[7] Alexander MR, Owens GK. Epigenetic control of smooth muscle cell differentiation and phenotypic switching in vascular development and disease[J]. Annu Rev Physiol, 2012,74(74):13-40.
[8] Bentzon JF, Sondergaard CS, Kassem M, et al. Smooth muscle cells healing atherosclerotic plaque disruptions are of local, not blood, origin in apolipoprotein E knockout mice[J]. Circulation, 2007,116(18):2053-2061.
[9] Proudfoot D, Shanahan C. Human vascular smooth muscle cell culture[J]. Methods Mol Biol, 2012(806):251-263.
[10] 钱国清,王良兴,陈婵,等.大鼠细小动脉平滑肌细胞原代培养和鉴定方法的研究[J].中国应用生理学杂志,2010,26(1):125-128.
[11] 王敏,崔连群,王晓军,等.动脉血管平滑肌细胞、血管内皮细胞原代培养方法的改良及应用[J].山东医药,2004,44(14):17-18.
[12] Braun-Dullaeus RC, Mann MJ, Seay U, et al. Cell cycle protein expression in vascular smooth muscle cells in vitro and in vivo is regulated through phosphatidylinositol 3-kinase and mammalian target of rapamycin[J]. Arterioscler Thromb Vasc Biol, 2001,21(7):1152-1158.
[13] Li P, Zhu N, Yi B, et al. MicroRNA-663 regulates human vascular smooth muscle cell phenotypic switch and vascular neointimal formation[J]. Circ Res, 2013,113(10):1117-1129.
[14] Mao N, Gu T, Shi E, et al. Phenotypic switching of vascular smooth muscle cells in animal model of rat thoracic aortic aneurysm[J]. Interact Cardiovasc Thorac Surg, 2015,21(1):62-70.
[15] Tukaj C, Bohdanowicz J, Kubasik-Juraniec J. A scanning electron microscopic study of phenotypic plasticity and surface structural changes of aortal smooth muscle cells in primary culture[J]. Folia Morphol (Warsz), 2002,61(4):191-198.
[16] Wang YH, Yan ZQ, Shen BR, et al. Vascular smooth muscle cells promote endothelial cell adhesion via microtubule dynamics and activation of paxillin and the extracellular signal-regulated kinase (ERK) pathway in a co-culture system[J]. Eur J Cell Biol, 2009,88(11):701-709.
[17] Jing L, Peng X, Xie MJ, et al. Different responses of cell cycle between rat vascular smooth muscle cells and vascular endothelial cells to paclitaxel[J]. J Huazhong Univ Sci Technolog Med Sci, 2014,34(3):370-375.
[18] Chang S, Song S, Lee J, et al. Phenotypic modulation of primary vascular smooth muscle cells by short-term culture on micropatterned substrate[J]. PLoS One, 2014,9(2):e88089.
[19] Shi XZ, Sarna SK. Cell culture retains contractile phenotype but epigenetically modulates cell-signaling proteins of excitation-contraction coupling in colon smooth muscle cells[J]. Am J Phy Gas Liver Physiol, 2013,304(4):337-345.
[20] Owens GK. Role of mechanical strain in regulation of differentiation of vascular smooth muscle cells[J]. Circ Res, 1996,79(5):1054-1055.
[21] Kennedy E, Mooney CJ, Hakimjavadi R, et al. Adult vascular smooth muscle cells in culture express neural stem cell markers typical of resident multipotent vascular stem cells[J]. Cell Tissue Res, 2014,358(1):203-216.
[22] Suzuki T, Mehta RH, Ince H. Clinical profiles and outcomes of acute type b aortic dissection in the current era:lessons from the international registry of aortic dissection (irad)[J]. Circulation, 2003,108(Suppl 1):312-317.
上海市卫生系统重要疾病联合攻关项目计划(2014ZY-JB0401)。
徐志云(E-mail: zhiyunx@hotmail.com)
10.3969/j.issn.1002- 266X.2017.28.009
R34
A
1002- 266X(2017)28- 0033- 04
2016- 09-19)

