CD147对前列腺癌细胞雄激素受体磷酸化的影响及其作用机制
方芳,赵臣,郝峰,王立国
(吉林医药学院检验学院,吉林吉林132013)
CD147对前列腺癌细胞雄激素受体磷酸化的影响及其作用机制
方芳,赵臣,郝峰,王立国
(吉林医药学院检验学院,吉林吉林132013)
目的 探讨白细胞分化抗原(CD147)对前列腺癌细胞雄激素受体(AR)磷酸化的影响及其作用机制。方法 选择前列腺癌LNCaP细胞,随机分为LNCaP/Scramble组、LNCaP/shCD147组,分别感染阴性对照病毒、CD147 RNA干扰病毒,采用Western blotting法检测沉默CD147表达效率。收集两组细胞,加或不加磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)信号通路抑制剂LY294002处理,采用Western blotting法检测磷酸化AKT(p-AKT)、磷酸化AR(p-AR)和前列腺特异性抗原(PSA)表达。结果 LNCaP/Scramble组CD147相对表达量为1.19±0.09,LNCaP/shCD147组为0.71±0.03,两组比较P<0.01。与LNCaP/Scramble组比较,LNCaP/shCD147组p-AKT、p-AR和PSA相对表达量均明显降低(P均<0.05);加入PI3K/AKT信号通路抑制剂LY294002处理后,LNCaP/shCD147组p-AKT、p-AR和PSA相对表达量进一步下降(P均<0.05)。结论 沉默CD147可降低AR磷酸化水平,其机制可能与影响PI3K/AKT信号通路有关。
前列腺癌;白细胞分化抗原;磷酸化雄激素受体;磷酸化蛋白激酶B;前列腺特异性抗原
近年来,我国前列腺癌的发病率逐年升高[1]。前列腺癌的早期症状不明显,甚至没有任何症状,多数患者就诊时病情已至中晚期,失去根治性手术机会。针对雄激素-雄激素受体(AR)的雄激素剥夺疗法(ADT)是目前治疗中晚期前列腺癌的主要方法,但术后2~3年雄激素依赖性前列腺癌(ADPC)可转化为去势抵抗性前列腺癌(CRPC)。此时,ADT不再有效,可出现肿瘤复发和转移,患者平均生存时间多不足2年[2]。研究发现,有转录活性的AR在CRPC细胞内广泛表达,且在CRPC的发展过程中具有关键作用[3]。因此,发现促进AR转录活性的调节分子对前列腺癌的治疗具有重要意义。CD147是一种跨膜糖蛋白,属于IgSF成员,在多种恶性肿瘤细胞中表达升高,具有促进肿瘤生长、侵袭和转移等作用[4]。有研究发现,CD147与前列腺癌的治疗反应和预后密切相关[5],但其对AR活性的影响目前尚不清楚。2015年12月~2016年5月,本研究探讨沉默前列腺癌细胞CD147表达对AR磷酸化的影响及其可能的作用机制。
1 材料与方法
1.1 材料 前列腺癌LNCaP细胞,由中国科学院上海生命科学研究院细胞资源中心提供。CD147 RNA干扰慢病毒、阴性对照病毒,上海吉凯基因化学技术有限公司。倒置显微镜,上海医用分析仪器厂;电泳槽和转膜仪,美国Bio-Rad公司;RPMI 1640培养液,美国Gibco公司;FBS,美国HyClone公司;RIPA裂解液、PMSF和BCA蛋白定量试剂盒,南京碧云天生物技术有限公司;兔抗CD147、磷酸化蛋白激酶B(p-AKT)、磷酸化AR(p-AR)、前列腺特异性抗原(PSA)、β-actin抗体和磷脂酰肌醇3-激酶(PI3K)/AKT信号通路抑制LY294002,美国Cell Signaling Technology公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG,北京中杉金桥生物技术有限公司。
1.2 细胞培养及CD147基因沉默 取LNCaP细胞接种于含10% FBS的RPMI 1640培养液中,置于37 ℃、5% CO2、饱和湿度培养箱中培养,隔天换液,当细胞生长至80%以上融合时传代。取传3代细胞,胰酶消化后计数,吹打成单细胞悬液,接种于6孔板,每孔2 mL(含1×106个细胞),混匀后置于37 ℃、5% CO2细胞培养箱中培养。随机将细胞分为LNCaP/Scramble组、LNCaP/shCD147组,当细胞生长至约50%融合时,分别加入1∶20倍稀释的阴性对照病毒、CD147 RNA干扰病毒,同时加入适量凝聚胺,使其终浓度为5 μg/mL,培养24 h更换为正常培养液,继续培养48 h。
1.3 沉默CD147表达效率检测 采用Western blotting法。收集两组细胞,加入RIPA裂解液,反复吹打,充分裂解,12 000×g离心15 min,取上清,BCA法进行蛋白定量。将蛋白裂解液加入上样缓冲液,加热变性;取蛋白样品30 μg行SDS-PAGE,并转印至醋酸纤维素膜上,4 ℃、50 g/L脱脂奶粉封闭2 h;然后加入兔抗CD147(1∶3 000)和β-actin抗体(1∶3 000),4 ℃孵育过夜;次日TBST洗膜,加入HRP标记的山羊抗兔抗体(1∶3 000)室温避光孵育2 h;TBST洗膜,ECL发光显影。采用Quantity One软件分析各蛋白电泳条带的灰度值。
1.4 p-AR、p-AKT和PSA表达检测 采用Western blotting法。收集两组细胞,分别置于含或不含20 μmol/L LY294002的培养基中培养24 h,加入RIPA裂解液,反复吹打,充分裂解,12 000×g离心15 min,取上清,BCA法进行蛋白定量。将蛋白裂解液加入上样缓冲液,加热变性;取蛋白样品30 μg行SDS-PAGE,并转印至醋酸纤维素膜上,4 ℃、50 g/L脱脂奶粉封闭2 h;分别加入兔抗p-AR(1∶1 000)、p-AKT(1∶1 000)、PSA抗体(1∶1 000)和β-actin 抗体(1∶3 000),4 ℃孵育过夜;次日TBST洗膜,加入HRP标记的山羊抗兔抗体(1∶3 000)室温避光孵育2 h;TBST洗膜,ECL发光显影。采用Quantity One软件分析各蛋白电泳条带的灰度值。
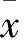
2 结果
2.1 两组CD147表达比较 LNCaP/Scramble组CD147相对表达量为1.19±0.09,LNCaP/shCD147组为0.71±0.03,两组比较P<0.01。
2.2 两组p-AR、p-AKT表达比较 见表1。
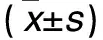
表1 两组有或无LY294002时p-AR、p-AKT相对表达量比较
注:与LNCaP/Scramble组比较,*P<0.05;与同组无LY294002比较,#P<0.05。
2.3 两组PSA表达比较 见表2。
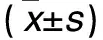
表2 两组有或无LY294002时PSA相对表达量比较
注:与LNCaP/Scramble组比较,*P<0.05;与同组无LY294002比较,#P<0.05。
3 讨论
前列腺癌具有雄激素依赖性,雄激素与AR结合后,能将活化信号传导至细胞核内,继而促进肿瘤细胞生长。ADT是目前前列腺癌的主要治疗手段,但几乎所有患者最终会对该疗法产生抗性而失效。
有研究认为,大部分CRPC细胞可通过AR基因扩增、AR基因活性增强和AR敏感性升高等方式,导致AR能够在去势治疗后被体内低浓度的雄激素激活,从而维持前列腺癌细胞的生长和增殖[6,7]。AR存在多种翻译后修饰方式,如磷酸化、乙酰化和泛素化等,这些修饰方式对AR的转录活性具有不同的调控作用[8]。磷酸化是目前研究较多的一种AR修饰和调控方式。当AR丝氨酸第80、93、641位点发生磷酸化时,其处于稳定状态并能抵抗蛋白酶解作用;而当磷酸化发生在丝氨酸第213、506、650位点时,AR的转录被活化,可促进肿瘤细胞生长[9,10]。因此,研究影响AR磷酸化的因素及其磷酸化位点非常重要。
PI3K作为联系细胞外信号与细胞应答效应的桥梁分子,在一些上游分子的作用下活化,进而募集和激活下游靶分子,启动一系列信号级联反应。丝氨酸、苏氨酸激酶是PI3K下游的靶分子之一。PI3K/AKT信号通路的过度激活在肿瘤细胞中普遍存在,活化的肿瘤细胞往往表现出抗凋亡和增殖活跃[11]。最近有研究表明,PI3K/AKT信号通路与AR信号通路的相互作用是CRPC发生、发展的重要分子机制。AKT能够导致AR在第213位点的丝氨酸磷酸化。当AR磷酸化发生在丝氨酸第213位点时,AR的转录被活化,继而促进肿瘤细胞增殖[12,13]。CD147在前列腺癌细胞中高表达,并与前列腺癌的侵袭和转移有关[5]。本课题组前期研究发现,CD147能够活化PI3K/AKT信号通路,抑制饥饿诱导的前列腺癌细胞自噬性死亡[14]。本研究通过RNAi技术沉默前列腺癌LNCaP细胞中CD147表达,并观察了细胞中p-AKT、p-AR表达变化;结果显示,LNCaP/shCD147组p-AKT、p-AR相对表达量明显低于LNCaP/Scramble组。提示CD147可能通过PI3K/AKT信号通路导致AR磷酸化。利用PI3K/AKT信号通路抑制剂LY294002作用于两组细胞,结果发现,加入PI3K/AKT信号通路抑制剂LY294002后,LNCaP/shCD147组p-AKT、p-AR相对表达量进一步降低。进一步证实,CD147可能通过PI3K/AKT信号通路导致AR磷酸化。
前列腺癌是一种雄激素依赖性肿瘤,雄激素弥散到前列腺上皮细胞中,迅速转变为高代谢活性的双氢睾酮,与AR结合后,导致AR构象发生变化,继而转移到前列腺癌细胞核内,结合在含有雄激素元件的DNA序列上,从而启动相应基因的转录。PSA是前列腺癌的特异性标志物,在临床上PSA是诊断前列腺癌的分子生物学标志物之一[15]。PSA基因启动子区含有雄激素应答元件[16]。AR可促进PSA基因的转录,增加PSA表达。本研究结果显示,LNCaP/shCD147组PSA相对表达量明显低于LNCaP/Scramble组,加入PI3K/AKT信号通路抑制剂LY294002后,PSA相对表达量进一步降低。提示沉默CD147表达可抑制PI3K/AKT信号通路,使PSA表达下降。
综上所述,CD147可能通过PI3K/AKT信号通路导致AR磷酸化,加速前列腺癌进程。
[1] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[2] Smith MR, Cook R, Lee KA, et al. Disease and host characteristics as predictors of time to first bone metastasis and death in men with progressive castration-resistant nonmetastatic prostate cancer[J]. Cancer, 2011,117(10):2077-2085.
[3] Ferraldeschi R, Welti J, Luo J, et al. Targeting the androgen receptor pathway in castration-resistant prostate cancer progresses and prospects[J]. Oncogene, 2015,34(14):1745-1757.
[4] Huang P, Chang S, Jiang X, et al. RNA interference targeting CD147 inhibits the proliferation, invasiveness, and metastatic activity of thyroid carcinoma cells by down-regulating glycolysis[J]. Int J Clin Pathol, 2015,8(1):309-318.
[5] Zhong WD, Liang YX, Lin SX, et al. Expression of CD147 is associated with prostate cancer progression[J]. Int J Cancer, 2012,130(2):300-308.
[6] Wyatt AW, Gleave ME. Targeting the adaptive molecular landscape of castration-resistant prostate caner[J]. EMBO Mol Med, 2015,7(7):878-894.
[7] Shiota M, Yokomizo A, Naito S. Increased androgen receptor transcription: a cause of castration-resistant prostate cancer and a possible therapeutic target[J]. J Molecular Endocrinol, 2011,47(1):R25-R41.
[8] 陈艺轩,伍会健.雄激素受体翻译后修饰的研究进展[J].生理科学进展,2013,44(6):442-446.
[9] Daniels G, Pei Z, Loqan SK, et al. Mini-review: androgen receptor phosphorylation in prostate cancer[J]. Am J Clin Exp Urol, 2013,1(1):25-29.
[10] Koryakina Y, Ta HQ, Gioeli D. Androgen receptor phosphorylation: biological context and functional consequences[J]. Endocr Relat Cancer, 2014,21(4):T131-T145.
[11] Morrow JK, Du-Cuny L, Chen L, et al. Recent development of anticancer therapeutics targeting Akt[J]. Recent Pat Anticancer Drug Discov, 2011,6(1):146-159.
[12] Ha S, Iqbal NJ, Mita P, et al. Prosphorylation of the androgen receptor by PIM1 in hormone refractory prostate cancer[J]. Oncogene, 2013,32(34):3992-4000.
[13] Koryakina Y, Ta HQ, Gioeli D. Androgen receptor phosphorylation: biological context and functional consequences[J]. Endocr Relat Cancer, 2014,21(4):T131-T145.
[14] Fang F, Wang L, Zhang S, et al. CD147 modulates autophagy through the PI3K/Akt/mTOR pathway in human prostate cancer PC-3 cells[J]. Oncol Lett, 2015,9(3):1439-1443.
[15] Scher HI, Fizazi K, Saad F, et al. Increased survival with enzalutamide in prostate cancer after chemotheraphy[J]. N Engl J Med, 2012,367(13):1187-1197.
[16] Liu Y, Liu Y, Yuan B, et al. FOXM1 promotes the progression of prostate cancer by regulating PSA gene transcription[J]. Oncotarget, 2017,8(10):17027-17037.
Effects of CD147 on phosphorylation of AR in prostate cancer cells
FANGFang,ZHAOChen,HAOFeng,WANGLiguo
(CollegeofLaboratory,JilinMedicalUniversity,Jilin132013,China)
Objective To investigate the effects of leukocyte differentiation antigen (CD147) on phosphorylation of androgen receptor (AR) in prostate cancer cells and its mechanism. Methods The prostate cancer LNCaP cells were selected and then were randomly divided into the LNCaP/Scramble group and LNCaP/shCD147 group. LNCaP cells in the above two groups were transfected with the negative control virus and CD147 interference virus, respectively. The CD147 expression was detected by Western blotting. The expression of phosphorylated protein kinase B (p-AKT), phosphorylated androgen receptors (p-AR) and prostate specific antigen (PSA) in cells of the two group treated with or without LY294002 was detected by Western blotting. Results The expression of CD147 in the LNCaP/Scramble group was 1.19±0.09, versus 0.71±0.03 in the LNCaP/shCD147 group (P<0.01). We found that the expression of p-AKT, p-AR, and PSA was decreased in the LNCaP/shCD147 group as compared with that of the LNCaP/Scramble group (allP<0.05). When cells were treated with LY294002 for 24 h, the expression of p-AKT, p-AR, and PSA protein was significantly decreased in the LNCaP/Scramble group (allP<0.05). Conclusion CD147 can cause phosphorylation of AR through PI3K/AKT pathway and then increase PSA expression in prostate cancer, which facilitates prostate cancer progress.
prostate cancer; leukocyte differentiation antigen; phosphorylated androgen receptors; phosphorylated protein kinase B; prostate specific antigen
国家自然科学基金资助项目(81202031);吉林省科技发展计划项目(20130101154JC)。
方芳(1973-),女,副教授,主要研究方向为前列腺癌的分子生物学机制。E-mail: jillmcfang@163.com
王立国(1971-),男,主任医师,主要研究方向为前列腺癌的分子生物学机制。E-mail: urolancet@sina.com
10.3969/j.issn.1002- 266X.2017.28.003
R737.25
A
1002- 266X(2017)28- 0009- 03
2017- 02-21)

