XPD基因在氢醌致U937细胞DNA损伤修复中的作用
王永红,李攀登,肖芸,万秀方,郑丹,温缘缘,赵雪,张亚莉,杨国珍
(1 贵州医科大学医学检验学院,贵阳550004;2 德阳市中西医结合医院)
XPD基因在氢醌致U937细胞DNA损伤修复中的作用
王永红1,李攀登2,肖芸1,万秀方1,郑丹1,温缘缘1,赵雪1,张亚莉1,杨国珍1
(1 贵州医科大学医学检验学院,贵阳550004;2 德阳市中西医结合医院)
目的 探讨XPD基因在氢醌(HQ)致U937细胞DNA损伤修复中的作用。方法 选择5、10、20、40、80 μmol/L HQ分别对U937细胞染毒12、24、48 h,根据各浓度下U937细胞活性,选择10、20、40 μmol/L HQ染毒24、48 h进行后续实验。取10、20、40 μmol/L HQ染毒24、48 h U937细胞,分别设为HQ低、中、高浓度组,另取未染毒U937细胞作为空白对照组,采用单细胞凝胶电泳检测各组细胞尾矩(TM)、Oliv尾矩(OTM),采用Western blotting法检测各组XPD蛋白相对表达量。结果 与空白对照组比较,HQ低、中、高浓度组染毒24、48 h TM和OTM均明显增大(P均<0.05);与同组染毒24 h比较,HQ低、中、高浓度组染毒48 h TM和OTM均明显增大(P均<0.05),染毒48 h HQ低、中、高浓度组TM和OTM依次升高(P均<0.05)。与空白对照组比较,HQ低、中、高浓度组染毒24 h XPD蛋白相对表达量均明显升高(P均<0.05),且HQ高浓度组明显高于HQ低浓度组(P均<0.05);染毒48 h,HQ高浓度组XPD蛋白相对表达量明显高于空白对照组及HQ低、中浓度组(P均<0.05),但空白对照组及HQ低、中浓度组两两比较差异均无统计学意义(P均>0.05);HQ各浓度组染毒48 h XPD蛋白相对表达量与染毒24 h比较差异均无统计学意义(P均>0.05)。结论 XPD基因表达上调可促进HQ致U937细胞DNA损伤修复。
DNA损伤;氢醌;XPD基因;DNA修复
氢醌(HQ)是一种苯的酚类代谢产物,广泛应用于各种工业领域。1999年国际癌症研究机构将HQ归为第三类致癌物之一。动物研究发现,长期接触HQ可造成实验动物肝肾损害,产生骨髓和血液毒性,并导致肿瘤的发生[1]。流行病学调查发现,长期接触HQ人群可出现骨髓造血功能障碍,甚至白血病[2]。研究认为,HQ可通过氧化作用诱导DNA双链断裂[3],而DNA双链断裂会启动核苷酸切除修复(NER)系统,继而进行切除修复。XPD 是转录因子TFⅡH的核心组件,在DNA损伤NER过程中具有重要作用。XPD蛋白主要有两个功能:一是稳定转录因子TFⅡH复合物,在NER过程中具有解旋酶功能[4];二是参与细胞周期调控及p53介导的细胞凋亡[5]。尽管XPD的解旋酶活性不是TFⅡH调控转录所必需的,但XPD的缺失会引起TFⅡH复合物不稳定,继而影响转录及NER过程[6]。2016年3~7月,本研究观察了XPD基因在HQ致U937细胞DNA损伤修复中的作用。现分析结果并报告如下。
1 材料与方法
1.1 材料 U937细胞株,由武汉大学中国典型培养物保藏中心提供。HQ,美国Sigma公司。FBS,美国Gibco公司;RPMI 1640培养基,美国HyClone公司;XPD兔单克隆抗体,美国Abcam公司;Lanin B1鼠单克隆抗体,美国Proteintech公司;细胞核蛋白与细胞浆蛋白抽提试剂盒,上海碧云天生物技术有限公司;0.4%台盼蓝染色液、BCA蛋白浓度测定试剂盒,北京索莱宝科技有限公司。稳流电泳仪,北京六一生物科技有限公司;Eclipe 80i荧光显微镜,日本Nikon公司;Western blotting垂直电泳仪及其转印系统,美国Bio-Rad公司。
1.2 HQ浓度筛选 取U937细胞约1×106个,置于含10% FBS完全培养基的细胞培养瓶中,37 ℃、5% CO2、饱和湿度下培养。当细胞生长至铺满瓶底90%左右时,加入完全培养基重悬细胞,调整细胞悬液密度为0.5×106个/mL,并接种于6孔板,每孔4 mL。称取HQ 0.011 g溶于1 mL完全培养基制成HQ母液,再将HQ母液稀释100倍,即为1 mmol/L HQ溶液。每孔加入适量1 mmol/L HQ溶液,使其终浓度分别为0、5、10、20、40、80 μmol/L,每个浓度设3个复孔。分别于HQ染毒12、24、48 h收集细胞,加入完全培养基重悬细胞,调整细胞悬液密度为1×106个/mL。取细胞悬液90 μL与0.4%台盼蓝染液10 μL混合,轻轻吹打混匀。取混合液10 μL,用改良牛鲍计数板计数细胞总数和活细胞数(未被台盼蓝染色液染色的细胞即为活细胞),计算细胞存活率。实验重复3次,取平均值。各浓度下不同时间细胞存活率比较见表1。结果表明,随着HQ浓度增加及作用时间延长,细胞存活率明显降低。根据HQ染毒24 h细胞存活率不低于50%,且HQ 0、5 μmol/L染毒24 h细胞存活率比较差异无统计学意义,确定后续实验HQ染毒浓度分别为10、20、40 μmol/L。为进一步观察随着HQ染毒时间延长,DNA损伤及修复基因表达情况,选择染毒时间分别为24、48 h。
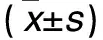
表1 HQ各浓度下染毒12、24、48 h U937细胞存活率比较
注:与 0 μmol/L HQ染毒同时间比较,*P<0.01;与5 μmol/L HQ染毒同时间比较,#P<0.01;与10 μmol/L HQ染毒同时间比较,△P<0.05;与20 μmol/L HQ染毒同时间比较,▲P<0.05;与40 μmol/L HQ染毒同时间比较,▽P<0.05;与同浓度染毒12 h比较,▼P<0.05;与同浓度染毒24 h比较,★P<0.05。
1.3 细胞染毒及DNA损伤检测 分别收集HQ 10、20、40 μmol/L染毒24、48 h 的U937细胞(分别设为HQ低、中、高浓度组),同期另选未染毒的U937细胞作为空白对照组。各组均加入完全培养基重悬细胞,调整细胞悬液密度为1×106个/mL。将提前预热的1%普通琼脂凝胶100 μL滴至磨砂载玻片上,凝结后为第一层胶。另取各组染毒24、48 h细胞悬液30 μL置于1.5 mL离心管中,加入1.5%低熔点琼脂270 μL,反复吹打混匀;取混合液100 μL滴加至第一层胶上,即为第二层胶。将做好第二层胶的载玻片放入专用铝盒中,加入细胞裂解液浸没,置于4 ℃冰箱内避光裂解1 h,PBS冲洗,置于水平电泳槽阳极端附近,加入新鲜配制的碱性电泳液(pH=10)至完全浸没载玻片,避光解旋20 min,25 V、300 mA电泳20 min。取出载玻片,用Tris-HCl中和液(pH=7.5)漂洗5 min×3次;取2 μg/mL EB 50 μL滴至第二层胶上,置于湿盒中,避光染色15 min,自来水冲洗3次,正置荧光显微镜下观察。随机取10个200倍视野,采用单细胞凝胶电泳CometScore分析软件分析50个细胞。以尾矩(TM)和Oliv尾矩(OTM)反映细胞DNA损伤程度。
1.4 XPD蛋白表达检测 采用Western blotting法。取HQ低、中、高浓度组染毒24、48 h细胞及空白对照组细胞各2×106个,根据细胞核蛋白与细胞浆蛋白提取试剂盒说明提取细胞核蛋白。细胞核蛋白经BCA法蛋白定量后,与4×蛋白上样缓冲液以3∶1混匀,100 ℃水浴5 min,然后行聚丙烯酰胺凝胶电泳(5%浓缩胶+10%分离胶)。取各组核蛋白25 μg上样,80 V恒压电泳至Marker分离(约30 min),换用120 V恒压电泳,当蛋白上样缓冲液到达分离胶底部时(约2 h)停止电泳。采用湿转法将蛋白转印至PVDF膜上(220 mA,120 min),5%脱脂奶粉室温封闭2 h,加入XPD兔单克隆抗体(1∶5 000)4 ℃过夜,TBST洗膜10 min×3次,羊抗兔二抗(1∶20 000)室温孵育1 h,TBST洗膜10 min×3次,ECL发光,显影液显影,定影液定影。凝胶电泳扫描仪灰度扫描后,Image J图像分析软件分析各蛋白电泳条带灰度值。以Lamin B1为内参,计算目的蛋白相对表达量。目的蛋白相对表达量=目的蛋白电泳条带灰度值/内参蛋白电泳条带灰度值。
2 结果
2.1 各组HQ染毒不同时间DNA损伤程度比较 见表2。
2.2 各组HQ染毒不同时间XPD蛋白表达比较 见表3。

表2 各组HQ染毒不同时间DNA损伤程度比较±s)
注:与空白对照组同染毒时间比较,*P<0.05;与HQ低浓度组同染毒时间比较,#P<0.05;与HQ中浓度组同染毒时间比较,△P<0.05;与同组染毒24 h比较,▲P<0.05。

表3 各组HQ染毒不同时间XPD蛋白相对表达量比较±s)
注:与空白对照组染毒同时间比较,*P<0.05;与HQ低浓度组染毒同时间比较,#P<0.05;与HQ中浓度组染毒同时间比较,△P<0.05。
3 讨论
苯是一种工农业生产中应用广泛的有机溶剂,也是常见的环境污染物之一。因室内装修、汽车尾气排放、杀虫剂使用等原因,使众多非职业人群长期暴露于低苯环境中,而长期低苯接触可造成骨髓造血功能障碍[7]。苯对人类健康的威胁已成为公共健康领域关注的焦点。HQ与苯毒性密切相关,可通过氧化作用直接攻击DNA分子或与DNA结合形成加合物,导致DNA链断裂,继而造成DNA损伤,最终引起染色体畸变[8]。
单细胞凝胶电泳技术是目前检测单细胞DNA损伤的常用方法,其TM和OTM可反映DNA损伤程度[9,10],TM、OTM越大,DNA损伤越严重。本研究结果显示,HQ低、中、高浓度组染毒24、48 h TM和OTM均高于空白对照组;与同组染毒24 h比较,HQ低、中、高浓度组染毒48 h TM和OTM均明显增大,且染毒48 h HQ低、中、高浓度组TM和OTM依次升高。表明HQ染毒可导致U937细胞DNA损伤,具有剂量-时间依赖性,与苏晶等[11]研究结论基本一致。
研究证实,DNA损伤时,细胞会通过NER、碱基切除修复、错配修复及同源重组等修复机制,修复受损DNA。NER被认为参与修复大多数DNA损伤[12]。在NER过程中,XPD基因能利用水解三磷酸核苷产生的能量解开受损DNA双链,这是NER过程的三个限速步骤之一;同时,XPD蛋白还可与XPF形成异二聚体,对损伤的DNA链进行5′-3′端切除修复[13]。XPD基因参与DNA修复、重组等多个细胞代谢过程,其在DNA修复中的作用对维持基因组稳定尤为重要。陈丽等[14]采用cDNA微阵列技术,从慢性苯中毒患者和无苯接触的健康人群中筛选出包括切除修复交叉互补基因1等在内的25条差异表达基因。Xiao等[15]研究发现,XPD基因(切除修复交叉互补基因2)与慢性苯中毒有关。Chen等[16]研究认为,XPD是与苯中毒相关的DNA修复基因之一。还有研究发现,XPD基因缺陷会导致着色性干皮病,表现为基因组不稳定性增加并有易患肿瘤倾向[17]。HQ作为苯的重要代谢产物,研究XPD基因在HQ致细胞DNA损伤修复中的作用具有重要意义。
本研究结果显示,与空白对照组比较,HQ低、中、高浓度组染毒24 h XPD蛋白相对表达量均明显升高,且HQ高浓度组明显高于HQ低浓度组;染毒48 h,HQ高浓度组XPD蛋白相对表达量明显高于空白对照组及HQ低、中浓度组。说明HQ染毒后可能启动了NER,通过上调XPD表达,修复受损的DNA。XPD缺失会增加基因组的不稳定性,其高表达可能参与修复受损的DNA,虽然XPD表达上调与DNA损伤同时存在,但XPD表达上调并未随染毒时间延长进一步增加,而DNA损伤却进一步加重。因此推测,HQ染毒后引起的DNA损伤可能没有完全修复。DNA损伤修复途径有多种,且基因修复需要众多蛋白参与,一个修复基因并不能完全反映细胞DNA的整体修复情况,而且DNA损伤的修复过程时间较长,而本研究观察时间较短,也可能是DNA损伤未完全修复的原因之一。
综上所述,XPD基因表达上调可促进HQ致U937细胞DNA损伤修复。但DNA损伤修复机制复杂,HQ所致DNA损伤的详尽修复机制仍需进一步深入研究。
[1] Regev L, Wu M, Zlotolow R, et al. Hydroquinone, a benzene metabolite, and leukemia: a case report and review of the literature[J]. Toxicol Ind Health, 2012,28(1):64-73.
[2] Qin W, Wang Y, Fang G, et al. Evidence for the generation of reactive oxygen species from hydroquinone and benzoquinone: roles in arsenite oxidation[J]. Chemosphere, 2016(150):71-78.
[3] Raj A, Nachiappan V. Exposure to benzene metabolites causes oxidative damage in saccharomyces cerevisiae[J]. Antonie Van Leeuwenhoek, 2016,109(6):841-854.
[4] de Laat WL, Jaspers NG, Hoeijmakers JH. Molecular mechanism of nucleotide excision repair[J]. Genes Dev, 1999,13(7):768-785.
[5] Robles AL, Wang XW, Harris CC. Drug-induced apoptosis is delayed and reduced in XPD lymphoblastoid cell lines: possible role of TFⅡH in p53-mediated apoptotic cell death[J]. Oncogene, 1999,18(33):4681-4688.
[6] Kanchan S, Mehrotra R, Chowdhury S. Evolutionary pattern of four representative DNA repair proteins across six model organisms: an in silico analysis[J]. Netw Model Anal Health Inform Bioinforma, 2014,3(1):70.
[7] Smith MT, Zhang L, Mchale CM, et al. Benzene, the exposome and future investigations of leukemia etiology[J]. Chem Biol Interact, 2011,192(1-2):155-159.
[8] Sun P, Qian J, Zhang Z, et al. Polymorphisms in phase Ⅰ and phase Ⅱ metabolism genes and risk of chronic benzene poisoning in a Chinese occupational population[J]. Carcinogenesis, 2008,29(12):2325-2329.
[9] Ashby J, Tinwell H, Lefevre PA, et al. The single cell gel electrophoresis assay for induced DNA damage (comet assay): measurement of tail length and moment[J]. Mutagenesis, 1995,10(2):85-90.
[10] Olive PL, Banáth JP, Durand RE. Heterogeneity in radiation-induced DNA damage and repair in tumor and normal cells measured using the "comet" assay[J]. Radiat Res, 1990,122(1):86-94.
[11] 苏晶,李琴,秦富,等.低浓度苯系物暴露与加油站工人淋巴细胞遗传损伤的关系研究[J].环境与健康杂志,2014,31(4):317-319.
[12] Recio L, Bauer A, Faiola B. Use of genetically modified mouse models to assess pathways of benzene-induced bone marrow cytotoxicity and genotoxicity[J]. Chem Biol Interact, 2005(153-154):159-164.
[13] Houten BV, Kuper J, Kisker C. Role of XPD in cellular functions: to TFⅡH and beyond[J]. DNA Repair(Amst), 2016(44):136-142.
[14] 陈丽,毕勇毅,陶宁,等.用cDNA微列阵技术探讨苯中毒相关的DNA复制及损伤修复基因表达谱的改变[J].中华劳动卫生职业病杂志,2005,23(4):248-251.
[15] Xiao S, Gao L, Liu Y, et al. Association of genetic polymorphisms in ERCC1 and ERCC2/XPD with risk of chronic benzene poisoning in a Chinese occupational population[J]. Mutat Res, 2012,751(1):52-58.
[16] Chen L, Bi YY, Tao N, et al. cDNA microarray to identify the significance of DNA replication and damage repair genes associated with benzene poisoning[J]. Zhanghua Lao Dong Wei Sheng Zhi Ye Bing Za Zhi, 2005,23(4):248-251.
[17] Moriwaki S, Takigawa M, Igarashi N, et al. Xeroderma pigmentosum complementation group G patient with a novel homozygous missense mutation and no neurological abnormalities[J]. Exp Dermatol, 2012,21(4):304-307.
Role of XPD gene in DNA damage repair of U937 cells induced by hydroquinone
WANGYonghong1,LIPandeng,XIAOYun,WANXiufang,ZHENGDan,WENYuanyuan,ZHAOXue,ZHANGYali,YANGGuozhen
(1SchoolofChinicalLaboratoryScience,GuizhouMedicalUniversity,Guiyang550004,China)
Objective To investigate the role of XPD gene in DNA damage repair of U937 cells induced by hydroquinone (HQ). Methods U937 cells were treated with 5, 10, 20, 40, and 80 μmol/L HQ for 12, 24 and 48 h. According to the cell activity, we selected 10, 20, and 40 μmol/L HQ for the following experiments. U937 cells were treated with 10, 20 and 40 μmol/L HQ for 24 and 48 h, which were taken as the low-dose, medium-dose, and high-dose HQ groups, meanwhile, the untreated U937 cells were taken as the blank control group. Single cell gel electrophoresis tail moment (TM) and Oliv tail moment (OTM) were used to detect DNA damage. The relative expression of XPD protein in each group was determined by Western blotting. Results Compared with the blank control group, TM and OTM in the low-dose, medium-dose, and high-dose HQ groups at 24, 48 h significantly increased (bothP<0.05). TM and OTM in the low-dose, medium-dose, and high-dose HQ groups at 48 h significantly increased as compared with that of the same group at 24 h (bothP<0.05), and the TM and OTM values of the low-dose, medium-dose, and high-dose HQ groups increased successively (bothP<0.05). Compared with the blank control group, the relative expression of XPD protein in the low-dose, medium-dose, and high-dose HQ groups at 24 h was significantly higher (P<0.05), and the high-dose group was significantly higher than the low-dose group (P<0.05). The relative expression of XPD protein in the high-dose HQ group at 48 h was significantly higher than that in the blank control group, low-dose, and medium-dose HQ groups (P<0.05), but there was no significant difference between the blank control group and low-dose and medium-dose HQ groups (allP>0.05). The relative expression of XPD protein in each group at 48 h was not significantly different from that at 24 h (allP>0.05). Conclusion The up-regulation of XPD gene expression promotes the repair of DNA damage of U937 cells induced by HQ.
DNA damage; hydroquinone; XPD gene; DNA repair
国家自然科学基金资助项目(81360437);贵州省科教青年英才培养工程项目(黔省专合字〔2012〕164号)。
王永红(1989-),女,硕士研究生,主要研究方向为造血损伤的分子机制。E-mail: 1239976713@qq.com
张亚莉(1973-),女,教授,主要研究方向为造血损伤的分子机制。E-mail: zhangyl20011002@aliyun.com 杨国珍(1954-),女,教授,主要研究方向为出生缺陷筛查及其发病机制。E-mail: yangguozhen-kong@hotmail.com
10.3969/j.issn.1002- 266X.2017.28.002
Q754
A
1002- 266X(2017)28- 0005- 04
2016-12- 07)

