miR-31慢病毒载体质粒构建及其对宫颈癌HeLa细胞增殖和迁移能力的影响
王琳琳,胡晓霞,刘斐
(广西壮族自治区人民医院,南宁530021)
·论著·
miR-31慢病毒载体质粒构建及其对宫颈癌HeLa细胞增殖和迁移能力的影响
王琳琳,胡晓霞,刘斐
(广西壮族自治区人民医院,南宁530021)
目的 构建微小核糖核酸31(miR-31)慢病毒载体质粒,并观察其对宫颈癌HeLa细胞增殖和迁移能力的影响。方法 以包含miR-31基因的序列为目的片段,设计末端含有相应酶切位点的引物,PCR扩增目的片段,产物双酶切后插入线性化慢病毒载体中,构建miR-31慢病毒载体质粒并鉴定。将miR-31慢病毒载体质粒与包装质粒pPACKH1-GAG、pPACKH1-REV、pVSV-G共转染宫颈癌HeLa细胞,并进行慢病毒包装,检测miR-31慢病毒载体质粒滴度。取对数生长期HeLa细胞,随机分为空白对照组、miR-31组、空载体组,空白对照组不做任何处理,miR-31组予miR-31慢病毒载体质粒处理,空载体组予空载体慢病毒质粒处理。采用实时荧光定量PCR法检测各组miR-31 mRNA表达;MTT法和细胞克隆实验检测各组细胞增殖能力,Transwell小室法检测各组细胞迁移能力。结果 成功构建重组慢病毒表达质粒,其病毒滴度为3×107TU/mL。miR-31组miR-31 mRNA相对表达量明显高于空白对照组、空载体组(P均<0.05),而空白对照组与空载体组比较P>0.05。miR-31组细胞增殖和迁移能力均高于空白对照组、空载体组(P均<0.05),而空白对照组与空载体组比较P均>0.05。结论 成功构建了miR-31慢病毒载体质粒,建立了稳定过表达miR-31的宫颈癌HeLa细胞。稳定过表达miR-31的宫颈癌HeLa细胞增殖和迁移能力明显增强。
宫颈癌;微小核糖核酸31;慢病毒包装;细胞增殖;细胞迁移
微小核糖核酸(miRNA)是一类内源性非编码小分子RNA,约由22个核苷酸组成,广泛存在于真核生物中。miRNA诱导的沉默复合体通过与靶基因mRNA的3′非编码区碱基特异性结合,使mRNA降解或抑制翻译,在转录后水平对基因表达起调控作用[1]。miR-31编码基因定位于染色体9p21.3内含子区。研究发现,在宫颈癌组织中miR-31高表达,可能具有癌基因作用,参与宫颈癌的多种恶性生物学行为[2,3]。但其具体分子生物学机制尚未完全明确。2015年8月~2016年2月,本研究通过构建miR-31慢病毒表达质粒,获得稳定表达miR-31的宫颈癌HeLa细胞(以下称HeLa细胞),并观察其增殖和迁移能力变化,旨在进一步研究miR-31在宫颈癌中的作用。
1 材料与方法
1.1 材料 慢病毒载体质粒pCDH-CMV-MCS-EF1-copGFP,包装质粒pPACKH1-GAG、pPACKH1-REV和pVSV-G,美国Invitrogen公司;大肠杆菌DH5α感受态细胞,北京天根生化科技有限公司。HeLa细胞,由广西医科大学附属肿瘤医院李力教授惠赠;293T细胞,中国科学院细胞中心。DNA提取试剂盒、质粒提取试剂盒、DNA回收试剂盒、2×Taq PCR MasterMix、T4 DNA连接酶,北京天根生化科技有限公司;XbaⅠ、BamHⅠ限制内切酶,美国NEB公司;RPMI 1640培养液、FBS、DMEM培养基,美国Gibco公司;X-tremeGENE HP DNA Transfection Reagent,德国Roche公司。基因扩增仪,珠海黑马医学仪器有限公司;实时荧光定量PCR仪,美国ABI公司;凝胶成像分析系统,日本SANYO株式会社;电泳仪、电泳槽,美国Bio-Rad公司;显微镜成像系统,日本奥林巴斯株式会社。
1.2 miR-31慢病毒载体质粒构建
1.2.1 目的基因及引物设计合成 从GeneBank获取miR-31基因序列,在miR-31基因序列的上下游截取相应碱基序列作为目的片段(包含目的基因miR-31)。根据目的片段设计引物,由美国Invitrogen公司合成。引物序列:miR-31-FP:5′-GCTCTAG-AAAACCTCCTGTGCCTAACTAC-3′(下划线部分为XbaⅠ酶切位点),miR-31-RP:5′-CGCGGATCCCCA-TACAGGCCAATGTGGCTA-3′(下划线部分为BamHⅠ酶切位点),扩增片段大小为417 bp。测序引物序列由广州华大基因科技有限公司合成。正向引物CMV-F:5′-CGCAAATGGGCGGTAGGCGTG-3′,反向引物CK:5′-CTCTAGGCACCCGTTCAATTG-3′。以目的片段为模板进行PCR扩增,反应体系共25 μL:引物miR-31-FP和miR-31-RP各取1 μL、模板2 μL、2×Taq PCR MasterMix 12.5 μL、ddH2O 8.5 μL;反应条件:94 ℃预变性3 min,94 ℃ 30 s、55 ℃ 30 s、72 ℃ 1 min 30个循环,最后72 ℃延伸10 min。用XbaⅠ、BamHⅠ限制性内切酶双酶切两端分别有XbaⅠ、BamHⅠ酶切位点的PCR扩增产物,使目的片段两端含有黏性末端。载体质粒pCDH-CMV-MCS-EF1-copGFP用XbaⅠ、BamHⅠ限制性内切酶双酶切后变成线性,大小约7 000 bp,目的片段为417 bp。目的片段PCR扩增产物经双酶切后,大小与预期长度一致,约400 bp,符合实验要求。
1.2.2 miR-31慢病毒载体质粒构建及鉴定 取XbaⅠ、BamHⅠ双酶切PCR产物及慢病毒载体质粒pCDH-CMV-MCS-EF1-copGFP,分别用2.0%、0.7%琼脂糖凝胶回收酶切产物,连接目的片段和载体片段。反应体系共10 μL:目的片段0.7 μL,载体片段0.8 μL,10×T4 DNA ligase buffer 1 μL,T4 DNA ligase 1 μL,ddH2O 6.5 μL;反应条件:16 ℃连接过夜。连接产物转化DH5α感受态细胞,涂布含100 μg/mL氨苄青霉素的LB平板,37 ℃培养16 h;挑选单克隆菌落接种于含100 μg/mL氨苄青霉素的LB培养基中,37 ℃ 220 r/min振荡培养16 h;以提取质粒作为模板,以miR-31-FP、miR-31-RP作为引物进行PCR扩增。反应条件:94 ℃预变性3 min,94 ℃ 30 s、55 ℃ 30 s、72 ℃ 1 min 30个循环,最后72 ℃延伸10 min。提取质粒用XbaⅠ、BamHⅠ双酶切。扩增产物、酶切产物经凝胶电泳分析鉴定。将提取质粒送广州华大基因科技有限公司测序鉴定。
1.3 miR-31表达对HeLa细胞增殖和迁移能力影响的观察
1.3.1 miR-31慢病毒载体质粒包装及其滴度测定 将HeLa细胞接种于含10% FBS的培养基中,置于37 ℃、5%CO2的细胞培养箱中培养,隔天换液。取对数生长期HeLa细胞接种于96孔板,5×103个/孔。利用X-tremeGENE HP DNA Transfection Reagent将包装质粒pPACKH1-GAG、pPACKH1-REV、pVSV-G与miR-31慢病毒载体质粒按质量比为1∶3∶1∶5制成转染复合物。取10 μL转染复合物加入孔板内,转染HeLa细胞,37 ℃、5% CO2的细胞培养箱培养72 h。将细胞反复冻融3次,4 ℃、4 000×g离心4 min,收集上清,0.45 μm滤过膜除菌并分装。以包装的空载体慢病毒作为对照。按5×103个/孔接种于96孔板中,10倍倍比稀释病毒原液8个梯度,培养24 h后加入100 μL DMEM +10% FBS+1% P/S。培养72 h,荧光显微镜下观察GFP表达,计算病毒滴度。病毒滴度=(平均GFP阳性细胞数×转染时细胞数)/100×每孔病毒稀释液体积×稀释倍数。结果显示,miR-31慢病毒载体质粒滴度为3×107TU/mL,空载体慢病毒质粒滴度为2×107TU/mL,二者比较P<0.05。说明miR-31慢病毒载体质粒包装成功,可用于后续实验。
1.3.2 miR-31慢病毒载体质粒感染HeLa细胞及稳转株筛选 取对数生长期HeLa细胞,按5×103个/孔接种于96孔板中,37 ℃、5% CO2的细胞培养箱培养24 h。随机将细胞分为空白对照组、miR-31组、空载体组,空白对照组不做任何处理,miR-31组给予10 μL重组慢病毒原液+100 μL培养基,空载体组给予10 μL空载体慢病毒原液+100 μL培养基,37 ℃、5% CO2条件下孵育12 h,至被感染细胞形态饱满且未见明显死亡时,弃上清,更换培养基。miR-31组病毒感染72 h,感染效率超过85%时,流式细胞仪分选荧光表达细胞,即为稳定过表达miR-31的HeLa细胞。
1.3.3 HeLa细胞miR-31 mRNA表达检测 采用实时荧光定量PCR法。取稳定过表达miR-31的HeLa细胞扩大培养,miRcute miRNA提取分离试剂盒提取细胞RNA,通过miR-31逆转录引物逆转录合成cDNA,然后进行PCR扩增,扩增引物见1.2。PCR反应体系共20 μL:2×SuperReal PreMix 10 μL,上下游引物各0.6 μL,cDNA 1 μL,50×Reference Dye 0.4 μL,RNase-free H2O 7.4 μL;反应条件:95 ℃预变性15 min,95 ℃ 10 s、60 ℃ 32 s 40个循环。以U6为内参(上游引物: 5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAATT-TGCGT-3′),2-ΔΔCt法计算miR-31 mRNA相对表达量。
1.3.4 HeLa细胞增殖和迁移能力检测 ①细胞增殖能力:a.采用MTT法。取空白对照组、miR-31组、空载体组对数生长期HeLa细胞接种于96孔板,3×103个/孔,每组设5个复孔,37 ℃、5% CO2的细胞培养箱中培养。各组培养第1、2、3、4、5天时分别加入5 mg/mL MTT溶液20 μL,37 ℃、5% CO2的细胞培养箱中培养4 h,弃上清,加入DMSO 150 μL,37 ℃恒温摇床低速振荡10 min,酶联免疫检测仪490 nm波长处检测各孔的光密度(OD)值。实验重复3次,取平均值。b.细胞克隆实验:取空白对照组、miR-31组、空载体组对数生长期HeLa细胞接种于6孔板,1×103个/孔,每组设3个复孔,37 ℃、5% CO2的细胞培养箱中培养。至肉眼可见克隆时终止培养,弃去培养基,PBS浸洗2次,甲醇固定15 min,弃固定液,0.5%结晶紫染色25 min。显微镜下计数克隆数,每个大于50个细胞的集落计为1个克隆。克隆形成率=(克隆数/接种细胞数)×100%。②细胞迁移能力:采用Transwell小室法。取空白对照组、miR-31组、空载体组对数生长期细胞,Transwell chamber在37 ℃条件下温育,用无血浆培养基悬浮细胞并计数,制成密度为2×105个/mL的细胞悬液;在Transwell下室加入600 μL含10%血浆的培养基,上室加入150 μL细胞悬液,37 ℃、5% CO2的细胞培养箱中培养6 h,用湿棉棒小心擦去上室底膜表面细胞,甲醇固定,0.1%结晶紫染色,显微镜下观察。随机取5个400倍视野,计数穿膜细胞数。
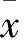
2 结果
2.1 miR-31慢病毒载体鉴定 以重组质粒为模板,PCR扩增目的片段,获得单一特异条带,400 bp左右,与设计的片段大小基本相符,说明目的片段已成功插入载体质粒。经广州华大基因科技有限公司测序,与GeneBank中miR-31的基因序列完全一致,表明miR-31慢病毒载体质粒(即pCDH-CMV-MCS-EF1-copGFP-miR-31)构建成功。
2.2 各组miR-31 mRNA表达比较 空白对照组、空载体组、miR-31组miR-31 mRNA相对表达量分别为1.29±0.18、1.07±0.12、3.78±0.28,miR-31组miR-31 mRNA相对表达量明显高于空白对照组、空载体组(P均<0.05),而空白对照组与空载体组比较P>0.05。
2.3 各组细胞增殖能力比较 见表1。miR-31组、空载体组、空白对照组克隆形成率分别为(41.16±5.79)%、(29.40±3.84)%、(28.60±4.14)%,miR-31组克隆形成率明显高于空载体组、空白对照组(P均<0.05),而空载体组与空白对照组比较P>0.05。

表1 各组细胞增殖能力比较±s)
注:与空白对照组比较,*P<0.01;与空载体组比较,#P<0.01。
2.4 各组细胞迁移能力比较 miR-31组、空载体组、空白对照组穿膜细胞数分别为(194.6±14.39)、(132.6±12.81)、(130.2±18.01)个, miR-31组穿膜细胞数明显高于空载体组、空白对照组(P均<0.05),而空载体组与空白对照组比较P>0.05。
3 讨论
目前已发现的miRNA有上千种,其在不同肿瘤组织中表达上调或下调,通过干扰靶基因调控与肿瘤相关的信号通路或某些关键因子,影响肿瘤发生、发展,发挥类似癌基因或抑癌基因作用[4~6],有可能成为肿瘤诊断的分子生物学标志物和治疗靶点[7]。研究miRNA的方法有多种,主要通过过表达或抑制表达两种途经。过表达主要通过miRNA类似物瞬时转染和构建表达载体稳定转染[8]。携带外源性基因的慢病毒载体,经病毒包装成感染颗粒,通过感染细胞或活体组织,实现外源性基因在细胞或活体组织中表达。该载体将外源性基因有效地整合到宿主染色体上,从而使外源性基因持久表达[9]。当进行持续时间较长的实验时,采用慢病毒载体构建稳转株来改变相应内源性基因的表达比瞬时转染更具优势。本课题组前期将miR-31 mimic(miR-31模拟片段)转入宫颈癌细胞中,发现其可增强宫颈癌细胞的增殖、侵袭及迁移能力,但miR-31mimic在细胞内存在时间短,且转染试剂毒性大,实验结果不可靠[2]。本研究将携带GFP基因和miR-31基因慢病毒载体质粒感染HeLa细胞,使miR-31基因和GFP基因整合进入宿主基因组,建立了稳定过表达miR-31的HeLa细胞。
研究发现,miR-31在多种恶性肿瘤(如肺癌、皮肤鳞癌、结肠癌等)组织中过表达,发挥癌基因作用。如在肺癌中可通过抑制抑癌基因BAP1促进肺癌细胞增殖并抑制其凋亡,加速肿瘤生长[10];在皮肤鳞癌中通过直接抑制抑癌基因RhoTB1的表达,参与皮肤鳞癌的发生、发展[11];在结肠癌中可增强癌细胞的增殖能力,并与患者预后有关[12]。Wang等[3]研究发现,宫颈癌组织中miR-31 mRNA相对表达量与临床分期、淋巴结转移及脉管浸润呈正相关关系,下调miR-31表达可抑制宫颈癌细胞增殖、侵袭和转移。说明miR-31可能与宫颈癌的发生、发展有关。本研究采用miR-31模拟片段转入HeLa细胞,成功建立稳定表达miR-31的HeLa细胞;miR-31组培养3~5天,其增殖和迁移能力明显高于空载体组、空白对照组,而空载体组与空白对照组比较差异无统计学意义,说明miR-31过表达可促进宫颈癌细胞增殖和迁移能力。
综上所述,成功构建了miR-31慢病毒表达载体,建立了稳定过表达miR-31的HeLa细胞。稳定过表达miR-31的HeLa细胞增殖和迁移能力明显增强。
[1] Hata A, Lieberman J. Dysregulation of microRNA biogenesis and gene silencing in cancer[J]. Sci Signal, 2015,8(368):e3.
[2] Zheng W, Liu Z, Zhang W, et al. miR-31 functions as an oncogene in cervical cancer[J]. Arch Gynecol Obstet, 2015,292(5):1083-1089.
[3] Wang N, Zhou Y, Zheng L, et al. MiR-31 is an independent prognostic factor and functions as an oncomir in cervical cancer via targeting ARID1A[J]. Gynecol Oncol, 2014,134(1):129-137.
[4] Berezikov E, Guryev V, van de Belt J, et al. Phylogenetic shadowing and computational identification of human microRNA genes[J]. Cell, 2005,120(1):21-24.
[5] Banno K, Iida M, Yanokura M, et al. MicroRNA in cervical cancer: OncomiRs and tumor suppressor miRs in diagnosis and treatment[J]. Sci World J, 2014,2014:178075.
[6] Edmonds MD, Boyd KL, Moyo T, et al. MicroRNA-31 initiates lung tumorigenesis and promotes mutant KRAS-driven lung cancer[J]. J Clin Invest,2016,126(1):349-364.
[7] D′Angelo B, Benedetti E, Cimini A, et al. MicroRNAs: a puzzling tool in cancer diagnostics and therapy[J]. Anticancer Res, 2016,36(11):5571-5575.
[8] Thind A, Wilson C. Exosomal miRNAs as cancer biomarkers and therapeutic targets[J]. J Extracell Vesicles, 2016(5):31292.
[9] 孟凡荣,陈琛,万海粟,等.慢病毒载体及其研究进展[J].中国肺癌杂志,2014,17(12):870-876.
[10] Yu M, Liang H, Fu Z, et al. BAP1 suppresses lung cancer progression and is inhibited by miR-31[J]. Oncotarget, 2016,7(12):13742-13753.
[11] Lin N, Zhou Y, Lian X, et al. MicroRNA-31 functions as an oncogenic microRNA in cutaneous squamous cell carcinoma cells by targeting RhoTBT1[J]. Oncol Lett, 2017,13(3):1078-1082.
[12] Li T, Luo W, Liu K, et al. miR-31 promotes proliferation of colon cancer cells by targeting E2F2[J]. Biotechnol Lett, 2015,37(3):523-532.
Construction of miR-31 lentiviral vector and its effect on proliferation and migration of cervical cancer HeLa cells
WANGLinlin,HUXiaoxia,LIUFei
(ThePeople′sHospitalofGuangxiZhuangAutonomousRegion,Nanning530021,China)
Objective To construct the miR-31 lentiviral vector and to investigate its effect on proliferation and migration of cervical cancer HeLa cells. Methods PCR was used to amplify the target gene which included gene miR-31. The target gene was designed with appropriate enzyme sites at the end of the primer pairs. We inserted the PCR products into linearization of lentiviral vector after the double digestion. Restriction endonuclease analysis and DNA sequencing had confirmed the sequence of the recombinant plasmid pCDH-CMV-MCS-EF1-copGFP-miR-31. HeLa cells were co-transfected with the lentiviral vectors pCDH-CMV-MCS-EF1-copGFP-miR-31, pPACKH1-GAG, pPACKH1-REV and pVSV-G, the titer of the lentivirus was detected. HeLa cells in the logarithmic phase were randomly divided into the control group without any treatment, the miR-31 group treated with lentivirus miR-31, and the negative control group given empty lentivirus. The qPCR was used to detect the expression of miR-31 in HeLa cells of each group. The cell proliferation was detected by clone formation assay and MTT assay, and the cell migration ability was detected by Transwell assay. Results The recombinant lentivirus expression plasmid was constructed successfully, with lentivirus titer of 3×107TU/mL. The expression of miR-31 in HeLa cells of the miR-31 group was significantly higher than that of the other two groups (allP<0.05); no significant difference was found between the control group and the negative control group (P>0.05). Compared with the other two groups, the proliferation and migration abilities of HeLa cells were increased in the miR-31 group (allP<0.05); no significant difference was found between the control group and the negative control group (P>0.05). Conclusion The miR-31 lentivirus expression plasmid is constructed successfully, and the proliferation and migration abilities of HeLa cells with stale expression of miR-31 are significantly enhanced.
cervical cancer; microRNA-31; lentivirus packaging; cell proliferation; cell migration
国家自然科学基金资助项目(81060219、81660434);广西自然科学基金资助项目(2014GXNSFAA118266)。
王琳琳(1991-),女,住院医师,研究方向为妇科肿瘤。E-mail: henansqwll@126.com
胡晓霞(1964-),女,主任医师,研究方向为妇科肿瘤。E-mail: huxxia@hotmail.com
10.3969/j.issn.1002- 266X.2017.28.001
R737.33
A
1002- 266X(2017)28- 0001- 04
2017- 03-11)

