甲状腺功能亢进患者骨密度与血清骨代谢指标的变化及意义
黄小红,王小中,杨伟明,樊启伟,樊有龙
(南昌大学第二附属医院 江西省检验医学重点实验室,南昌 330006)
甲状腺功能亢进患者骨密度与血清骨代谢指标的变化及意义
黄小红,王小中,杨伟明,樊启伟,樊有龙
(南昌大学第二附属医院 江西省检验医学重点实验室,南昌 330006)
目的 观察甲状腺功能亢进(以下简称甲亢)患者骨密度及血清骨代谢指标的变化,为甲亢患者骨质疏松的早期诊断提供依据。方法 选择甲亢患者65例作为甲亢组、健康体检者49例作为对照组。采用双能X线骨密度仪检测两组腰椎1~4(L1~L4)和股骨近端(股骨颈、Wards三角、大粗隆)的骨密度。采集两组空腹静脉血,检测血清骨代谢破骨细胞功能指标β胶原特殊序列(β-CTX)、Ⅰ型前胶原羧基末端前肽(PⅠNP)、N端骨钙素(N-MID)及间接反映破骨细胞活性的指标骨源性碱性磷酸酶(ABAP)水平。结果 甲亢组L1~L4、股骨颈、Wards三角、大粗隆骨密度均低于对照组(P均<0.01),血清β-CTX、PⅠNP、N-MID及ABAP水平均高于对照组(P均<0.05)。甲亢患者血清PⅠNP、N-MID、β-CTX均与各部位骨密度呈负相关(P均<0.01)。结论 甲亢患者多个部位的骨密度出现下降、血清骨代谢相关指标明显升高,且二者明显相关;动态观察血清骨代谢指标有助于早期发现甲亢所致的骨质疏松。
甲状腺功能亢进;骨代谢;骨密度;骨质疏松
甲状腺功能亢进(简称甲亢)是内分泌系统的一种常见慢性疾病。由于甲亢时甲状腺激素分泌过多,可使成骨细胞和破骨细胞活性或数量发生改变,促进骨吸收和骨形成,导致骨矿物质代谢紊乱[1~3]。骨质疏松是一种以低骨量、骨组织结构改变而加强骨脆性和增加骨折风险的系统性骨骼疾病,甲亢是引起继发性骨质疏松的常见原因。甲亢患者随着骨矿物质的减低,骨吸收和骨形成的平衡逐渐被打破,骨密度下降,发生骨质疏松和骨折的风险大大提高[4]。因此,检测甲亢患者的骨密度及血清骨代谢标记物,对于骨质疏松的早期诊断及治疗具有重要意义。2016年4~12月,我们检测了65例甲亢患者的骨密度、血清骨代谢相关指标,探讨甲亢患者骨密度及骨代谢相关因素的变化,为甲亢患者骨质疏松的早期诊断提供依据。
1 资料与方法
1.1 临床资料 选择同期在我院住院治疗的甲亢患者65例为甲亢组,患者均有典型的临床症状,甲状腺功能指标均符合甲亢诊断标准[5]。选择与甲亢组年龄、性别相匹配的健康体检者49例作为对照组。两组均无影响骨代谢的其他疾病,未使用激素、维生素D制剂、钙剂等影响骨代谢的药物。本研究得到入选者的知情同意和我院医学伦理委员会批准。
1.2 骨密度测量 采用双能X线骨密度仪(美国GE公司,型号为Lunar ProdigyTM)检测两组骨密度,测量部位为腰椎1~4(L1~L4)和股骨近端(股骨颈、Wards三角、大粗隆),参数以骨矿面密度表示。
1.3 血清骨代谢相关指标测定 所有入选者均采集空腹静脉血,及时分离血清保存于-80 ℃冰箱中待测。采用罗氏化学发光仪测定成骨细胞活性指标Ⅰ型前胶原羧基末端前肽(PⅠNP)、N端骨钙素(N-MID)和破骨细胞活性指标β胶原特殊序列(β-CTX),并测定间接反映成骨细胞活性的指标骨源性碱性磷酸酶(ABAP)水平。
1.4 统计学方法 应用SPSS20.0统计软件。对各组数据进行正态性检验,因数据属于非正态分布,用中位数M(极小值,极大值)表示,组间比较采用非参数检验(Mann-Whitney检验)。相关性分析采用Spearman相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 两组不同部位骨密度比较 甲亢组L1~L4、股骨颈、Wards三角、大粗隆骨密度均低于对照组(P均<0.01)。见表1。

表1 两组不同部位骨密度比较[g/cm2,M(极小值,极大值)]
注:与对照组比较,﹟P<0.01。
2.2 各组血清骨代谢相关指标比较 甲亢组血清β-CTX、PⅠNP、N-MID及ABAP水平均高于对照组(P均<0.05)。见表2。
2.3 甲亢患者血清成骨细胞及破骨细胞活性指标

表2 两组骨代谢相关指标比较[M(极小值,极大值)]
注:与对照组比较,﹟P<0.01。
与不同部位骨密度的相关性 甲亢患者血清成骨细胞活性指标PⅠNP、N-MID及破骨细胞功能指标β-CTX均与各部位骨密度呈负相关(P均<0.01)。ABAP与各部位骨密度无相关性。详见表3。
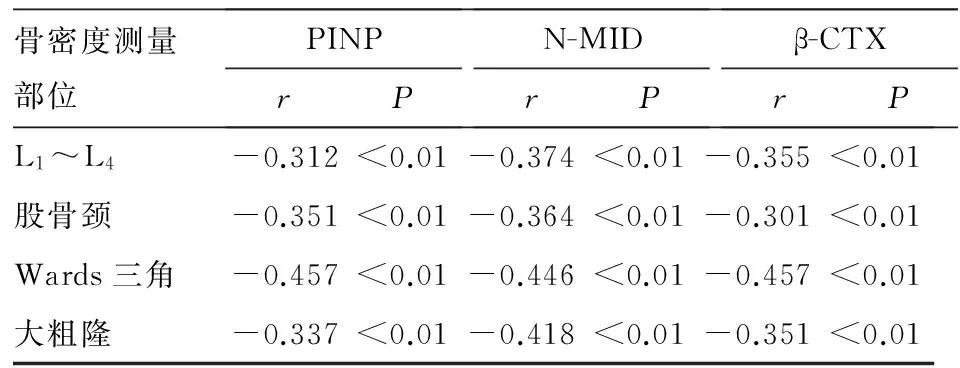
表3 甲亢患者血清成骨细胞及破骨细胞活性指标与不同部位骨密度的相关性结果
3 讨论
甲亢是由于甲状腺激素分泌过多影响正常的骨代谢而导致的一种代谢性疾病,过多的甲状腺激素可导致骨转换加快,骨吸收扩大,破骨细胞溶解加速,导致骨代谢紊乱,骨吸收活动更加显著,因而使骨密度降低,继而发生骨质疏松。研究发现,甲亢患者骨质疏松的发生率为19%~29%[6, 7]。假如没有发生骨质疏松性骨折,甲亢引起的骨质疏松症通常是可逆的,报道显示甲亢患者通过治疗后骨密度上升[8]。因此,临床须及早对甲亢患者的骨代谢紊乱进行干预,定期检测甲亢患者骨密度及骨代谢指标的变化,以有效评估骨折风险、早期发现及预防骨质疏松的发生。
双能X线骨密度测定是评估骨密度的金标准[9],其能够精确测量骨矿物质的丢失情况,精确度高,重复性较好。本研究发现,甲亢组L1~L4、股骨颈、Wards三角、大粗隆的骨密度均低于对照组,这提示甲亢患者不同部位的骨密度均下降,骨量明显减少,骨的质量较差,表明甲亢患者发生骨折的风险较正常人增高。
虽然双能X线骨密度测定的精确度高,但是其仍有辐射,且价格昂贵,在规模较小的医院及社区无法普及,无法作为筛查骨质疏松的方法,因此寻找方便易得的血清骨代谢标志物尤其必要。目前,临床上应用的骨代谢标志物分为骨吸收和骨形成两大类。反映骨吸收的指标主要是β-CTX,骨形成的指标主要有PⅠNP、N-MID、ABAP。IOF推荐β-CTX[10]及PⅠNP[11]为骨吸收及形成的敏感指标。在骨吸收过程中,破骨细胞降解Ⅰ型胶原,降解产物的主要分子片段是CTX,有CTX-MMP、α-CTX、β-CTX,而β-CTX的敏感性、特异性均较高[12]。PINP是总Ⅰ型前胶原延长肽在成骨细胞中的合成产物,不受年龄及性别的影响,主要反映Ⅰ型胶原的合成速率及骨转换情况。研究表明,与骨形成的其他指标N-MID相比,PⅠNP有更高的特异性和敏感性[13]。β-CTX的升高反映甲亢患者破骨细胞活动频繁、骨吸收活跃;而PⅠNP、N-MID、ABAP的升高,反映甲亢患者体内成骨细胞的活动,骨形成及骨转换速率加快。骨代谢指标的显著升高,提示甲亢患者骨吸收与骨形成在高速运作,呈现高转换型骨代谢紊乱,骨吸收大于骨形成,导致骨量丢失,继而引起骨质疏松。ABAP对了解成骨细胞功能有重要意义,其检测方法简便、灵敏,在基层医院即能实施。温宇明等[14]研究发现,甲亢患者血清ABAP水平升高。本研究发现,甲亢组破骨细胞功能指标(β-CTX)和成骨细胞活性指标(PⅠNP、N-MID和ABAP)水平均高于对照组,提示甲亢患者成骨细胞和破骨细胞均在活跃状态,既有骨组织的形成,同时也有骨组织的重吸收,二者活动的不协调,造成骨代谢的紊乱。相关性分析显示,甲亢患者血清成骨细胞活性指标PⅠNP、N-MID及破骨细胞功能指标β-CTX均与各部位骨密度呈负相关,提示甲亢患者成骨细胞活性指标和破骨细胞功能指标升高的同时,也将造成患者各部位骨密度的下降,说明甲亢患者出现高转换型骨代谢紊乱,这一过程引起骨量的丢失。
综上所述,甲亢患者多个部位的骨密度出现下降,并可导致血清骨代谢相关指标明显升高,且骨密度与骨代谢指标呈负相关。因此,动态观察甲亢患者血清骨代谢指标有助于临床早期发现甲亢所致的骨质疏松。
[1] Gogakos AI, Duncan BJ, Williams GR. Thyroid and bone[J]. Arch Biochem Biophys, 2010,503(1):129-136.
[2] 姜海红,刁迎斌,赵宏,等. Graves病患者甲状腺激素与骨密度及骨转换指标的相关性[J]. 中国骨质疏松杂志,2010,16(7):480-482.
[3] Gorka J, Taylor-Gjevre RM, Arnason T. Metabolic and clinical consequences of hyperthyroidism on bone density[J]. Int J Endocrinol, 2013,2013:1-11.
[4] Emkey GR, Epstein S. Secondary osteoporosis: pathophysiology & diagnosis[J]. Best Pract Res Clin Endocrinol Metab, 2014,28(6):911-935.
[5] Ross DS, Burch HB, Cooper DS, et al. 2016 American thyroid association guidelines for diagnosis and management of hyperthyroidism and other causes of thyrotoxicosis[J]. Thyroid, 2016,26(10):1343-1421.
[6] Biswas D, Dutta D, Maisnam I, et al. Occurrence of osteoporosis & factors determining bone mineral loss in young adults with Graves′ disease[J]. Indian J Med Res, 2015,141(3):322-329.
[7] 张杨文,翁建盛. 甲亢患者骨密度与骨代谢生化指标的临床观察[J]. 现代诊断与治疗,2015,26(2):416-417.
[8] Yoshihara A, Yoshimura NJ, Mukasa K, et al. The characteristics of osteoporotic patients in Graves′ disease patients newly diagnosed after menopause: a prospective observational study[J]. Endocr J, 2016,63(12):1113-1122.
[9] Roux C, Briot K. Current role for bone absorptiometry[J]. Joint Bone Spine, 2017,84(1):35-37.
[10] Vasikaran S, Cooper C, Eastell R, et al. International osteoporosis foundation and international federation of clinical chemistry and laboratory medicine position on bone marker standards in osteoporosis[J]. Clin Chem Lab Med, 2011,49(8):1271-1274.
[11] Koivula MK, Risteli L, Risteli J. Measurement of aminoterminal propeptide of type Ⅰ procollagen (PⅠNP) in serum[J]. Clin Biochem, 2012,45(12):920-927.
[12] Bunyaratavej N, Buranasinsup S. Study of validity of pyridinoline and correlation of pyridinoline and beta crosslap in postmenopausal women[J]. J Med Assoc Thai, 2011,94(Suppl5):76-78.
[13] Wheater G, Elshahaly M, Tuck SP, et al. The clinical utility of bone marker measurements in osteoporosis[J]. J Transl Med, 2013,11:201.
[14] 温宇明,张伟康,李端昌. 甲状腺功能亢进症278例骨代谢分析[J]. 岭南急诊医学杂志,2013,22(1):33-35.
樊有龙(E-mail: fyl7375@163.com)
10.3969/j.issn.1002-266X.2017.30.013
R581.1
B
1002-266X(2017)30-0045-03
2017-04-17)

