姜黄素减轻氧化型低密度脂蛋白诱导的人主动脉内皮细胞损伤*
胡 勇, 苏晓红, 朱火兰, 张凌霄, 刘 飞, 刘仲伟△
(1黄陵县人民医院心血管内科, 陕西 黄陵 727300; 2陕西省人民医院心血管内科, 3西安医学院临床医学系, 4西安交通大学附属口腔医院, 陕西 西安 710000)
姜黄素减轻氧化型低密度脂蛋白诱导的人主动脉内皮细胞损伤*
胡 勇1, 苏晓红1, 朱火兰2, 张凌霄3, 刘 飞4, 刘仲伟2△
(1黄陵县人民医院心血管内科, 陕西 黄陵 727300;2陕西省人民医院心血管内科,3西安医学院临床医学系,4西安交通大学附属口腔医院, 陕西 西安 710000)
目的: 观察姜黄素对氧化型低密度脂蛋白(ox-LDL)诱导的人主动脉内皮细胞(HAECs)损伤的作用及分子机制。方法: 以不同浓度姜黄素预处理体外培养的HAECs,再以ox-LDL对细胞进行干预。MTT法和EdU法评估细胞增殖能力;ELISA法对培养液中白细胞介素-6(IL-6)、转化生长因子β1(TGFβ1)、高迁移率族蛋白1(HMGB1)以及分泌型晚期糖基化终产物受体(sRAGE)浓度进行检测;凝胶电泳迁移率实验(EMSA)评估过氧化物酶体增殖物激活受体γ(PPARγ)的结合活性;Western blot 法检测HAECs中磷酸化PPARγ、血红素氧合酶-1(HO-1)、HMGB1、IL-6、TGFβ1和RAGE的表达水平。结果: ox-LDL处理的HAECs细胞活力和增殖能力下降,细胞内PPARγ/HO-1信号被抑制,其下游HMGB1/RAGE炎症通路被激活,细胞分泌的IL-6、TGFβ1、HMGB1以及sRAGE浓度显著增加。不同浓度姜黄素预处理可激活ox-LDL诱导的HAECs内PPARγ/HO-1信号通路,从而抑制下游HMGB1/RAGE炎症通路,降低IL-6、TGFβ1、HMGB1以及sRAGE炎症因子水平。结论: ox-LDL能够通过抑制PPARγ/HO-1而激活HMGB1/RAGE炎症通路造成HAECs损伤。姜黄素则能够通过活化PPARγ/HO-1通路抑制炎症反应,减轻ox-LDL对HAECs的损伤。
姜黄素; 人主动脉内皮细胞; 氧化型低密度脂蛋白; 过氧化物酶体增殖物激活受体γ
动脉粥样硬化(atherosclerosis,AS)是动脉系统的常见病之一,其发病机制复杂。动脉血管内皮细胞损伤在AS的发生发展过程中扮演重要的角色,如改变血流动力学、调控血管张力、诱发局部血小板凝聚及血栓形成等[1]。既往研究表明,机体内过度产生的氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)导致的炎症反应是内皮细胞损伤及死亡的重要原因[2]。高迁移率族蛋白1(high mobility group box-1 protein,HMGB1)被认为是重要的炎症介导因子。在正常生理状态下,HMGB1存在于细胞核中。在病理因素刺激下,HMGB1从细胞核中释放,与其重要的受体——晚期糖基化终产物受体(receptor for advanced glycation end-products,RAGE)相结合构成HMGB1/RAGE通路[3]。该信号通路活化后可诱导多种炎症因子,如白细胞介素(interleukin,IL)及转化生长因子(transforming growth factor,TGF)合成及分泌,从而诱发炎症反应,导致细胞凋亡[4]。过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)信号通路的激活对炎症反应有抑制作用。PPARγ磷酸化是其激活的标志。近期的一项研究指出,PPARγ/血红素氧合酶-1(heme oxygenase-1,HO-1)信号通路激活能够抑制HMGB1/RAGE通路减弱炎症反应[5]。
中药姜黄,其味辛苦,大寒,无毒,入心、肺二经,能行气破瘀,通经止痛。研究表明,姜黄具有抗动脉粥样硬化的功效。姜黄素 (curcumin,Cur)属于二酮类化合物,是姜黄的重要组成成分,具有抗肿瘤、抗感染、抗增殖、免疫调节以及抗炎等药理活性。近期研究显示,姜黄素可通过调控PPARγ信号通路发挥改善代谢紊乱、抗氧化以及抗纤维化等作用[6-7]。因此,我们提出如下科学假说:姜黄素可通过影响PPARγ/HMGB1/RAGE信号通路活性抑制内皮细胞炎症反应。本研究以外源性ox-LDL处理人主动脉内皮细胞(human aortic endothelial cells,HAECs)诱导炎症反应,观察姜黄素对细胞内炎症反应的抑制作用并使用分子生物学手段阐明其可能分子机制,为姜黄素在抗动脉硬化的治疗方面提供理论基础。
材 料 和 方 法
1 细胞培养与处理
HAECs复苏后以2×108/L浓度接种于培养瓶中,以含10%胎牛血清(Hyclone)的RPMI-1640细胞培养基(Hyclone)在适宜环境(37 ℃、5% CO2以及饱和湿度)的细胞培养箱中进行培养。取2~4代处于对数生长期的HAECs进行后续研究。根据干预不同,将细胞分为5组:(1)空白对照(control,Ctrl)组:以无血清RPMI-1640培养基进行细胞培养;(2)ox-LDL处理组:以终浓度为150 mg/L的ox-LDL处理细胞24 h;(3)低浓度(10 μmol/L)姜黄素处理组(Cur 10组):先以终浓度为10 μmol/L的姜黄素对HAECs进行2 h干预,而后以终浓度为150 mg/L的ox-LDL处理细胞24 h;(4)中浓度(20 μmol/L)姜黄素处理组(Cur 20组):先以终浓度为20 μmol/L的姜黄素对HAECs进行2 h干预,而后以终浓度为150 mg/L的ox-LDL处理细胞24 h;(5)高浓度(40 μmol/L)姜黄素处理组(Cur 40组):先以终浓度为40 μmol/L的姜黄素对HAECs进行2 h干预,而后以终浓度为150 mg/L的ox-LDL处理细胞24 h。
2 方法
2.1 细胞活力的检测 采用四氮噻唑蓝(MTT)法对细胞活力进行检测。取处于对数生长期的细胞接种于96孔细胞培养板,分别给予ox-LDL和/或姜黄素处理,分别在姜黄素处理12 h、24 h及48 h取样,各组设6个复孔,置于细胞培养箱中培养后,每孔分别加入20 μL终浓度为5 g/L的MTT溶液(Sigma)后继续培养4 h。弃去每孔液体后,加入150 μL DMSO溶液(Sigma)充分振荡。使用酶标仪(Bio-Rad)在570 nm读取每孔的吸光度(A)。按照如下公式计算细胞活力抑制率:细胞活力抑制率(%)=(1-干预组A值/对照组A值)×100%。
2.2 细胞增殖能力的检测 采用EdU荧光染色法对细胞增殖能力进行检测。在细胞培养基中加入终浓度为10 μmol/L的EdU(Invitrogen),继续培养2.5 h。经过4%多聚甲醛固定和0.5% Triton X-100穿透处理后,避光条件下加入Apollo染色反应液(Invitrogen)。最后以DAPI对细胞核进行染色。以荧光显微镜观察,随机选取5个视野,分别计数EdU阳性细胞数及细胞总数,以两者比值表示细胞增殖能力。
2.3 细胞培养液炎症因子测定 各组细胞离心后,获得的培养液经过Centricon-YM10浓缩柱(Millipore)浓缩后,分别使用HMGB1 ELISA试剂盒(R&D)、分泌型RAGE(sRAGE) ELISA试剂盒(R&D)、IL-6 ELISA试剂盒(Invitrogen)以及TGFβ1试剂盒(Invitrogen)测定细胞培养液中HMGB1、sRAGE、IL-6以及TGFβ1的浓度。操作均按照产品说明书进行。
2.4 凝胶电泳迁移率实验(electrophoretic mobility shift assay,EMSA)测定PPARγ结合活性 各组细胞离心后弃去上清,收集细胞,分别使用细胞浆蛋白抽提试剂盒及细胞核蛋白抽提试剂盒获得相应蛋白样本,使用增强型BCA蛋白浓度试剂盒对提取的蛋白浓度进行检测。过氧化物酶体增殖物反应元件(PPRE)的寡核苷酸探针序列为5’-CAAACTAGGTCAAAGGTCA-3’。将2 μL以[32P]-ATP标记的探针、4 μg提取的核蛋白以及4 μL EMSA/Gel-shift binding buffer加无核酶水调整至总反应体积18 μL,室温下孵育20 min后加入5%聚丙烯酰胺凝胶中,在EMSA/Gel-shift running buffer中以100 V电压进行电泳,直至溴酚蓝到达凝胶底部。取出凝胶进行放射自显影,以X线胶片曝光后进行分析。
2.5 Western blot实验 使用上述2.4中获得的蛋白样本进行检测。将样本加入上样缓冲液,在沸水中变性后,以聚丙烯酰胺凝胶电泳分离,再电转印至NC膜或PVDF膜,5%脱脂牛奶封闭1 h。分别以抗PPARγ抗体、抗磷酸化PPARγ抗体、抗RAGE抗体、抗GAPDH抗体、抗histone H1抗体(Abcam)、抗HMGB1抗体、抗HO-1抗体(Invitrogen)、抗IL-6抗体(Santa Cruz)和抗TGFβ1抗体(Sigma),在4 ℃下孵育样本8 h,用TBST洗涤后,用相应辣根过氧化物酶标记的 II 抗在室温孵育1 h。洗涤后采用ECL发光液(Thermo)处理,最后在X线胶片上曝光、分析。
3 统计学处理
使用统计学软件SPSS 16.0进行统计学分析。本研究所得数据均采用均数±标准差(mean±SD)表示,组间差异比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 姜黄素预处理能够显著增加ox-LDL处理的HAECs的活力
MTT检测结果如图1所示,与对照组相比,经ox-LDL处理后,HAECs的细胞活力抑制率显著增加,差异有统计学意义(P<0.05)。不同浓度的姜黄素(10、20、40 μmol/L)预处理12 h、24 h及48 h均能够降低ox-LDL对HAECs细胞活力的抑制作用,且呈现浓度依赖性,均具有统计学意义(P<0.05)。
2 姜黄素预处理能够显著增加ox-LDL处理的HAECs的增殖能力
EdU荧光染色如图2所示,与对照组相比,经ox-LDL处理后,HAECs的增殖能力显著下降,差异具有统计学意义(P<0.05)。不同浓度的姜黄素(10、20、40 μmol/L)预处理均能提高ox-LDL处理的HAECs的增殖能力,且呈现显著的浓度依赖性(P<0.05)。
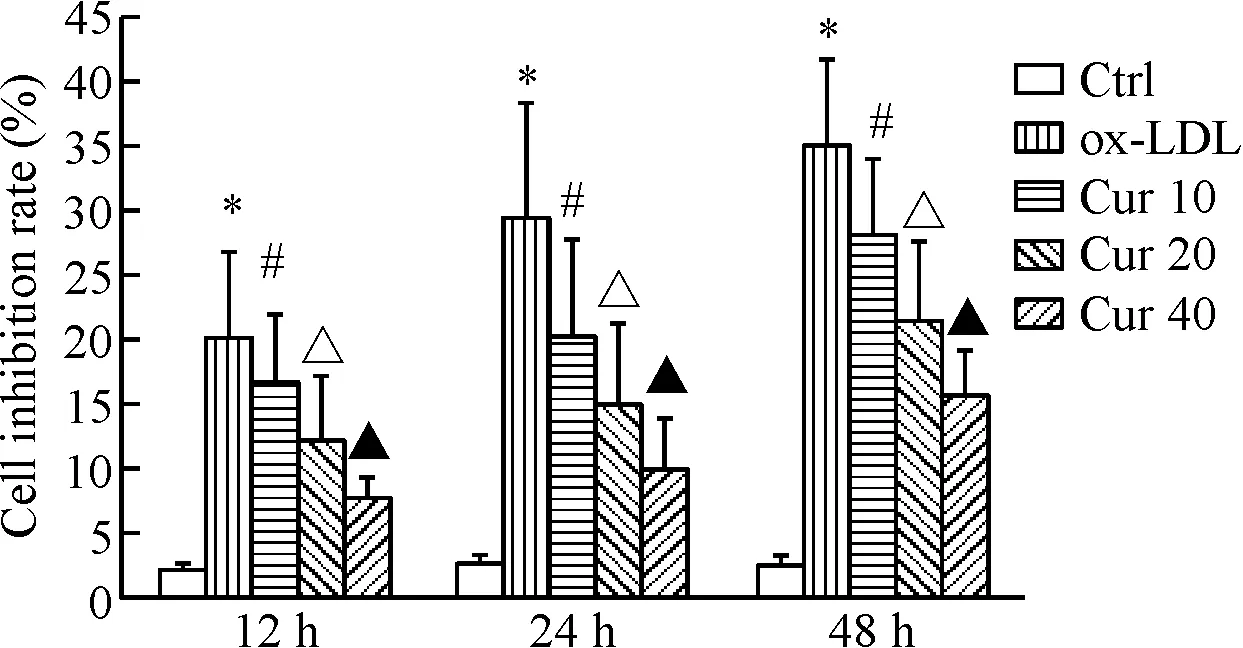
Figure 1.The effect of curcumin (Cur) on the viability of ox-LDL-induced HAECs. Mean±SD.n=3.*P<0.05vsCtrl group;#P<0.05vsox-LDL group;△P<0.05vsCur 10 group;▲P<0.05vsCur 20 group.
图1 不同浓度姜黄素对ox-LDL处理的HAECs细胞活力的影响
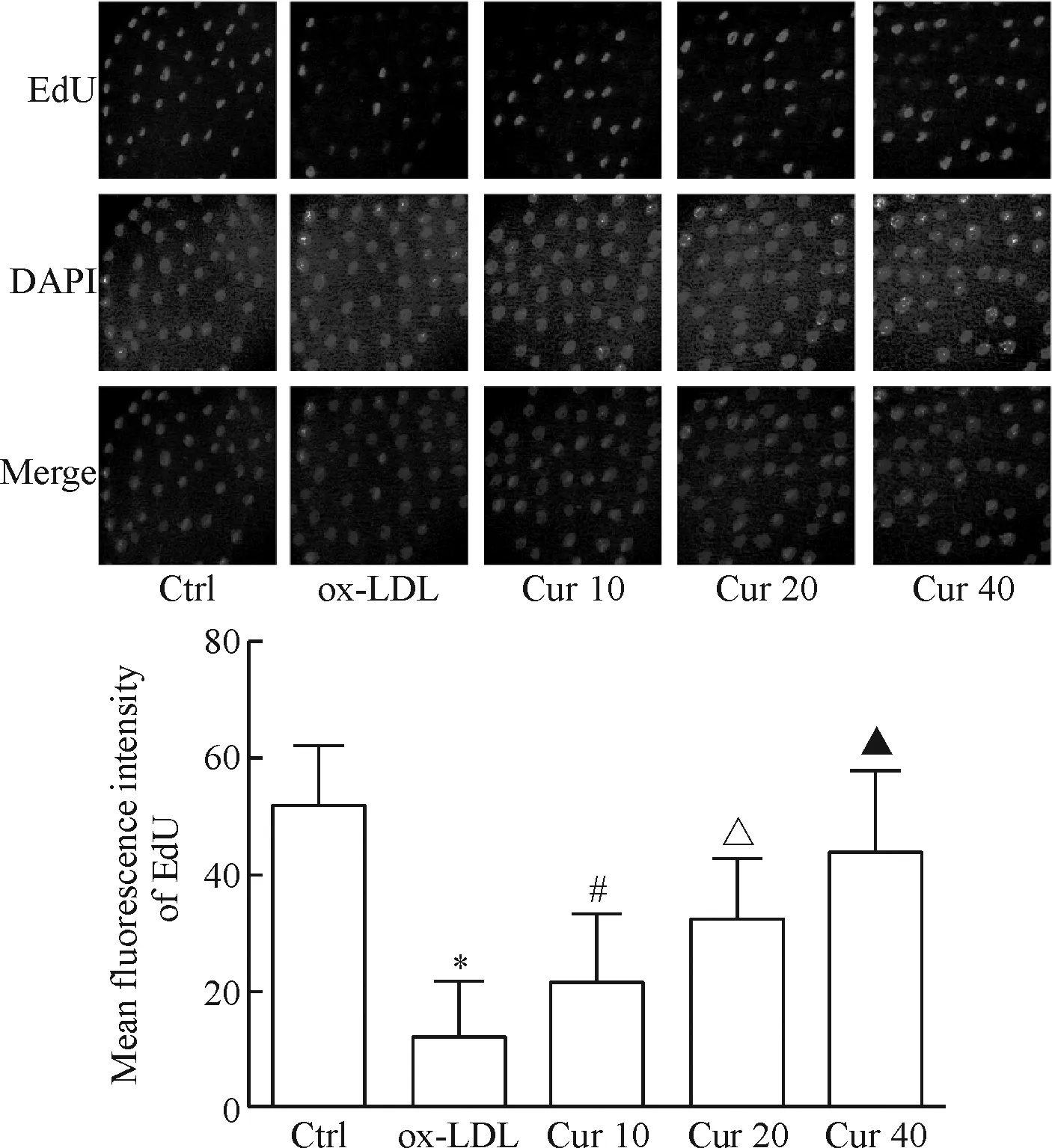
Figure 2.The effect of curcumin (Cur) on the proliferation of ox-LDL-induced HAECs were measured by EdU assay. Mean±SD.n=3.*P<0.05vsCtrl group;#P<0.05vsox-LDL group;△P<0.05vsCur 10 group;▲P<0.05vsCur 20 group.
图2 EdU实验检测不同浓度姜黄素对ox-LDL诱导的HAECs细胞增殖能力的影响
3 姜黄素预处理显著降低ox-LDL处理的HAECs培养液中炎症因子水平
ELISA法检测HAECs细胞培养液中炎症因子水平的结果如图3所示。与对照组相比,接受ox-LDL处理的HAECs细胞培养液中HMGB1、sRAGE、IL-6及TGFβ1水平均显著升高,差异具有统计学意义(P<0.05)。不同浓度姜黄素(10、20和40 μmol/L)预处理能够显著降低ox-LDL处理的HAECs细胞培养液中HMGB1、sRAGE、IL-6及TGFβ1浓度,呈现出浓度依赖性,且差异均具有统计学意义(P<0.05)。

Figure 3.The effect of curcumin (Cur) on inflammatory factors in the cell culture medium of the ox-LDL-induced HAECs. Mean±SD.n=3.*P<0.05vsCtrl group;#P<0.05vsox-LDL group;△P<0.05vsCur 10 group;▲P<0.05vsCur 20 group.
图3 姜黄素对ox-LDL处理的HAECs培养液中炎症因子水平的影响
4 姜黄素预处理显著提高ox-LDL处理的HAECs内PPARγ活性
ox-LDL处理的HAECs细胞核内PPARγ磷酸化水平显著降低,提示PPARγ信号通路活性被抑制;EMSA结果表明PPARγ与DNA的结合能力显著下降,与对照组相比差异均具有统计学意义(P<0.05)。采用不同浓度姜黄素(10、20、40 μmol/L)预处理不仅能够显著提高ox-LDL处理的HAECs细胞核内PPARγ的磷酸化水平,还能够提高PPARγ与DNA的结合能力,呈现出显著的浓度依赖性,且差异均具有统计学意义(P<0.05),见图4、5。

Figure 4.The effect of curcumin (Cur) on the binding activity of PPARγ to PPRE in the ox-LDL-induced HAECs. The optical densities of the EMSA electrophoretic bands in each lane were determined. NS: non-specific electrophoretic band; Cold: cold probes. Mean±SD.n=3.*P<0.05vsCtrl group;#P<0.05vsox-LDL group;△P<0.05vsCur 10 group;▲P<0.05vsCur 20 group.
图4 姜黄素对ox-LDL处理的HAECs内PPARγ与PPRE结合能力的影响
5 姜黄素预处理能够激活ox-LDL处理的HAECs内PPARγ下游HO-1信号通路,抑制HMGB1/RAGE炎症通路信号活化
在以ox-LDL处理的HAECs中,HO-1表达水平显著下降,同时HMGB1和RAGE水平显著升高,提示ox-LDL能够使HMGB1/RAGE炎症通路激活。此外,HAECs内炎症细胞因子IL-6及TGFβ1表达水平显著升高(P<0.05)。然而,在不同浓度姜黄素(10、20和40 μmol/L)预处理的HAECs中,HO-1表达水平显著升高,同时HMGB1和RAGE表达水平被明显抑制,且细胞内IL-6及TGF-β1的表达水平显著降低(P<0.05),呈现浓度依赖性,表明姜黄素能够抑制PPARγ下游的HMGB1/RAGE炎症信号通路的活化,见图6。
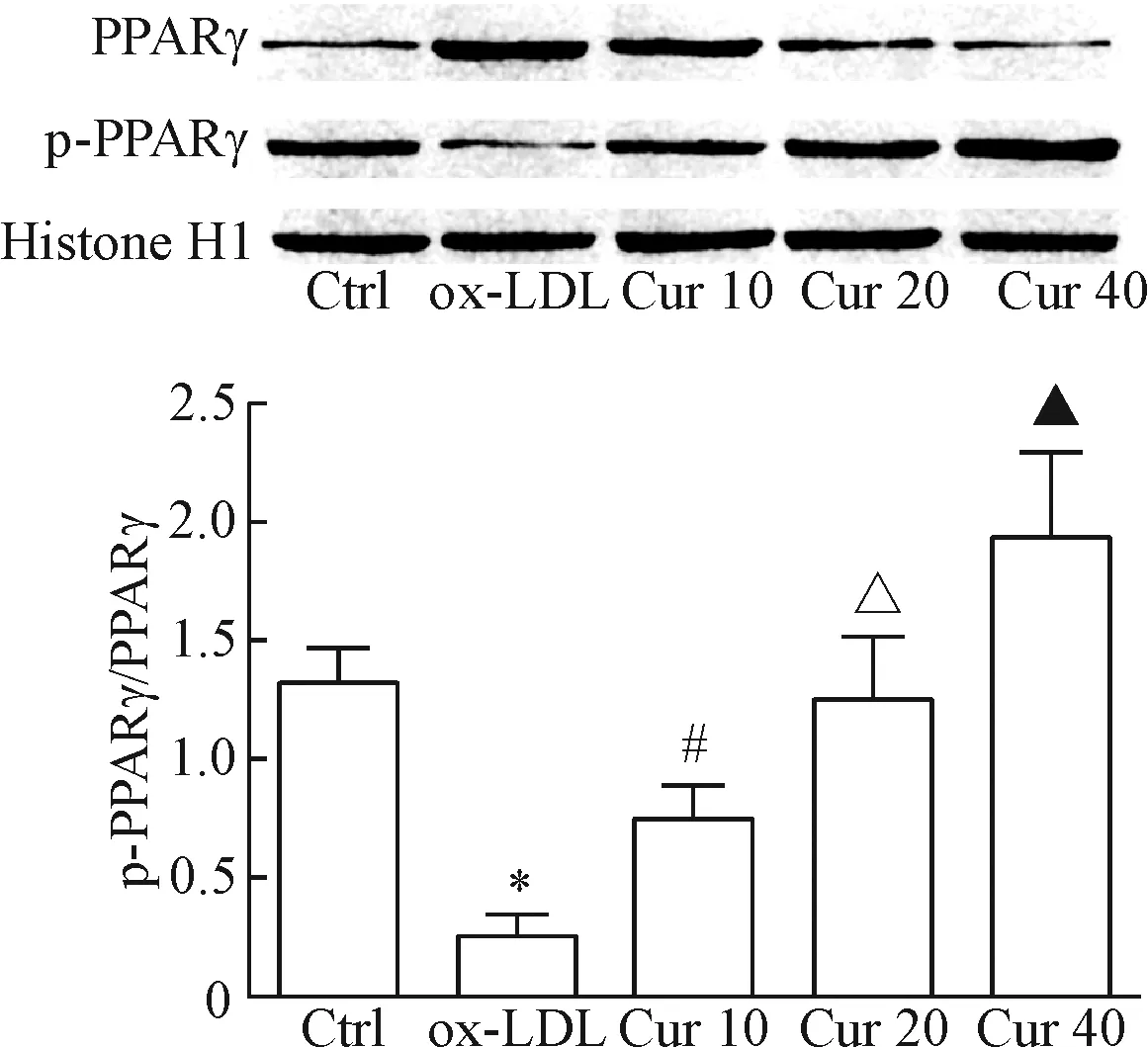
Figure 5.The effect of curcumin (Cur) on the phosphorylation of PPARγ in the ox-LDL-induced HAECs were determined by Western blot. Histone H1 was used as the internal control. TheAratio of p-PPARγ/PPARγ was calculated. Mean±SD.n=3.*P<0.05vsCtrl group;#P<0.05vsox-LDL group;△P<0.05vsCur 10 group;▲P<0.05vsCur 20 group.
图5 姜黄素对ox-LDL处理的HAECs内PPARγ磷酸化的影响
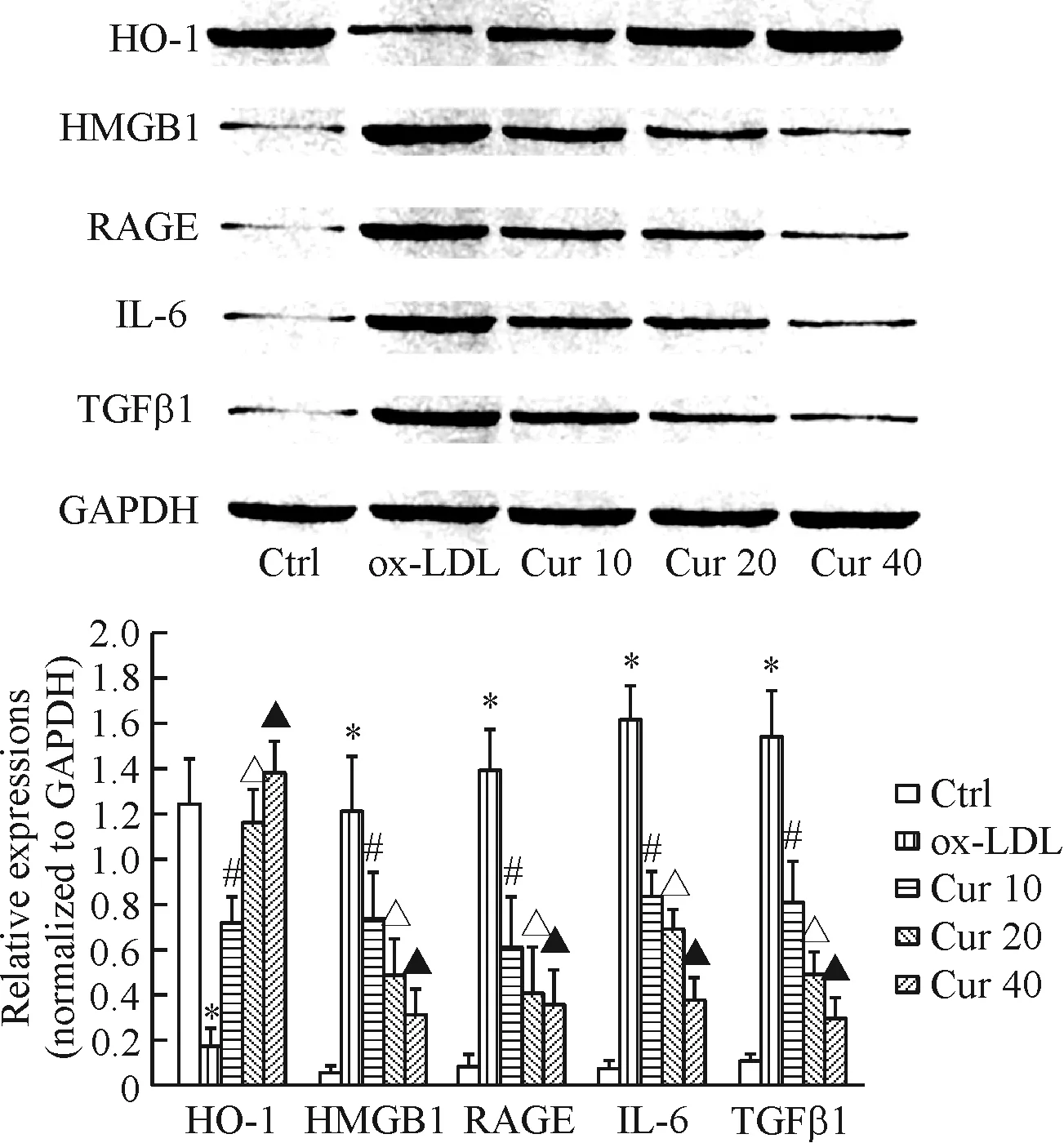
Figure 6.The effect of curcumin (Cur) on the protein levels of HO-1, RAGE, HMGB1, IL-6 and TGFβ1 in the ox-LDL-induced HAECs determined by Western blot. GAPDH was used as the internal control. Mean±SD.n=3.*P<0.05vsCtrl group;#P<0.05vsox-LDL group;△P<0.05vsCur 10 group;▲P<0.05vsCur 20 group.
图6 Western blot检测姜黄素对ox-LDL处理的HAECs内HO-1、RAGE、HMGB1、IL-6以及TGFβ1表达的影响
讨 论
ox-LDL由LDL氧化修饰而来,是AS的重要致病因子,募集单核-巨噬细胞、参与形成泡沫细胞及脂质条纹、诱发及促进炎症反应以及介导内皮细胞损伤。血管内皮功能障碍及损伤既是AS发生的始动因素,又是AS发展的促进因素[8]。过度产生的ox-LDL可诱导内皮细胞出现炎症反应,导致内皮细胞出现损伤,从而促进AS的形成。本研究中,我们发现ox-LDL处理导致HAECs内及培养液中炎症因子水平、细胞抑制率显著升高,细胞增殖能力显著下降,表现出对细胞的毒性作用。
一些研究提出了通过干预HMGB1/RAGE信号通路来抑制炎症反应的策略[9]。在Wang等[5]的一项近期研究中,PPARγ激动剂罗格列酮能够显著抑制HMGB1/RAGE信号的激活。使用HMGB1特异性抗体能够抑制实验动物体内的炎症反应[10];RAGE基因沉默动物也对病理应激表现出较弱的炎症反应[11]。进一步的研究表明,HMGB1/RAGE信号通路受到其上游分子HO-1的调控[12]。以上分子共同组成PPARγ/HO-1/HMGB1/RAGE信号通路。本研究发现,ox-LDL处理可使 HAECs细胞内HMGB1/RAGE信号通路显著活化,而使炎症因子浓度明显升高,造成HAECs损伤。
PPARs是核激素受体家族中的配体激活受体,目前共发现3种亚型,生物功能复杂,参与调控多种生理及病理过程。PPARs被激活后,可与视黄醇类X受体结合并形成二聚体,进而通过与PPRE的结合,调控靶基因的转录活性,产生众多生物学效应[13]。PPARγ以磷酸化的方式被激活。HO-1是PPARγ下游的重要靶基因,组成PPARγ/HO-1信号通路,其激活后在心血管系统中具有抗氧化以及抗炎等活性。本研究发现,ox-LDL作用后,HAECs内PPARγ的磷酸化水平及与PPRE的结合能力显著降低,HO-1表达水平下调,表明ox-LDL可通过降低PPARγ/HO-1信号通路的活性诱发HAECs的炎症反应而造成细胞损伤。以上结果表明,ox-LDL对HAECs造成的细胞损伤与PPARγ/HO-1/HMGB1/RAGE信号通路有关,其中对PPARγ/HO-1信号的抑制导致了下游HMGB1/RAGE信号的活化,从而导致细胞炎症反应的加剧。
姜黄素是提取自植物姜黄中有效中药单体,即[1,7-二(4-羟基-3甲氧基)苯基-1,6-庚二烯-3,5-二酮],其生物安全性得到了包括美国药品食品管理局等权威机构的认证[14]。姜黄素为脂溶性的二酮类化合物,其独特的β-二酮及酮-烯-醇结构使其具有抗氧化以及与多肽分子相互作用的药理学活性。姜黄素在纤维化、脂肪细胞分化以及胰岛素抵抗等多种病理生理过程中具有激活PPARγ信号的作用[15-17]。本研究发现,使用姜黄素能够减轻ox-LDL诱导的HAECs细胞炎症反应。我们的进一步研究发现,姜黄素处理能够提高PPARγ的活性,表现为对PPARγ磷酸化的促进作用及对PPARγ与PPRE结合能力的显著提高。这一作用能够使PPARγ的下游靶分子HO-1表达显著上调,进而抑制炎症通路HMGB1/RAGE信号活化,最终起到抑制HAECs中炎症反应作用。
总之,通过本研究结果可知,姜黄素可通过影响PPARγ/HO-1/HMGB1/RAGE信号通路活性抑制ox-LDL诱导的HAECs中的炎症反应,对细胞起保护作用。PPARγ是姜黄素的作用靶点之一。动脉粥样硬化内皮细胞损伤的发病机制复杂,目前临床常用药物的保护及逆转作用并不十分理想。寻找新的、安全可靠的有效药物具有很大的临床价值。本研究结果提示姜黄素在动脉粥样硬化的预防及治疗中具有很大应用潜力,为其临床应用提供了新理论基础。
[1] Gao W, Liu H, Yuan J, et al. Exosomes derived from mature dendritic cells increase endothelial inflammation and atherosclerosis via membrane TNF-α mediated NF-κB pathway[J]. J Cell Mol Med, 2016, 12(10):2318-2327.
[2] Wei DH, Jia XY, Liu YH, et al.CathepsinLstimulates autophagy and inhibits apoptosis of ox-LDL-induced endothelial cells: potential role in atherosclerosis[J]. Int J Mol Med, 2013, 31(2):400-406.
[3] Jhun J, Lee S, Kim H, et al. HMGB1/RAGE induces IL-17 expression to exaggerate inflammation in peripheral blood cells of hepatitis B patients[J]. J Transl Med, 2015, 13:310.
[4] LeBlanc PM, Doggett TA, Choi J, et al. An immunogenic peptide in the A-box of HMGB1 protein reverses apoptosis-induced tolerance through RAGE receptor[J]. J Biol Chem, 2014, 289(11):7777-7786.
[5] Wang G, Liu L, Zhang Y, et al. Activation of PPARgamma attenuates LPS-induced acute lung injury by inhibition of HMGB1-RAGE levels[J]. Eur J Pharmacol, 2014, 726(5):27-32.
[6] Jaroonwitchawan T, Chaicharoenaudomrung N, Namkaew J, et al. Curcumin attenuates paraquat-induced cell death in human neuroblastoma cells through modulating oxidative stress and autophagy[J]. Neurosci Lett, 2016, 25(16):30805-30809.
[7] Lim W, Jeong M, Bazer FW, et al. Curcumin suppresses proliferation and migration and induces apoptosis on human placental choriocarcinoma cells via ERK1/2 and SAPK/JNK MAPK signaling pathways[J]. Biol Reprod, 2016, 95(4):83.
[8] Yuan X, Chen J, Dai M. Paeonol promotes microRNA-126 expression to inhibit monocyte adhesion to ox-LDL-injured vascular endothelial cells and block the activation of the PI3K/Akt/NF-kappa B pathway[J]. Int J Mol Med, 2016, 38(6):1871-1878.
[9] Gangemi S, Casciaro M, Trapani G, et al. Association between HMGB1 and COPD: a systematic review[J]. Mediators Inflamm, 2015, 2015: 164913.
[10]Gong Q, Xu JF, Yin H, et al. Protective effect of antagonist of high-mobility group box 1 on lipopolysaccharide-induced acute lung injury in mice[J]. Scand J Immunol, 2009, 69(1):29-35.
[11]Sims GP, Rowe DC, Rietdijk ST, et al. HMGB1 and RAGE in inflammation and cancer[J]. Annu Rev Immunol, 2010, 28:367-388.
[12]Kohno T, Anzai T, Naito K, et al. Role of high-mobility group box 1 protein in post-infarction healing process and left ventricular remodelling[J]. Cardiovasc Res, 2009, 81(3):565-573.
[13]Sheikh IA, Khweek AA, Beg MA. Peroxisome proliferator-activated receptors as potential targets for carcinogenic activity of polychlorinated biphenyls: a computational perspective[J]. Anticancer Res, 2016, 36(11):6117-6124.
[14]Deng YI, Verron E, Rohanizadeh R. Molecular mechanisms of anti-metastatic activity of curcumin[J]. Anticancer Res, 2016, 36(11):5639-5647.
[15]江振友, 岳 磊, 卢燕茹, 等. 姜黄素抑制小鼠矽肺纤维化[J]. 中国病理生理杂志, 2009, 25(5):976-979.
[16]Hu Y, Mou L, Yang F, et al. Curcumin attenuates cyclosporine A induced renal fibrosis by inhibiting hypermethylation of the klotho promoter[J]. Mol Med Rep, 2016, 14(4):3229-3236.
[17]Gu Q, Cai Y, Huang C, et al. Curcumin increases rat mesenchymal stem cell osteoblast differentiation but inhibits adipocyte differentiation[J]. Pharmacogn Mag, 2012, 8(31):202-208.
(责任编辑: 林白霜, 余小慧)
Effect of curcumin on ox-LDL-induced HAEC injury
HU Yong1, SU Xiao-hong1, ZHU Huo-lan2, Zhang Ling-xiao3, LIU Fei4, LIU Zhong-wei2
(1DepartmentofCardiology,HuanglingCountyPeople’sHospital,Huangling727300,China;2DepartmentofCardiology,ShanxiProvincialPeople’sHospital,3DepartmentofClinicalMedicine,Xi’anMedicalCollege,4DentalHospitalofXi’anJiaotongUniversity,Xi’an710000,China.E-mail:liuzhongwei@xjtu.edu.cn)
AIM: To investigate the effect of curcumin on oxidized low-density lipoprotein (ox-LDL)-induced injury of human aortic endothelial cells (HAECs). METHODS: HAECs were pre-treated with curcumin at different concentrations and then treated with ox-LDL. The cell viability was assessed by MTT assay. The cell proliferation ability was analyzed by EdU assay. ELISA was used to determine the concentrations of interleukin-6 (IL-6), transforming growth factor β1 (TGFβ1), high mobility group box-1 protein (HMGB1) and secretory receptor for advanced glycation end products (sRAGE) in the HAEC culture medium. The binding activity of peroxisome proliferator-activated receptor γ (PPARγ) was evaluated by electrophoretic mobility shift assay. The protein levels of HO-1, HMGB1, RAGE,IL-6,TGFβ1 and phosphorylated PPARγ in the HAECs were determined by Western blot. RESULTS: The viability and the proliferation ability decreased significantly in the HAECs treated with ox-LDL. The PPARγ/HO-1 signaling pathway was inhibited while its down-stream HMGB1/RAGE signaling pathway was activated by ox-LDL. The levels of IL-6, TGFβ1, HMGB1 and sRAGE were increased. Pre-treatment with curcumin activated PPARγ/HO-1 signaling pathway and inhibited HMGB1/RAGE signaling pathway in ox-LDL treated HAECs in a concentration-dependent manner. The levels of IL-6, TGFβ1, HMGB1 and sRAGE were also decreased dramatically by pre-treatment of curcumin in a concentration-dependent manner. CONCLUSION: ox-LDL induces HAEC damage by inhibiting PPARγ/HO-1 to activate HMGB1/RAGE inflammatory signaling. Curcumin exerts protective effect on ox-LDL treated HAECs via activating PPARγ/HO-1 signaling pathway.
Curcumin; Human aortic endothelial cells; Oxidized low-density lipoprotein; Peroxisome prolife-rator-activated receptor γ
1000- 4718(2017)08- 1359- 06
2016- 11- 28
2017- 04- 19
国家自然科学基金资助项目(No. 81600646)
R363.2+1; R965
A
10.3969/j.issn.1000- 4718.2017.08.003
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 029-85251331-3194; E-mail: liuzhongwei@xjtu.edu.cn

