茯苓多糖对系统性红斑狼疮患者Th17/Treg平衡的影响
王慧莲, 孟庆良, 李松伟, 王济华
(1河南省中医院风湿病科, 2河南中医药大学第一附属医院风湿病科, 河南 郑州 450000)
茯苓多糖对系统性红斑狼疮患者Th17/Treg平衡的影响
王慧莲1△, 孟庆良1, 李松伟2, 王济华2
(1河南省中医院风湿病科,2河南中医药大学第一附属医院风湿病科, 河南 郑州 450000)
目的: 研究茯苓多糖对系统性红斑狼疮(SLE)患者外周血辅助性T细胞17(Th17)/调节性T细胞(Treg)平衡的免疫调节作用。方法: 选取45例SLE患者和35例健康对照者,应用磁珠分选法分离外周血CD4+T细胞,流式细胞术检测CD4+T 细胞中Th17和Treg细胞的比例。用茯苓多糖分别处理健康对照者及患者的CD4+T 细胞,MTT法检测细胞活力以测定茯苓多糖毒性,ELISA检测细胞中白细胞介素17(IL-17)、IL-6、IL-10及转化生长因子β(TGF-β)的含量,RT-qPCR和Western blot法分别测定维甲酸相关孤儿受体γt(RORγt)与叉头框蛋白P3(Foxp3)的mRNA和蛋白表达水平。结果: 与健康对照组相比,SLE患者的Th17细胞比例显著升高,Treg细胞比例明显降低(P<0.05)。用100 μg/L的茯苓多糖处理SLE患者CD4+T 细胞,与空白对照组相比,IL-17和IL-6的含量显著降低,IL-10 和TGF-β的含量明显上升(P<0.05);RORγt的mRNA和蛋白表达显著下降,同时Foxp3的表达在mRNA和蛋白水平上明显增加(P<0.05);并且Th17/Treg的比值降低(P<0.05)。结论: 茯苓多糖可以通过升高Treg并降低Th17细胞的比例,对SLE起到一定的治疗作用。
系统性红斑狼疮; 辅助性T细胞17; 调节性T细胞; 茯苓多糖
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种临床常见的多因素多环境影响的自身免疫疾病[1]。SLE的特征为机体对自身的抗原免疫耐受出现缺失,导致多种自身抗体的产生以及T、B淋巴细胞的异常活化和增殖,其中辅助性T细胞的功能异常在SLE的发病中起到重要作用[2]。辅助性T细胞17(T helper 17 cells, Th17)和调节性T细胞(regulator T cells,Treg)的功能絮乱可导致多种免疫相关疾病的发生。有报道表明,在SLE的发病进程中观察到明显的Th17/Treg平衡失调,提示Th17/Treg可能影响SLE的发生和发展[3]。茯苓多糖(pachyman polysaccharides,PPS)是中药茯苓(Poriacocos)的主要活性成分,具有抗肿瘤、保肝、免疫调节等多种生物活性作用[4]。最新报道表明茯苓可以在炎性疾病中激活T细胞向Treg分化,调节机体的免疫失衡[5-6]。目前关于茯苓多糖在系统性红斑狼疮中的作用尚少见文献报道。因此,本实验从体外实验出发,观察茯苓多糖对SLE患者外周血Th17和Treg细胞的影响,初步探讨茯苓对SLE的免疫调节作用及其作用机制。
材 料 和 方 法
1 材料
1.1 研究对象 选取2010~2015年在河南省中医院风湿科就诊的系统性红斑狼疮患者45例,其中男23例,女22例,年龄22~50岁。SLE诊断符合由美国风湿学会修订的分类标准。健康对照35例,选自本院健康献血者,男18例,女17例,年龄20~50岁。SLE患者与健康对照之间性别、年龄差异无统计学显著性,具有可比性。本研究获得河南省中医院伦理委员会批准,所有参与人经过知情同意后获得其外周血标本。
1.2 主要试剂 AIM-V Medium CTS培养基购于Gibco; CD4+T细胞分选试剂盒购于Miltenyi;流式检测试剂盒购于eBioScience;茯苓多糖购于宁波德康生物制品有限公司;人白细胞介素17(interleukin-17,IL-17)、IL-6、IL-10和转化生长因子β(transforming growth factor,TGF-β) ELISA 试剂盒购自R&D Systems;抗维甲酸相关孤儿受体γt(retinoid-related orphan receptor γt,RORγt)、叉头框蛋白P3(forkhead box protein P3,Foxp3)和β-actin的 I 抗,以及HRP标记的II 抗购于Santa Cruz Biotechnology。
2 方法
2.1 标本采集 在清晨空腹状态下采集静脉血10 mL,放置于肝素钠抗凝管中。按照试剂盒说明,用免疫磁珠法分离出外周血中的CD4+T细胞,并用流式细胞术检测 CD4+T细胞的纯度在90%以上。分离出的CD4+T细胞中加入AIM-V Medium CTS培养基放置于37 ℃、5% CO2培养箱中培养。
2.2 流式细胞术检测Th17与Treg细胞 流式细胞术检测外周血分离出的CD4+T细胞中Th17与Treg细胞的比例。在分离出的CD4+T细胞中分别加入表面染色FITC-IL-17或FITC-IL-10,细胞固定、破膜后,加入染色PE-RORγt或PE-Foxp3,4 ℃孵育30 min,PBS洗涤3次,并将细胞悬浮于PBS中,通过流式细胞仪检测Th17和Treg细胞的比例。
2.3 细胞处理及分组 分离出的CD4+T 细胞中分别加入浓度为10、100、500、1 000 μg/L的PPS培养72 h,不加PPS处理的CD4+T细胞为对照组。
2.4 MTT法检测细胞活力 在待测细胞中加入5 g/L的MTT溶液,置于37 ℃恒温箱中孵育4 h。上清吸弃后,加入二甲基亚砜(dimethyl sulfoxide, DMSO),震荡15 min使蓝色结晶充分溶解,用酶标仪读取在490 nm处的吸光度(optical density,A)。
2.5 ELISA实验 使用ELISA检测IL-17、IL-6、IL-10和TGF-β的含量。详细步骤按照ELISA试剂合说明书进行。反应完成后,结果使用酶标仪检测波长450 nm处的A值,并根据标准品的浓度及对应A值计算出样品浓度。
2.6 RT-qPCR检测mRNA的表达 待测细胞用Trizol法提取总RNA,测定RNA的浓度及纯度,逆转录后提取cDNA,PCR扩增RORγt和Foxp3。 RORγt 上游引物: 5’-CCTGGGCTCCTCGCCTGACC-3’;下游引物:5’-TCTCTCTGCCCTCAGCCTTGCC-3’。Foxp3上游引物:5’-GCTGGTCGGGAGAAGAGGAAAA-3’;下游引物:5’-CAGTATCCCACGGAAATAACC-3’。扩增条件为: 95 ℃ 5 min; 95 ℃ 1 min, 64 ℃ 1 min, 72 ℃ 1 min, 30个循环; 72 ℃ 10 min。取5 μL扩增产物行琼脂糖凝胶电泳,自动凝胶成像分析仪分析。
2.7 Western blot实验 待测细胞中加入0.05%胰蛋白酶消化3 min,用PBS洗涤3次。加入65 μL的细胞蛋白裂解液RIPA裂解细胞,提取总蛋白,随后使用BCA试剂盒测定蛋白浓度。SDS-PAGE分离蛋白。电泳结束后,进行电转膜,接着用5%脱脂奶粉在室温下摇晃封闭60 min。加入RORγt、Foxp3和β-actin的抗体,4 ℃过夜。PBS洗涤3次后,加入HRP标记的II 抗,室温摇晃孵育120 min。结果用X线胶片曝光分析,Image-Pro Plus软件处理。蛋白的相对表达量用目的蛋白与内参照的灰度值比值表示。
3 统计学处理
所有计量资料数据以平均数±标准差(mean±SD)表示,采用GraphPad Prism 5统计软件进行t检验及单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 SLE患者外周血中Th17细胞水平升高,Treg水平降低
用磁珠分选出SLE患者和健康对照者外周血中的CD4+T细胞,并用流式细胞仪检测CD4+T细胞中Th17与Treg的比例。结果如图1所示,与健康对照组相比,SLE患者外周血中的Th17细胞比例明显升高,Treg细胞的比例显著下降,同时Th17/Treg显著升高。

Figure 1.The Th17 and Treg cells from the SLE patients or healthy controls. Mean±SD.n=3.*P<0.05vshealthy control group.
图1 SLE患者与健康对照外周血中的Th17和Treg细胞
2 PPS毒性筛选实验
磁珠分选出SLE病患和健康对照的外周血CD4+T细胞,分别用不同浓度的PPS处理72 h,MTT检测细胞的活力。如图2所示,与未加入药物处理的对照组相比,CD4+T细胞在10、100和500 μg/L的PPS处理下,细胞活力没有发生明显改变。当药物浓度增大后,细胞活力显著降低(P<0.05),说明浓度大于1 000 μg/L的PPS对CD4+T细胞有毒性作用。因此本实验选择没有毒性作用的500 μg/L作为PPS的药物处理浓度。
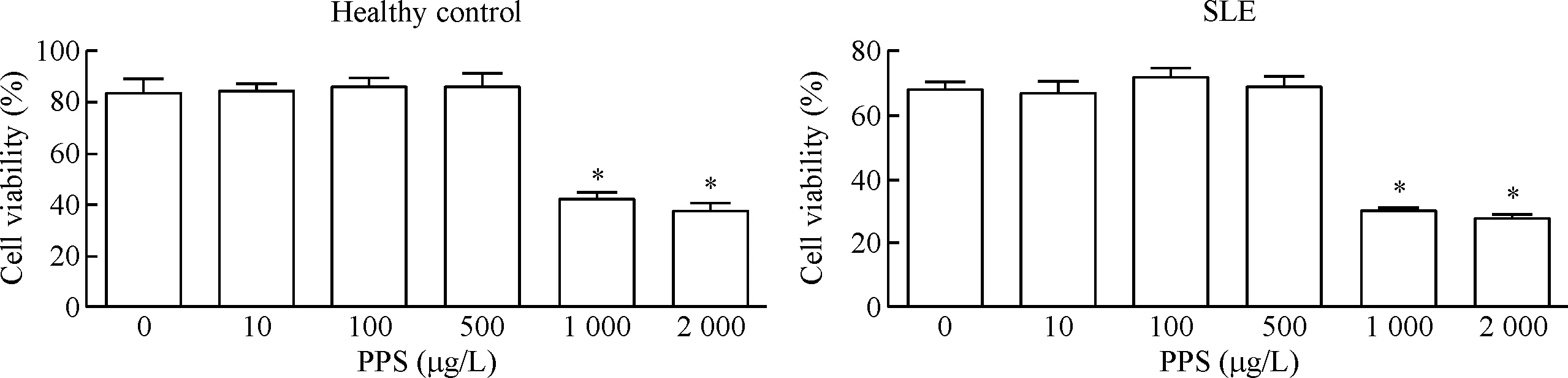
Figure 2.The effect of PPS on the viability of CD4+T cells isolated from the SLE patients and healthy controls. Mean±SD.n=3.*P<0.05vs0 μg/L group.
图2 PPS对SLE患者与健康对照者CD4+T细胞活力的影响
3 PPS影响SLE患者外周血中Th17和Treg细胞因子的分泌
磁珠分选出SLE患者外周血的CD4+T细胞中加入500 μg/L的PPS处理,用未加入PPS的SLE患者CD4+T细胞作为空白对照组,ELISA检测细胞中Th17相关细胞因子(IL-17和IL-6)及Treg相关细胞因子(IL-10和TGF-β)的含量。结果如图3所示,PPS处理后IL-17和IL-6的含量显著降低,IL-10和TGF-β的含量明显上升(P<0.05)。
4 PPS影响SLE患者外周血中Th17和Treg细胞特异转录因子的表达
分选出的CD4+T 细胞经过PPS处理后,RT-qPCR 检测Th17细胞特征性转录因子RORγt与Treg细胞特征性转录因子Foxp3的mRNA表达水平。结果显示,PPS处理使RORγt的mRNA表达显著降低,Foxp3的表达明显上调(P<0.05),见图4A。Wes-tern blot检测RORγt和Foxp3的蛋白表达水平,结果与mRNA表达一致,见图4B。
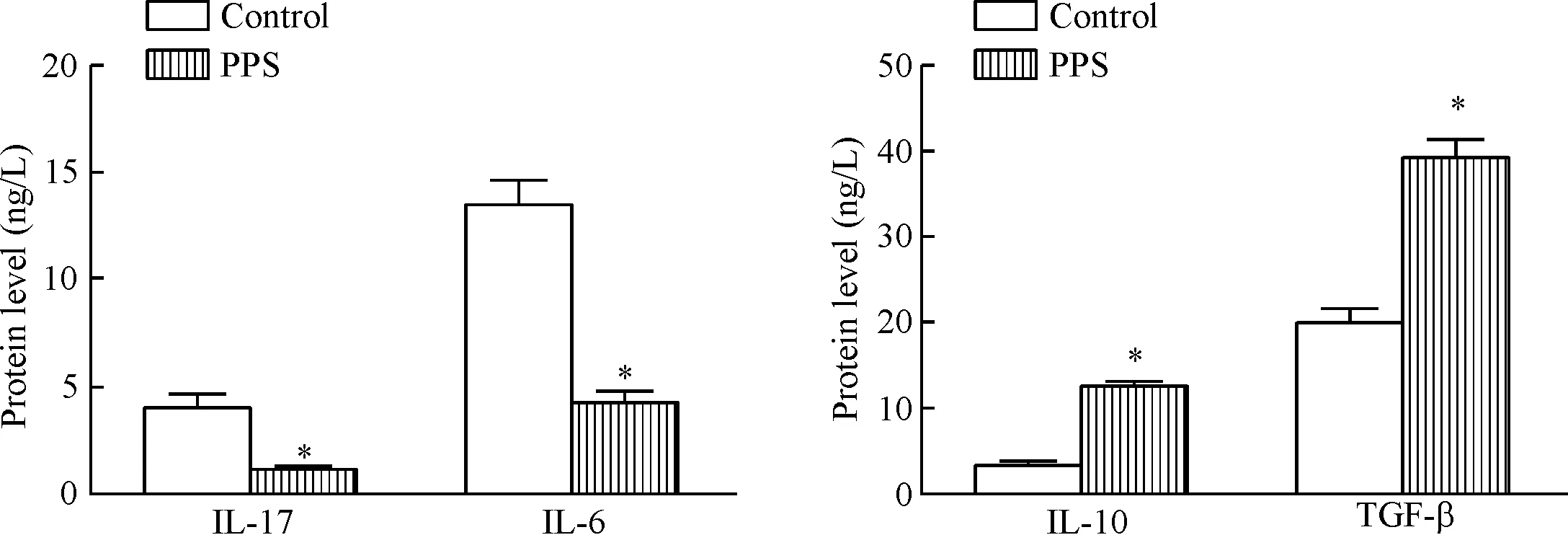
Figure 3.The effect of PPS on the cytokine production by Th17 and Treg cells from SLE patients. Mean±SD.n=3.*P<0.05vscontrol group.
图3 PPS对SLE患者外周血中Th17和Treg细胞相关细胞因子分泌的影响
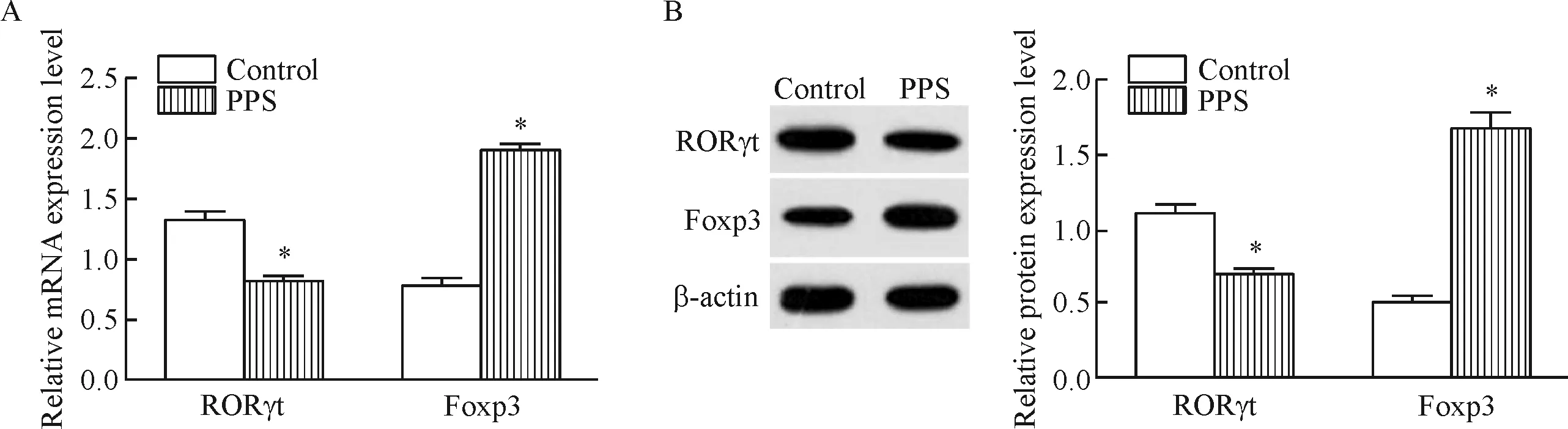
Figure 4.The effect of PPS on the mRNA (A) and protein (B) expression of transcription factors in Th17 and Treg cells from SLE patients. Mean±SD.n=3.*P<0.05vscontrol group.
图4 PPS对SLE患者外周血中Th17和Treg细胞特异转录因子表达的影响
5 PPS影响SLE患者外周血中Th17/Treg细胞的平衡
流式细胞术检测PPS处理的CD4+T 细胞中Th17与Treg细胞的比例。结果表明,与control组相比,PPS组的Th17细胞比例降低,Treg细胞比例增高,差异具有统计学意义(P<0.05)。统计Th17/Treg的比值在PPS处理后的变化,结果显示,Th17/Treg在PPS处理后降低,表明PPS处理使CD4+T细胞向Th17分化降低,Treg分化增多,平衡发生转移,见图5。
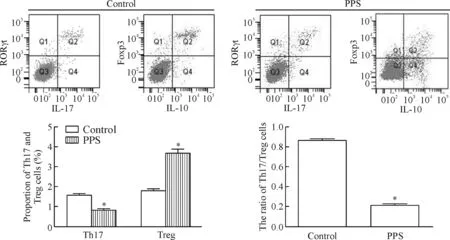
Figure 5.The effect of PPS on Th17/Treg balance in peripheral blood from the SLE patients. Mean±SD.n=3.*P<0.05vscontrol group.
图5 PPS对SLE患者外周血中Th17/Treg细胞平衡的影响
讨 论
SLE是一种由自身免疫调节紊乱引起,并累及多器官损伤的疾病[7-8]。该病的突出特征为骨骼肌肉、皮肤黏膜、肾、中枢神经等多个系统出现免疫性炎症[9]。T淋巴细胞调节的自身免疫反应在SLE的发病进程中发挥了重要的作用[10]。在不同的细胞环境下,T淋巴细胞可分化成为不同的淋巴细胞亚群,包括Th1、Th2、Th17、Treg等细胞[10]。其中Th17和Treg细胞在SLE的病程中尤为重要,在SLE疾病发病机制和治疗的研究中受到重视[11]。
初始T淋巴细胞分化为不同T细胞亚群后,各亚群之间发挥各自的功能,同时又相互制约,维持免疫的稳定与平衡。初始的T淋巴细胞在TGF-β和IL-6的共同刺激下分化为Th17细胞,参与炎症反应和自身免疫疾病[12]。但在仅存TGF-β时,初始T淋巴细胞不会分化为Th17细胞而是向Treg细胞转发并分泌TGF-β,对机体的免疫应答发挥负调控作用[13]。已有研究证实SLE患者的体内具有Treg细胞缺陷,从而导致SLE患者免疫调节功能失常,无法产生对正常组织的免疫耐受,进而促进疾病的发生[14]。Th17与Treg细胞的发育分化相互制约,当二者平衡打破时会导致包括SLE在内的自身免疫疾病的发生[15]。本研究显示SLE患者的Th17细胞比例较正常人升高,Treg细胞比例降低,Th17/Treg的平衡失调,同国内外研究一致[16-17]。
目前中药在免疫性疾病中的治疗受到越来越多的关注,主要原因是其具有副作用低、价廉、效果良好等优点。报道表明中药多糖对巨噬细胞、B细胞、NK细胞以及T细胞均有明显的调节作用[18]。茯苓是我国一种传统经典的中药,生于松根之上并成长分布在我国大部分地区。现代药理学研究表明,茯苓具有抗衰老、抗感染、抗肿瘤以及免疫调节的功效,尤其是抗肿瘤和免疫调节作用,具有良好的疾病治疗和临床应用价值[19]。PPS,即茯苓多糖,是中药茯苓的主要活性成分。早前在茯苓多糖对肿瘤细胞作用的研究中,吴波等[20]报道1 000 μg/L的PPS对肿瘤细胞有杀伤作用。为了筛选出不具有细胞毒性的茯苓多糖,我们首先用不同浓度PPS刺激培养外周血CD4+T细胞(患者组和健康组)72 h,通过MTT检测来观察细胞活力,分析PPS对细胞的毒性作用。结果表明在PPS浓度1~500 μg/L时,药物对患者和健康人的CD4+T细胞没有毒性作用;当PPS浓度为1000 μg/L时,细胞的生长受到抑制,当浓度继续增大其抑制作用的增加并不明显。此结果与在肿瘤细胞中的研究一致,因此我们选用500 μg/L作为无细胞毒性的浓度来研究PPS对SLE疾病的免疫调节作用。
Th17细胞在机体中主要合成并分泌细胞因子IL-17。IL-17通过诱导IL-6表达调节炎症细胞到组织局部的浸润,从而导致系统损伤。研究表明,IL-17和IL-6在炎症相关疾病如银屑病、骨关节炎、类风湿性关节炎、系统性红斑狼疮等中表达显著升高,参与炎症疾病的发病进程[21-22]。RORγt为Th17细胞的特异性转录因子,常用来作为Th17细胞检测的靶标[23]。本研究中PPS抑制SLE患者外周血分离的CD4+T细胞中IL-17和IL-6的表达,并且抑制RORγt的mRNA和蛋白表达,表明PPS处理对SLE的Th17细胞功能有一定的抑制作用。进一步流式检测表明,PPS降低分离出的CD4+T细胞中Th17细胞的比例,证实了PPS对Th17细胞的抑制作用。TGF-β和IL-10为Treg细胞分泌的细胞因子,可抑制淋巴和巨噬细胞等免疫细胞的功能,从而使Treg发挥免疫负调控作用,维持体内的免疫耐受稳态[24]。Foxp3为Treg细胞特异性表达的转录因子,在Treg细胞的发育和功能中起重要作用[25]。在Bae等[5]的报导中,过敏性皮炎小鼠在经过口服药物茯苓后,体内的免疫平衡受到调节,Treg细胞的比例增加,且Foxp3的表达显著增大。与其结果一致,PPS提升了SLE的CD4+T细胞中TGF-β、IL-10与 Foxp3的表达,增加了Treg细胞的比例。进一步分析细胞中Th17/Treg的平衡,结果证实PPS对该免疫细胞平衡有显著的调节作用,改善SLE患者外周血中Th17/Treg的细胞比例失调。
综上所述,我们的实验结果证实了Th17/Treg的免疫平衡参与SLE的病理生理进程,并发现茯苓多糖可以通过减少Th17、增加Treg细胞而调节Th17/Treg的平衡,为统性红斑狼疮的治疗提供了一个新的方法与切入点。
[1] 张 帆, 朱丽花, 王 旭, 等. 系统性红斑狼疮中A20表达特点的研究[J]. 中国病理生理杂志, 2015, 31(3): 518-523.
[2] Chalayer E, Ffrench M, Cathebras P. Aplastic anemia as a feature of systemic lupus erythematosus: a case report and literature review[J]. Rheumatol Int, 2015, 35(6): 1073-1082.
[3] Talaat RM, Mohamed SF, Bassyouni IH, et al. Th1/Th2/Th17/Treg cytokine imbalance in systemic lupus erythematosus (SLE) patients: correlation with disease activity[J]. Cytokine, 2015, 72(2): 146-153.
[4] Jeong JW, Lee HH, Han MH, et al. Ethanol extract ofPoriacocosreduces the production of inflammatory mediators by suppressing the NF-κB signaling pathway in lipopolysaccharide-stimulated RAW 264.7 macrophages[J]. BMC Complement Altern Med, 2014, 14:101.
[5] Bae MJ, See HJ, Choi G, et al. Regulatory T cell induced byPoriacocosbark exert therapeutic effects in murine models of atopic dermatitis and food allergy[J]. Mediators Inflamm, 2016, 2016:3472608.
[6] Choi YH. Induction of apoptosis by an ethanol extract ofPoriacocosWolf. in human leukemia U937 cells[J]. Oncol Rep, 2015, 34(5): 2533-2540.
[7] Stockinger T, Richter L, Kanzler M, et al. Systemic lupus erythematosus: unusual cutaneous manifestations[J]. Hautarzt, 2016, 67(12):970-981.
[8] 袁 敏, 沈 南, 唐元家, 等. DNA甲基化与系统性红斑狼疮[J]. 中国病理生理杂志, 2009, 25(11): 2217-2220.
[9] Tsokos GC, Lo MS, Reis PC, et al. New insights into the immunopathogenesis of systemic lupus erythematosus[J]. Nat Rev Rheumatol, 2016, 12(12): 716-730.
[10]Suarez-Fueyo A, Bradley SJ, Tsokos GC. T cells in systemic lupus erythematosus[J]. Curr Opin Immunol, 2016, 43(3):32-38.
[11]Yang J, Yang X, Zou H, et al. Oxidative stress and Treg and Th17 dysfunction in systemic lupus erythematosus[J]. Oxid Med Cell Longev, 2016, 2016(1):1-9.
[12]Kimura A, Naka T, Kishimoto T. IL-6-dependent and -independent pathways in the development of interleukin 17-producing T helper cells[J]. Proc Natl Acad Sci U S A, 2007, 104(29):12099-12104.
[13]Tao JH, Cheng M, Tang JP, et al. Foxp3, regulatory T cell, and autoimmune diseases[J]. Inflammation, 2017,40(1):328-339.
[14]Okamura T, Morita K, Fujio K, et al. Regulatory T cells in systemic lupus erythematosus[J]. Nihon Rinsho Meneki Gakkai Kaishi, 2015, 38(1): 69-77.
[15]Koga T, Ichinose K, Tsokos GC. T cells and IL-17 in lupus nephritis[J]. Clin Immunol, 2016 Apr 21. [Epub ahead of print]
[16]Rother N, van der Vlag J. Disturbed T cell signaling and altered Th17 and regulatory T cell subsets in the pathogenesis of systemic lupus erythematosus[J]. Front Immunol, 2015, 6:610.
[17]李 志, 杨婷婷, 李文哲, 等. 系统性红斑狼疮患者外周血Th17与Treg细胞及相关细胞因子表达的研究[J]. 中国实验诊断学, 2015, 19(2):253-255.
[18]陈亚楠, 李美锋, 董艳敏, 等. 中药多糖免疫调节作用研究进展[J]. 国际中医中药杂志, 2016, 38(9):855-858.
[19]刘 元, 钱 军, 郭晨旭, 等. 茯苓对裸鼠SGC-7901胃癌细胞移植瘤的影响[J]. 中国普外基础与临床杂志, 2016, 23(3):286-291.
[20]吴 波, 梁 谋, 佟 丽, 等. 茯苓多糖抗肿瘤作用与机理的实验研究[J]. 中国药理学通报, 1994, 10(4):300-304.
[21]Dandan FU, Song X, Hua HU, et al. Downregulation of RUNX3 moderates the frequency of Th17 and Th22 cells in patients with psoriasis[J]. Mol Med Rep, 2016, 13(6):4606-4612.
[22]Wong CK, Lit LC, Tam LS, et al. Hyperproduction of IL-23 and IL-17 in patients with systemic lupus erythematosus: implications for Th17-mediated inflammation in auto-immunity[J]. Clin Immunol, 2008, 127(3):385-393.
[23]Tanaka S, Suto A, Iwamoto T, et al. Sox5 and c-Maf cooperatively induce Th17 cell differentiation via RORγt induction as downstream targets of Stat3[J]. J Exp Med, 2014, 211(9):1857-1874.
[24]陈俊伟, 张少然, 闫成兰, 等. T辅助细胞亚型细胞相关因子在类风湿关节炎发病中的作用[J]. 中国药物与临床, 2012, 12(4):420-423.
[25]Peters A, Pitcher LA, Sullivan JM, et al. Th17 cells induce ectopic lymphoid follicles in central nervous system tissue inflammation[J]. Immunity, 2011, 35(6):986-996.
(责任编辑: 陈妙玲, 罗 森)
Effect of pachyman polysaccharides on Th17/Treg balance in systemic lupus erythematosus patients
WANG Hui-lian1, MENG Qing-liang1, LI Song-wei2, WANG Ji-hua2
(1DepartmentofRheumatology,HenanProvinceHospitalofTCM,2DepartmentofRheumatology,TheFirstAffiliatedHospitalofHenanUniversityofTCM,Zhengzhou450000,China.E-mail:huilianwangzz@163.com)
AIM: To investigate the immunomodulatory effect of pachyman polysaccharides (PPS) on T helper 17 cell (Th17)/regulatory T cell (Treg) balance in the peripheral blood of systemic lupus erythematosus (SLE) patients. METHODS: The CD4+T cells were isolated from the peripheral blood samples obtained from 45 SLE patients and 35 healthy controls enrolled in our study using magnetic bead separation method. The proportions of Th17 and Treg cells were measured by flow cytometry. The CD4+T cells from SLE patients and healthy controls were treated with PPS. The cytoto-xicity of PPS was evaluated by detecting cell viability with MTT assay. The contents of interleukin-17 (IL-17), IL-6, IL-10 and transforming growth factor-β (TGF-β) were measured by ELISA. The expression of retinoid-related orphan receptor γt (RORγt) and forkhead box protein P3 (Foxp3) at mRNA and protein levels was determined by RT-qPCR and Western blot, respectively. RESULTS: The Th17 cells were significantly elevated, while Treg cells were obviously decreased in the SLE patients compared with the healthy control group (P<0.05). Compare with control group, the contents of IL-17 and IL-6 were decreased, while the contents of IL-10 and TGF-β were increased (P<0.05). The expression of RORγt at mRNA and protein levels was down-regulated and the expression of Foxp3 was up-regulated (P<0.05). The ratio of Th17/Treg was decreased in 100 μg/L nontoxic PPS-treated CD4+T cells isolated from the SLE patients (P<0.05). CONCLUSION: PPS treatment inhibits Th17 cells and elevates Treg cells in the CD4+T cells isolated from SLE patients, which may have a therapeutic effect on SLE patients.
Systemic lupus erythematosus; T helper 17 cells; Regulatory T cells; Pachyman polysaccharides
1000- 4718(2017)08- 1514- 06
2016- 12- 12
2017- 03- 22
R961.1; R392.32
A
10.3969/j.issn.1000- 4718.2017.08.027
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0371-53312126; E-mail: huilianwangzz@163.com

