KLF15在人肺腺癌中表达的临床意义*
刘晓妍, 周利能, 张 蕾, 蔡兴东
(暨南大学附属第一医院呼吸内科, 广东 广州 510630)
KLF15在人肺腺癌中表达的临床意义*
刘晓妍△, 周利能, 张 蕾, 蔡兴东
(暨南大学附属第一医院呼吸内科, 广东 广州 510630)
目的: Krüppel样因子15(Krüppel-like factor 15,KLF15)参与肿瘤的增殖、侵袭和转移,但在肺腺癌中的表达和作用尚不明确。本研究探索KLF15蛋白在肺腺癌患者中的表达及其临床意义。方法: 收集我院4例肺腺癌组织及匹配的癌旁组织,Western blot分析这些组织中KLF15蛋白表达的差异。同时收集我院72例肺腺癌患者的肿瘤组织标本及临床资料,免疫组织化学染色分析患者肺癌标本中KLF15蛋白的表达,分析其表达与患者临床特征包括预后的关系。另外,采用质粒转染的方法上调肺腺癌A549细胞中KLF15的表达,CCK-8法分析KLF15蛋白对肺腺癌细胞增殖能力的影响。结果: 在4例肺腺癌及匹配的癌旁组织中,肺腺癌组织中KLF15蛋白表明显低于癌旁组织。在72例肺腺癌病理标本中,KLF15蛋白低表达或不表达者53例,占73.6%,KLF15高表达者19例,占26.4%。KLF15蛋白高表达的患者,其5年生存率明显优于KLF15低表达的患者(P<0.01);KLF15蛋白表达与肺腺癌患者的病理分期(P<0.01)及T分期明显相关(P<0.01),KLF15蛋白低表达是肺腺癌患者不良预后的重要危险因素。上调肺腺癌细胞中KLF15蛋白的表达可明显抑制肺腺癌细胞的生长。 结论: KLF15抑制肺腺癌细胞的生长,有望成为肺腺癌患者的治疗靶点和预后分子标志物。
肺腺癌; Krüppel 样因子15; 细胞增殖; 预后
Krüppel样因子(Krüppel-like factors, KLFs) 是Sp1/KLFs家族中的一个亚家族,通过与富含GC序列元件的基因的启动子区结合而发挥调节作用,在细胞生长、分化、凋亡、死亡等生理过程中发挥重要的调节作用,并参与细胞的基因重编程。2000年,Uchida等[1]利用酵母单杂交试验,用来筛选人类肾脏cDNA文库,鉴定出一个GA位点结合蛋白,一个新的Cys2-His2 锌指基因,命名为肾脏富含的Krüppel样因子,后命名为KLF15。KLF15参与人类脂肪形成及代谢[2-3]、糖代谢[4-5]、心肌肥大的调控[6]和软骨成骨调控[7]等。研究发现,KLF15能够抑制KRAS驱动基因介导的细胞生长[8],抑制乳腺癌细胞的增殖能力且与乳腺癌患者的预后相关[9],然而KLF15在人肺腺癌中表达状况和临床意义如何?国内外尚无文献报道。因此,本研究通过分析KLF15在人肺腺癌中表达及其与患者临床特征(包括预后的关系)以及上调KLF15对肺腺癌细胞生长的影响,为探索KLF15能否作为肺腺癌的治疗靶点和预后分子标志物提供科学依据。
材 料 和 方 法
1 患者资料、病理标本收集和随访
收集暨南大学附属第一医院2009年1月~2012年12月病理确诊的肺腺癌组织石蜡标本72例并对患者进行4~6年的随访。收集患者年龄、性别、TNM分期(T: tumor,肿瘤大小及局部浸润范围; N: node,淋巴结受累情况; M: metastasis,远处转移)[10]等临床病理资料,以免疫组织化学染色分析患者确诊时石蜡包埋病理切片中KLF15蛋白的表达;收集我院4例肺腺癌患者新鲜肿瘤组织和匹配的癌旁组织,Western blot检测肺腺癌组织中KLF15蛋白表达。4例患者均为男性,2例为Ib期,2例为IIa期,术后病理确诊为肺低分化腺癌,取肿瘤组织大小约1 cm为癌组织,距肿瘤外缘3 cm外肺组织为癌旁组织。收集患者肿瘤组织前获得患者知情并签署知情同意书。统计肺腺癌肿瘤组织中KLF15蛋白表达与临床病理特征的关系。肺腺癌患者的临床病理特征资料见表1。
2 免疫组织化学染色和分析
肺腺癌患者石蜡包埋组织中KLF15蛋白检测采用链霉亲和素-过氧化物酶(streptavidin-peroxidase,SP)法染色分析,以KLF15抗体(Sigma,8 mg/L)检测标本中KLF15蛋白的表达,按康为世纪SP试剂盒提供说明进行检测。KLF15蛋白在肺腺癌切片中表达强度参考文献[11]评定,染色强度评分如下:0分(无染色),1分(轻度染色:浅黄色),2分(中度染色:黄棕色),3分(重度染色:棕色)。染色阳性细胞数评分如下:0分(无染色阳性细胞),1分(<10%阳性细胞),2分(10%~50%阳性细胞),3分(>50%阳性细胞)。KLF15蛋白表达强度以染色指数=染色阳性细胞数×染色强度来评价。以log-rank检验结果判定KLF15蛋白表达最佳截断值,其中染色指数≤4为低表达,>4为高表达。
表1 72例肺腺癌患者临床病理特征
Table 1.Clinicopathologic characteristics of 72 cases of patients with lung adenocarcinoma

CharacteristicsData[n(%)]Age(year) ≤6528(38.9) >6544(61.1)Sex Male32(44.4) Female40(55.6)Differentiation Poor30(41.7) Moderate28(38.9) Well14(19.4)Pathologicalstage ⅠA14(19.4) ⅠB25(34.6) ⅡA4(5.6) ⅡB13(18.1) ⅢA10(13.9) ⅢB2(2.8) Ⅳ4(5.6)Tclassification T117(23.6) T247(65.3) T33(4.2) T45(6.9)Nclassification N039(54.2) N117(23.6) N212(16.6) N34(5.6)Mclassification M068(83.3) M14(16.7)Smoking Yes41(56.9) No31(43.1)KLF15expression Low53(73.6) High19(26.4)Vitalstatus Death28(38.9) Alive44(61.1)
3 肺腺癌组织及腺癌细胞总蛋白提取及Western blot检测
4例新鲜肺腺癌组织及匹配的癌旁组织及A549细胞中总蛋白的提取采用BestBio快速蛋白提取试剂盒提取。 KLF15蛋白表达采用Western blot检测,蛋白分离以十二烷基硫酸钠聚丙烯酰胺凝胶(10%)电泳后转印于PVDF膜(Millipore)上。以5%的脱脂牛奶封闭,后以兔抗KLF15抗体(1∶200; Sigma)和兔抗GAPDH抗体(1∶2 500;康为世纪)4 ℃孵育过夜,然后以含0.1% 吐温20的PBS(PBST)洗膜3~5次,每次5 min。 继之以辣根过氧化物酶交联的山羊抗兔II抗(1∶3 000; 康为世纪)室温孵育1 h,PBST洗膜3~5次后以ECL发光液(康为世纪)进行显色,凝胶电泳成像仪拍照保存进行分析。
4 细胞培养、质粒转染及CCK-8检测
人肺腺癌细胞株A549购于中国科学院上海细胞库。细胞株培养用含有10%胎牛血清(Gibco BRL)、1×105U/L青霉素及100 mg/L链霉素的DMEM(Gibco BRL)完全培养基,并置于37 ℃、含5% CO2的培养箱中培养。重组人全长KLF15(NM_031918)cDNA质粒pcDNA3.1(+)-KLF15及对照空质粒pcDNA3.1(+)均购自GeneCopoeia。上述质粒通过PolyJetTM转染试剂转染至A549细胞,转染步骤参考PolyJet说明书。转染72 h后提取细胞总蛋白,Western blot检测KLF15表达成功后,以每孔8×104接种于96孔板中继续培养,分别于0、12、24、48和72 h加入CCK-8(Dojindo),酶标仪检测吸光度(A)并统计其差异。
5 统计学处理
以SPSS 16.0软件进行数据统计分析。KLF15蛋白表达不同组预后的差异以Kaplan-Meier法和log-rank 检验分析;单因素和多因素Cox回归模型分析肺腺癌患者不良预后的危险因素。肿瘤最大径在KLF15蛋白表达不同组间差异采用Student’st检验;Mann-WhitneyU检验分析KLF15蛋白表达与患者临床特征的关系;单因素方差分析统计KLF15上调前后各组细胞不同时点A值的差异。组间计量资料以均数±标准差(mean±SD)表示。以P<0.05为差异有统计学意义。
结 果
1 KLF15蛋白在肺腺癌和癌旁组织中的表达
免疫组织化学染色分析显示,在72例临床资料完整的肺腺癌肿瘤组织标本中,KLF15蛋白低表达或不表达者53例,占73.6%,KLF15高表达者19例,占26.4%,而KLF15表达主要定位于肿瘤细胞包浆中,以细胞核周围最明显。在4例肺腺癌患者新鲜肿瘤组织及匹配的癌旁组织中,Western blot分析显示,癌旁组织中KLF15蛋白表达明显高于其在癌组织中的表达,见图1。

Figure 1.The expression of KLF15 protein in lung adenocarcinoma and adjacent tissues. A: representative images from 72 cases of lung adenocarcinoma with negative, moderate and strong immunostaining of KLF15 protein detected by immunohistochemistry; B: Western blot analysis of KLF15 protein expression in lung adenocarcionoma tissues (T: tumor) and its matched adiacent tissues (N: normal).
图1 KLF15在肺腺癌组织中及匹配的癌旁组织中的表达对比
2 KLF15表达与肺腺癌患者的预后
Log-rank检验结果显示,KLF15蛋白高表达组5年累积生存率明显优于KLF15蛋白低表达组(P<0.05)。Kaplan-Meier法分析结果显示,KLF15蛋白高表达组患者,其5年累积生存率为53.54% (95% CI:0.486~0.873),而KLF15蛋白低表达组,其5年累积生存率为37.68% (95% CI: 0.325~0.474),见图2。
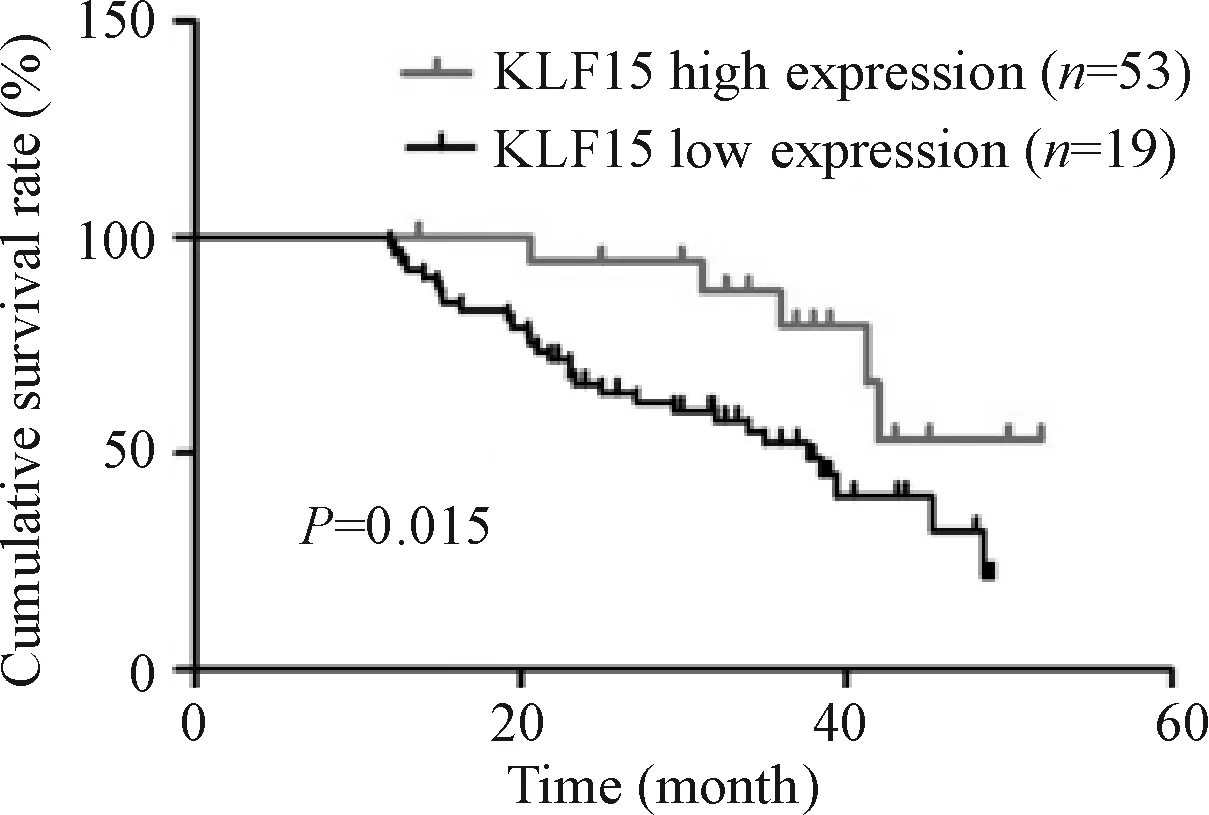
Figure 2.The correlation between KLF15 protein expression and the overall survival time of the patients with lung adenocarcinoma.
图2 KLF15蛋白的表达与肺腺癌患者总体生存时间的关系
3 肺腺癌患者预后不良的主要危险因素回归分析
对患者的临床资料,包括年龄、性别、吸烟、肿瘤大小、病理分期、分化程度、TNM分期以及KLF15蛋白表达高低进行回归分析,单因素Cox回归分析显示: KLF15蛋白表达、肺腺癌的分化程度、病理分期及TNM分期均为影响患者预后的危险因素,其中以KLF15蛋白表达及肿瘤远处转移尤为明显(P<0.01);多因素Cox回归分析显示,KLF15蛋白低表达和远处转移是导致肺腺癌患者预后不良的主要危险因素,见表2。
4 KLF15表达与肺腺癌患者的病理分期、T分期及肿瘤大小相关性分析
通过Mann-WhitneyU检验分析KLF15蛋白表达高低与患者年龄、性别、分化程度、病理分期和TNM分期的相关性,结果显示KLF15蛋白表达高低与肺腺癌患者的病理分期和T分期明显相关(表3)。通过分析不同KLF15蛋白表达组肿瘤最大径的差异,显示KLF15蛋白高表达组患者肿瘤最大径为(2.870±0.408) cm,低表达KLF15的患者肿瘤最大径为(5.165±2.173) cm,见图3。
5 上调KLF15蛋白的表达对A549细胞增殖能力的影响
通过瞬时过表达质粒转染技术,在A549肺腺癌细胞中上调KLF15蛋白的表达,结果发现:上调KLF15蛋白表达明显抑制了A549细胞的增殖能力,见图4。
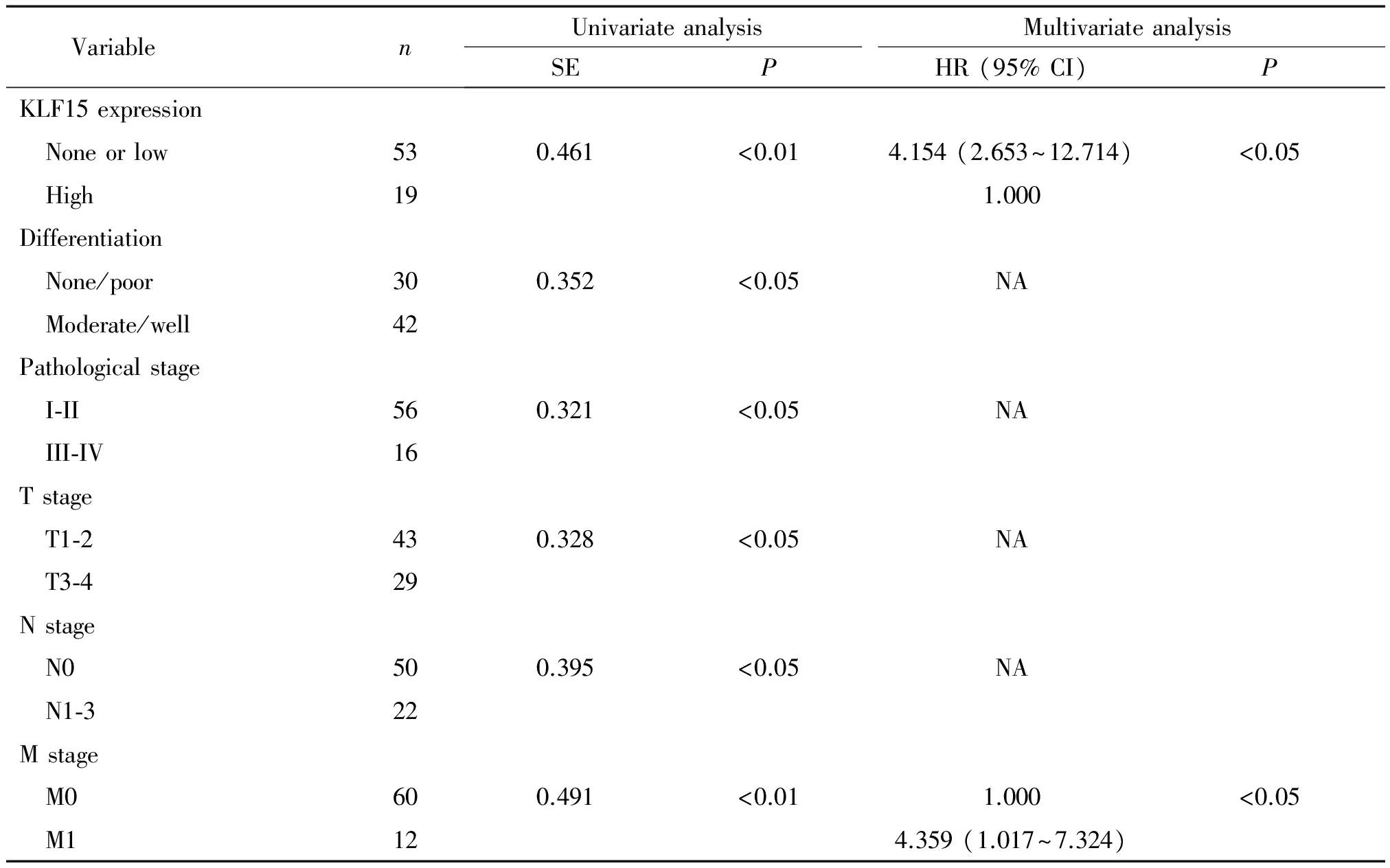
表2 Cox回归模型单因素和多因素分析肺腺癌患者不良预后的危险因素
表3 肺腺癌患者临床特征与KLF15表达的相关性分析
Table 3.The correlation between KLF15 protein expression and clinical characteristics of patients with lung adenocarcinoma

CharacteristicsKLF15expressionP(Mann⁃WhitneyUtest)LowornoneHighAge(year) ≤652170.832 >653212Sex Male21110.172 Female328Smoking No2650.678 Yes2714Differentiation Noneorpoor2280.964 Moderateorwell3111Pathologicalstage Ⅰ2712<0.01 Ⅱ125 Ⅲ102 Ⅳ31Tstage T1116<0.001 T2407 T321 T450Nstage N027120.363 N1⁃3267Mstage M060180.959 M131
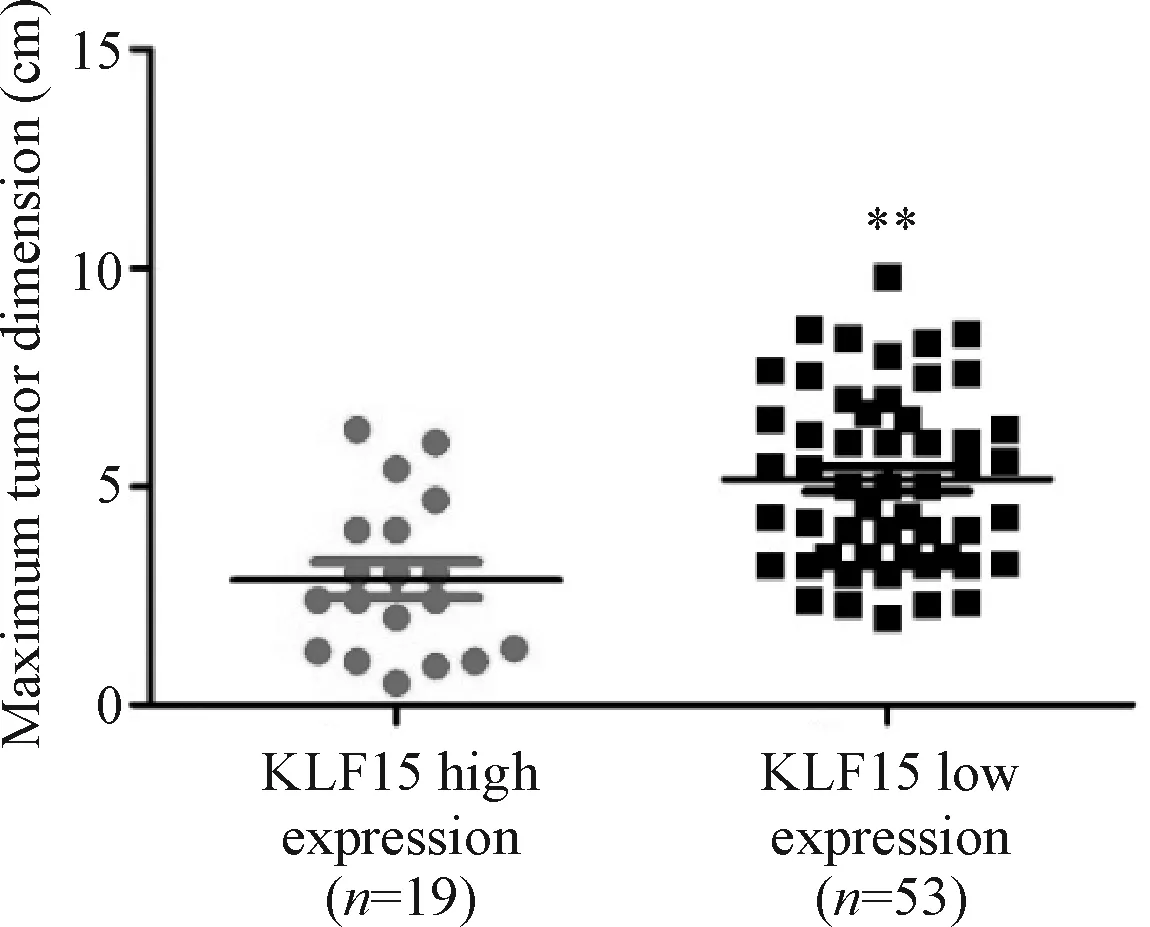
Figure 3.The difference of maximum tumor dimension between KLF15 high and low expression groups in patients with lung adenocarcinoma. Mean±SD.**P<0.01vsKLF15 high expression.
图3 肺腺癌患者肿瘤最大径在KLF15蛋白高低表达组的差异
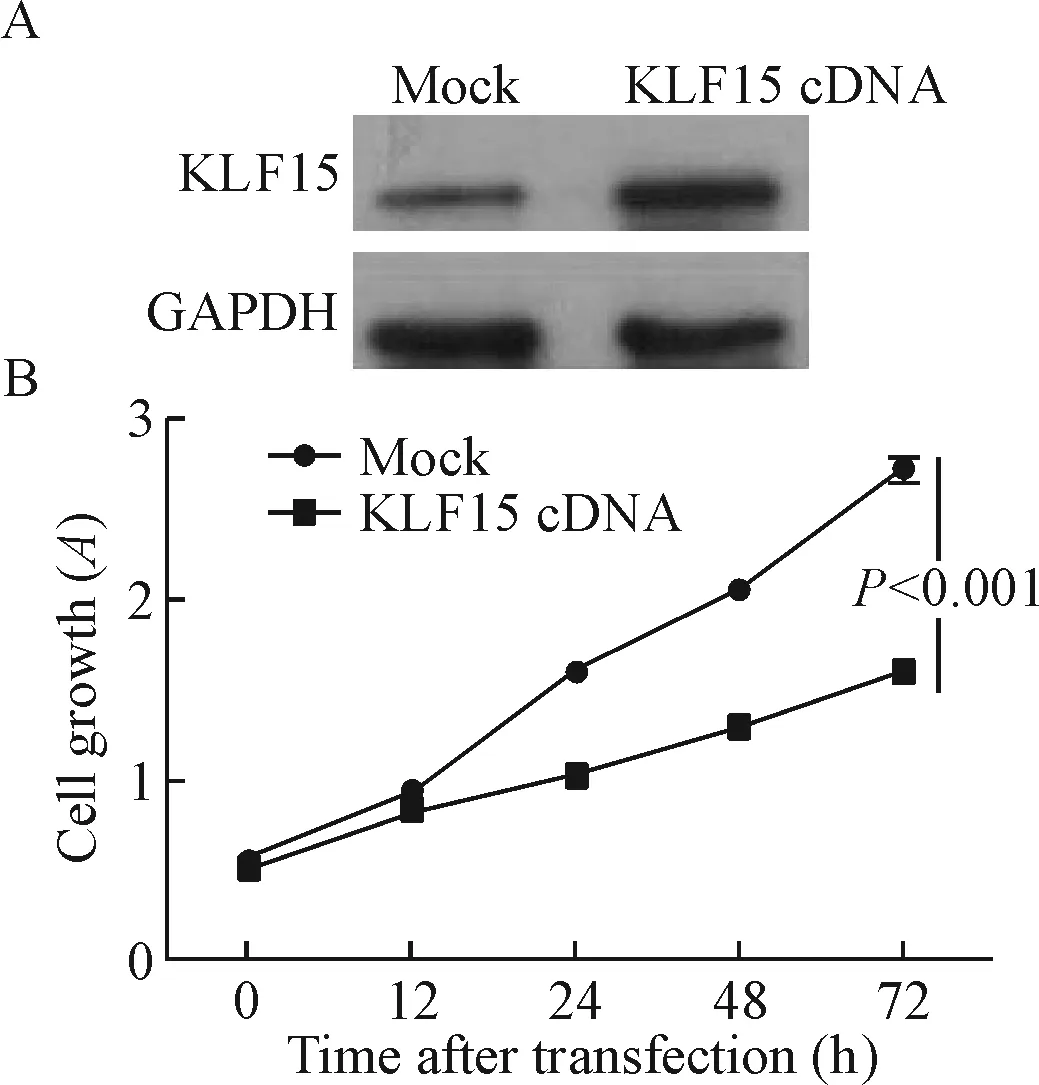
Figure 4.The effects of up-regulation of KLF15 on the proliferation of A549 cells. A: Western blot analysis showed up-regulation of KLF15 in A549 cells by transfection with pcDNA3.1(+) and pcDNA3.1(+)-KLF15 vector, which named mock and KLF15 cDNA, respectively; B: CCK-8 assay showed that enhanced expression of KLF15 significantly inhibited the proliferation of A549 cells compared with the cells transfected with mock vector. Mean±SD.n=3.
图4 上调KLF15蛋白的表达对A549细胞增殖能力的影响
讨 论
Krüppel样因子参与细胞的多种生物学过程。Wade等[12]在T47D乳腺癌细胞中,通过人工合成孕酮R5020刺激细胞富集孕酮受体靶基因,发现KLF15能够被孕酮受体诱导产生,并能够结合于E2F1富含GC的启动子区,提示KLF15可作为转录因子发挥作用。KLF15能够抑制子宫内膜癌Ishikawa细胞增殖,在子宫上皮细胞的黄体酮细胞周期中作为重要下游抑制性生理调节因子[13]。Yoda等[9]研究发现,在54例侵润性乳腺导管癌中,KLF17可表达于癌症细胞的胞浆及细胞核内,KLF15核表达的患者预后较好。在乳腺癌细胞中,KLF15在胞浆中低表达;上调KLF15的表达后,导致KLF15在乳腺癌细胞核内集聚,并抑制细胞的增殖能力,诱导细胞G0/G1细胞周期阻滞。该研究进一步发现,KLF15核表达诱导细胞周期蛋白P21表达增加,提示KLF15可能通过上调P21蛋白进而导致细胞周期阻滞在G0/G1期。本研究结果显示,KLF15主要表达于肺腺癌细胞的胞浆中,以核周围明显,核内表达不明显,与Yoda等[9]的研究结果不同。这可能是由于KLF15被癌基因表达的蛋白结合致体积增大或是KLF15蛋白修饰发生不利于通过核膜上微孔转运,导致KLF15蛋白在核膜周围聚集。此外,也可能是由于KLFs家族成员的功能不是固定不变的,在不同的细胞类型、不同组织中分布不同,功能不尽相同,且转录后调控也不同所致[14]。
本研究结果表明KLF15在肺腺癌中低表达,低表达KLF15的肺腺癌患者,其5年累积生存率明显低于KLF15蛋白高表达组患者,提示KLF15在肺腺癌中作为抑癌基因起作用。通过Cox多因素回归分析发现KLF15低表达是肺腺癌患者预后不良的主要危险因素;KLF15蛋白低表达的患者死亡风险较高表达KLF15患者增加4.154倍。这些研究结果表明KLF15是肺腺癌重要的抑癌基因,可作为肺腺癌患者预后的分子标志物。
MicroRNA-4262负性调控KLF15 mRNA的表达,进而促进乳腺癌细胞的增殖和侵袭能力[15],而在卵巢中,microRNA-376a通过靶向抑制KLF15的表达促进卵巢癌细胞增殖和转移能力[16],这些结果提示KLF15可能抑制肿瘤细胞的增殖、侵袭和转移能力。通过统计分析肺腺癌患者肿瘤组织中KLF15蛋白表达与临床特征的关系,本实验结果发现KLF15蛋白表达与患者的病理分期及T分期相关,进一步分析KLF15蛋白表达与患者肿瘤最大直径的差异,结果显示KLF15蛋白低表达的肺腺癌患者,其肿瘤最大径明显高于KLF15蛋白高表达的肺腺癌患者,提示KLF15抑制肺腺癌细胞的增殖。为了体外验证KLF15蛋白的功能,本实验通过质粒转染技术和CCK-8法,检测上调KLF15前后A549细胞增殖能力的差异,结果显示上调KLF15蛋白表达后明显抑制了细胞的增殖能力,结合临床统计数据结果,我们的研究表明KLF15抑制了肺腺癌细胞的增殖能力。
总之,本研究显示,KLF15蛋白在肺腺癌患者中表达明显下调,KLF15蛋白低表达的患者预后不良,而且KLF15蛋白低表达是肺腺癌患者预后不良的重要预测因子。KLF15蛋白表达与肿瘤患者的临床病理分期和T分期相关,高表达KLF15蛋白明显抑制肺腺癌细胞的增殖。本研究为KLF15作为肺腺癌调控靶点和预后分子标志物提供了理论依据。
[1] Uchida S, Tanaka Y, Ito H, et al. Transcriptional regulation of the CLC-K1 promoter by myc-associated zinc finger protein and kidney-enriched Krüppel-like factor, a novel zinc finger repressor [J]. Mol Cell Biol, 2000, 20(19):7319-7331.
[2] Banerjee SS, Feinberg MW, Watanabe M, et al. The Krüppel-like factor KLF2 inhibits peroxisome proliferator-activated receptor-γ expression and adipogenesis [J]. J Biol Chem, 2003, 278(4):2581-2584.
[3] Mori T, Sakaue H, Iguchi H, et al. Role of Krüppel-like factor 15 (KLF15) in transcriptional regulation of adipogenesis [J]. J Biol Chem, 2005, 280(13):12867-12875.
[4] Zorzano A, Palacín M, Gumà A. Mechanisms regulating GLUT4 glucose transporter expression and glucose transport in skeletal muscle [J]. Acta Physiol Scand, 2005, 183(1):43-58.
[5] Gray S, Wang B, Orihuela Y, et al. Regulation of gluconeogenesis by Krüppel-like factor 15 [J]. Cell Metab, 2007, 5(4):305-312.
[6] Fisch S, Gray S, Heymans S, et al. Kruppel-like factor 15 is a regulator of cardiomyocyte hypertrophy [J]. Proc Natl Acad Sci U S A, 2007, 104(17):7074-7079.
[7] Woods A, James CG, Wang G, et al. Control of chondrocyte gene expression by actin dynamics: a novel role of cholesterol/Ror-α signaling in endochondral bone growth [J]. J Cell Mol Med, 2009, 13(9B):3497-3516.
[8] Fernandez-Zapico ME, Lomberk GA, Tsuji S, et al. A functional family-wide screening of SP/KLF proteins identifies a subset of suppressors ofKRAS-mediated cell growth [J]. Biochem J, 2011, 435(2):529-537.
[9] Yoda T, McNamara KM, Miki Y, et al. KLF15 in breast cancer: a novel tumor suppressor? [J]. Cell Oncol (Dordr), 2015, 38(3):227-235.
[10]Postmus PE, Brambilla E, Chansky K, et al. The IASLC Lung Cancer Staging Project: proposals for revision of the M descriptors in the forthcoming (seventh) edition of the TNM classification of lung cancer [J]. J Thorac Oncol, 2007, 2(8):686-693.
[11]黄志宏, 骆文志, 蔡兴东. KLF16在肺腺癌中表达的临床意义及机制[J]. 中国病理生理杂志, 2013, 29(11):1978-1983.
[12]Wade HE, Kobayashi S, Eaton ML, et al. Multimodal regulation of E2F1 gene expression by progestins [J]. Mol Cell Biol, 2010, 30(8):1866-1877.
[13]Ray S, Pollard JW. KLF15 negatively regulates estrogen-induced epithelial cell proliferation by inhibition of DNA replication licensing [J]. Proc Natl Acad Sci U S A, 2012, 109(21):E1334-E1343.
[14]Bieker JJ. Krüppel-like factors: three fingers in many pies [J]. J Biol Chem, 2001, 276(37):34355-34358.
[15]Wang K, Ren Y, Liu Y, et al. miR-4262 promotes proliferation and invasion of human breast cancer cells through directly targeting KLF6 and KLF15 [J]. Oncol Res, 2017, 25(2):277-283.
[16]Yang L, Wei QM, Zhang XW, et al. MiR-376a promotion of proliferation and metastases in ovarian cancer: Potential role as a biomarker [J]. Life Sci, 2017, 173:62-67.
(责任编辑: 林白霜, 罗 森)
Clinical significance of KLF15 expression in human lung adenocarcinoma
LIU Xiao-yan, ZHOU Li-neng, ZHANG Lei, CAI Xing-dong
(DepartmentofRespiratoryMedicine,TheFirstAffiliatedHospitalofJinanUniversity,Guangzhou510630,China.E-mail: 2514437568@qq.com)
AIM: To explore the clinical significance of Krüpple-like factor 15 (KLF15) protein expression in the patients with lung adenocarcinoma for exploring the therapeutic and prognositic biomarkers of lung cancer. ME-THODS: Four cases of lung adenocarcinoma tissues and matched adjacent tissues were collected from our hospital, and the expression of KLF15 protein in these tissues was analyzed by Western blot. At the same time, 72 cases of archived paraffin-embedded samples and clinical data of the patients with lung adenocarcinoma were also collected. The KLF15 protein expression in the archived paraffin-embedded lung adenocarcinoma samples was detected by immunohistochemical staining. The correlations between KLF15 protein expression and clinical characteristics of the patients including prognosis were also analyzed. In addition, the KLF15 protein was up-regulated in A549 cells, and then the effects of KLF15 protein on the viability of the cells were measured by CCK-8 assay. RESULTS: The protein expression of KLF15 in the 4 cases of lung adenocarcinoma tissues was significantly lower than that in matched paracancerous tissues. Fifty-three cases of lung adenocarcinoma specimens showed low expression or no expression of KLF15 protein in total 72 cases (73.6%). The 5-year survival rate of the patients with high expression of KLF15 protein in their specimens was higher than that of the patients with the low expression of KLF15 protein (P<0.01), and the expression of KLF15 protein was significantly correlated with the pathological staging (P<0.01) and T stage (P<0.01) of the patients with lung adenocarcinoma. Furthermore, the low expression of KLF15 protein was an important poor prognostic indicator of the patients. Up-regulation of KLF15 protein in the A549 cells significantly inhibited the growth of the cells. CONCLUSION: KLF15 inhibits the growth of lung adenocarcinoma cells. It could be used as a therapeutic target and a prognostic biomarker for the patients with lung adenocarcinoma.
Lung adenocarcinoma; Krüppel-like factor 15; Cell proliferation; Prognosis
1000- 4718(2017)08- 1411- 06
2017- 01- 16
2017- 03- 15
国家自然科学基金青年基金资助项目(No.81302030)
R730.23; R734.2
A
10.3969/j.issn.1000- 4718.2017.08.011
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-38688427; E-mail: 2514437586@qq.com

