尿路上皮癌抗原1过表达对胰腺癌CaPan-2细胞侵袭和转移能力的影响
许朝 陈思 吕超蓝 余跃 张开光
·短篇论著·
尿路上皮癌抗原1过表达对胰腺癌CaPan-2细胞侵袭和转移能力的影响
许朝 陈思 吕超蓝 余跃 张开光
长链非编码RNA(long noncoding RNA, lncRNA)是指一类长度大于200个核苷酸、不编码蛋白质的RNA。近年来研究发现,它在诸如表观遗传调控、转录激活、转录干扰和核内转运等多种生物学过程中发挥重要的调控作用[1]。尿路上皮癌抗原1(urothelial carcinoma associated 1,UCA1)即是一个lncRNA,在人类多种恶性肿瘤中异常表达,并显著增强癌细胞的增殖和耐药性[2-4]。本课题组前期研究发现,UCA1在胰腺癌组织中高表达,且与临床转移成正相关,抑制UCA1可抑制人胰腺癌PANC1细胞的体外侵袭能力[5]。本研究通过脾内注射切脾法建立胰腺癌肝转移模型,进一步探讨UCA1过表达对胰腺癌细胞体内转移能力的影响。
一、材料与方法
1.稳定过表达UCA1的CaPan-2细胞株的建立:全长UCA1基因(1.44 kb)由上海吉玛制药技术有限公司合成。合成的UCA1基因片段及pGLV5-EF1a-EGFP/Puro质粒用NotⅠ和NsiⅠ双酶切后经1%琼脂糖凝胶电泳分离,回收和纯化酶切片段,用T4 DNA连接酶将UCA1片段以黏端方式与质粒片段连接,转化感受态DH5a大肠杆菌扩增后提取重组质粒,通过酶切及测序鉴定正确后,采用脂质体法将其与包膜蛋白质粒(pVSV-G)、核心蛋白/逆转录酶质粒(pGag/Pol)和载体质粒(pRev)共转染293T细胞。72 h后收集细胞培养上清,过滤后4℃ 20 000 r/min离心2 h,-80℃冰箱保存备用。用10% FBS的DMEM培养液20 μl 10倍稀释4个梯度分别感染293T细胞,通过荧光显微镜计数荧光细胞,结合稀释倍数计算病毒滴度约为1×109TU/ml。CaPan-2细胞1.0×106/孔的密度接种96孔板,培养24 h,吸去培养液,每孔加入200 μl 1×108TU/ml的病毒液,常规培养24 h后更换为McCoy′s 5a完全培养液培养,48 h后更换为含嘌呤霉素(终浓度为0.35 μg/ml)的McCoy′s 5a完全培养液培养,期间每2 d换液。10 d后获得稳定过表达UCA1的人胰腺癌CaPan-2细胞(CaPan-2/UCA1)。同法用空病毒载体感染CaPan-2细胞(CaPan-2/NC)作为阴性对照。
2.CaPan-2细胞UCA1的表达水平检测:Trizol提取各组细胞的总RNA,采用SuperscriptⅡ反转录试剂盒逆转录获得cDNA。实时荧光定量PCR法检测细胞UCA1 mRNA的表达,以GAPDH为内参。引物序列:UCA1上游引物为5′-ATGGTGTCCTCAAGCCTACTCTCA-3′,下游引物为5′-TGAAATGTCCCAAGCCCTCTAAC-3′, 产物片段长度为139 bp;GAPDH上游引物为5′-GGGAAACTGTGGCGTGAT-3′,下游引物为5′-GAGTGGGTGTCGCTGTTGA-3′,产物片段长度为299 bp。PCR扩增条件:95℃ 10 min;95℃ 10 s、60℃ 60 s,40个循环。采用2-△△Ct法计算UCA1在癌细胞中的相对表达量。
3.CaPan-2细胞体外侵袭能力检测:胰酶消化并收集各组细胞,计数后用McCoy′s 5a无血清培养液调整细胞密度为1×106个/ml。将Matrigel Transwell小室(Chemicon公司)置于24孔板中,上室中加入无血清培养液稀释的细胞悬液100 μl,下室中加入含10%胎牛血清的McCoy′s 5a培养液500 μl,常规培养24 h。弃上室液体,用棉签轻轻拭去滤膜上表面未穿膜的细胞,用甲醇溶液固定10 min,常规结晶紫染色。在倒置显微镜下选择10个高倍镜视野(×200),计数穿膜细胞数。每组设3个复孔,实验重复3次。
4.裸鼠体内实验:6周龄BALB/C裸鼠购自中国科学院上海实验动物中心,饲养于SPF条件下,8周龄后进行实验。采用脾内注射切脾法建立胰腺癌肝转移模型,即在麻醉后行左上腹横切口,显露脾脏并小心拉出体外,用1 ml注射器从脾脏上极沿脾纵轴进针,缓慢注射胰腺癌CaPan-2细胞悬液0.5 ml(1×107个/ml),注射区可见被膜变白隆起。待隆起消失后5 min切除脾脏,无出血后关腹。用随机数字表法将裸鼠分为2组;CaPan-2/UCA1组,注射CaPan-2/UCA1细胞悬液;CaPan-2/NC组,注射CaPan-2/NC细胞悬液,每组10只。注射6周后脱颈处死裸鼠,开腹取肝脏,计数肝表面的转移结节并称重。以10%甲醛固定肝组织后常规行病理学检查。
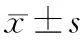
二、结果
1.各组细胞UCA1 mRNA表达量:CaPan-2/UCA1、CaPan-2/NC及亲本CaPan-2细胞UCA1 mRNA相对表达量分别为3.103±0.103、1.130±0.043和1.000±0.047。CaPan-2/UCA1细胞的表达显著高于CaPan-2/NC(t=2.110,P<0.05)以及亲本细胞(t=2.204,P<0.05),而CaPan-2/NC和亲本细胞间差异无统计学意义(P>0.05)。
2.UCA1过表达CaPan-2细胞体外侵袭能力的改变:CaPan-2/UCA1、CaPan-2/NC和亲本CaPan-2细胞24 h的穿膜细胞数分别为(34.67±7.35)、(24.33±4.12)和(21.67±4.04)个/200倍视野。CaPan-2/UCA1明显高于CaPan-2/NC(t=22.99,P<0.05)及亲本细胞(t=20.323,P<0.05),而CaPan-2/NC与亲本细胞间的差异无统计学意义(P>0.05,图1)。
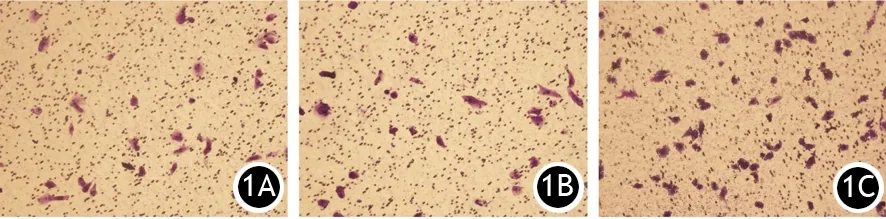
图1 CaPan-2组(1A)、CaPan-2/NC组(1B)、CaPan-2/UCAI(1C)的穿膜细胞(结晶紫染色 ×200)
3.UCA1过表达CaPan-2细胞肝转移的影响:CaPan-2/NC组中只有2只裸鼠有肝转移结节(2/10),而Capan-2/UCA1组6只裸鼠有肝转移结节(6/10),两组间差异有统计学意义(P<0.05,图2)。
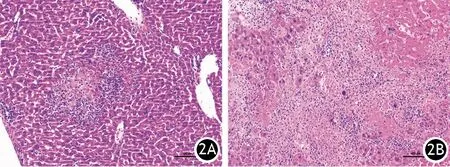
图2 CaPan-2/NC(2A)、CaPan-2/UCA1(2B)裸鼠的肝转移灶(HE ×100)
讨论 UCA1基因位于19号染色体的区链p13区,其转录产物UCA1是一个lncRNA,缺少明显的开放性阅读框而不具备蛋白编码功能。Wang等[6]首次在膀胱癌中鉴定并克隆出了UCA1的全长cDNA,并因其与泌尿道上皮肿瘤的密切相关性而将其命名。此后的研究显示UCA1在人类胎盘组织和胎儿的心脏、膀胱和宫体组织中均有表达,而在绝大多数正常成人组织(除心脏和脾脏外)中均无表达[7]。随后的研究显示,UCA1在人类多种恶性肿瘤中(如胃癌,卵巢癌、肺癌、结肠癌等)异常高表达,并能促进肿瘤增殖能力和耐药性,被认为具有癌基因功能[8-11]。
本课题组前期研究发现,UCA1在胰腺癌组织中表达异常增高,并且在伴有淋巴结或远处转移的胰腺癌组织中的表达明显高于无转移者;进一步通过RNA干扰技术下调UCA1表达后,胰腺癌PANC1细胞的体外迁移和侵袭能力均明显减弱[5]。最新研究报道,UCA1表达水平与黑色素瘤和舌鳞癌的临床转移呈正相关,抑制UCA1表达可抑制癌细胞的体外迁移和侵袭能力[12-13]。为进一步探讨UCA1对胰腺癌细胞体内转移能力的影响,本研究成功建立了稳定过表达外源UCA1的CaPan-2细胞株,结果显示,UCA1过表达显著增强了CaPan-2细胞的体外侵袭能力和肝转移能力。
上皮-间质转化是上皮细胞通过特定程序转化为间质表型细胞的生物学过程,是肿瘤细胞获得侵袭和转移能力的重要机制。本课题组前期研究发现,沉默UCA1可显著下调胰腺癌PANC1细胞间质分子vimentin的表达[5],细胞呈现成纤维细胞样的细胞形态。Cheng等[14]早前通过芯片技术检测沉默UCA1对膀胱癌细胞基因表达谱的影响,结果显示细胞中间质分子fibronectin和vimentin的表达水平均明显下调。因此,笔者推测UCA1可能通过正向调控细胞上皮-间质转化过程继而促进肿瘤侵袭。新近研究发现,UCA1可通过激活多条细胞内信号通路诱导上皮-间质转化,如AKT/mTOR,Wnt/β-catenin信号通路[15-16]。另一项研究则发现,UCA1通过竞争结合hsa-miR-145并干扰后者对 ZEB1/2表达的负性调控,ZEB1/2表达上调继而诱导了上皮-间质转化过程。然而,UCA1是否通过以上机制调控胰腺癌上皮-间质转化仍有待进一步研究。
[1] Ponting CP, Oliver PL, Reik W. Evolution and functions of long noncoding RNAs[J]. Cell, 2009,136(4):629-641. DOI: 10.1016/j.cell.2009.02.006.
[2] Huang J, Zhou N, Watabe K, et al. Long non-coding RNA UCA1 promotes breast tumor growth by suppression of p27 (Kip1)[J]. Cell Death Dis, 2014, 5: e1008. DOI: 10.1038/cddis.2013.541.
[3] Han Y, Yang YN, Yuan HH, et al. UCA1, a long non-coding RNA up-regulated in colorectal cancer influences cell proliferation, apoptosis and cell cycle distribution[J]. Pathology, 2014, 46(5):396-401. DOI: 10.1097/PAT.0000000000000125.
[4] Tsang WP, Wong TW, Cheung AH, et al. Induction of drug resistance and transformation in human cancer cells by the noncoding RNA CUDR[J]. RNA, 2007, 13(6): 890-898. DOI: 10.1261/rna.359007.
[5] 许朝,诸琦,余跃,等. 尿路上皮癌抗原1基因沉默可抑制人胰腺癌细胞的体外迁移和侵袭. 肿瘤,2015, 35(11):1192-1199. DOI:10.3781/j.issn.1000-7431.2015.11.482.
[6] Wang XS, Zhang Z, Wang HC, et al. Rapid identification of UCA1 as a very sensitive and specific unique marker for human bladder carcinoma[J]. Clin Cancer Res, 2006, 12(16):4851-4858. DOI: 10.1158/1078-0432.CCR-06-0134.
[7] Nie W, Ge HJ, Yang XQ, et al. LncRNA-UCA1 exerts oncogenic functions in non-small cell lung cancer by targeting miR-193a-3p[J]. Cancer Lett, 2016, 371(1):99-106. DOI: 10.1016/j.canlet.2015.11.024.
[8] Bian Z, Jin L, Zhang J, et al. LncRNA-UCA1 enhances cell proliferation and 5-fluorouracil resistance in colorectal?cancer?by inhibiting miR-204-5p[J]. Sci Rep, 2016, 6:23892. DOI: 10.1038/srep23892.
[9] Wang F, Zhou J, Xie X, et al. Involvement of SRPK1 in cisplatin resistance related to long non-coding RNA UCA1 in human ovariancancer cells[J]. Neoplasma, 2015, 62(3):432-438. DOI: 10.4149/neo_2015_051.
[10] Zheng Q, Wu F, Dai WY, et al. Aberrant expression of UCA1 in gastric cancer and its clinical significance[J]. Clin Transl Oncol, 2015, 17(8):640-646. DOI: 10.1007/s12094-015-1290-2.
[11] Tian Y, Zhang X, Hao Y, et al. Potential roles of abnormally expressed long noncoding RNA UCA1 and Malat-1 in metastasis of melanoma[J]. Melanoma Res, 2014,24(4):335-341. DOI: 10.1097/CMR.0000000000000080.
[12] Fang Z, Wu L, Wang L, et al. Increased expression of the long non-coding RNA UCA1 in tongue squamous cell carcinomas: a possible correlation with cancer metastasis[J]. Oral Surg Oral Med Oral Pathol Oral Radiol, 2014,117(1): 89-95. DOI: 10.1016/j.oooo.2013.09.007.
[13] Yang C, Li X, Wang Y, et al. Long non-coding RNA UCA1 regulated cell cycle distribution via CREB through PI3-K dependent pathway in bladder carcinoma cells[J]. Gene, 2012, 496(1):8-16. DOI: 10.1016/j.gene.2012.01.012.
[14] Cheng N, Cai W, Ren S, et al. Long non-coding RNA UCA1 induces non-T790M acquired resistance to EGFR-TKIs by activating the AKT/mTOR pathway in EGFR-mutant non-small cell lung cancer[J]. Oncotarget, 2015, 6(27):23582-23593. DOI: 10.18632/oncotarget.4361.
[15] Xiao C, Wu CH, Hu HZ. LncRNA UCA1 promotes epithelial-mesenchymal transition (EMT) of breast cancer cells via enhancing Wnt/beta-catenin signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2016, 20(13):2819-2824.
[16] Xue M, Pang H, Li X, et al. Long non-coding RNA urothelial cancer-associated 1 promotes bladder cancer cell migration and invasion by way of the hsa-miR-145-ZEB1/2-FSCN1 pathway[J]. Cancer Sci, 2016, 107(1):18-27.DOI: 10.1111/cas.12844.
(本文编辑:屠振兴)
10.3760/cma.j.issn.1674-1935.2017.04.010
230001 合肥,安徽医科大学附属省立医院消化内科
许朝,Email: xuchaoseu@126.com
2016-07-02)

