胰腺癌合并糖尿病患者放疗后血糖变化及预后分析
李勇 潘绵顺 邱书珺 邵显军 张丽 陈磊
胰腺癌合并糖尿病患者放疗后血糖变化及预后分析
李勇 潘绵顺 邱书珺 邵显军 张丽 陈磊
胰腺癌发病隐匿,恶性程度高,早期诊断困难,在确诊时约有50%的患者出现远处转移,约29%的患者出现局部或区域扩散,只有3%的患者局限于胰腺。能手术切除的患者低于总数的15%,且术后5年生存率与肿瘤的大小和分期直接相关,肿瘤中位直径为32 mm的患者5年生存率为10%~20%,小于20 mm为30%~60%,若小于10 mm术后5年生存率则大于75%,不能行手术的患者平均生存时间只有4~6个月[1-2]。因此,早期诊断和治疗是决定胰腺癌预后的最关键因素。有研究表明,胰腺癌在明确诊断前或确诊时常并发糖尿病,而且部分患者胰腺癌经有效控制后,与之伴随的血糖升高也恢复正常。因此,糖尿病可能是胰腺癌的一种临床表现。本研究回顾性分析胰腺癌合并糖尿病的患者中糖尿病与胰腺癌的关系,为早期诊断和治疗胰腺癌提供帮助。
一、资料与方法
1.一般资料:回顾性分析2006年8月至2014年8月间在武警部队肿瘤放射诊疗中心住院的经手术活检或穿刺病理证实的不宜行手术切除的胰腺癌Ⅱ~Ⅲ期(T3-4N0-1M0)合并糖尿病患者65例,所有患者空腹血糖>7.0 mmol/L,符合美国糖尿病学会糖尿病诊断标准。所有患者根据糖尿病病程分为3组:病程<24个月组(包括胰腺癌诊断同时发现糖尿病)36例;24~48个月组19例;病程>48个月组10例。
2.治疗方式:所有患者均接受了X射线或伽玛射线立体定向放射治疗(SGS-Ⅰ型伽玛射线全身治疗系统),患者以真空负压袋固定体位,螺旋CT扫描获得定位图像,肿瘤靶区(gross tumor volume, GTV)包括胰腺原发病灶及后腹膜转移淋巴结,GTV外扩10 mm形成计划靶区(planning target volume, PTV),治疗剂量3~3.5 Gy/次,5次/周,肿瘤边缘总剂量38.5~45 Gy,相应边缘生物剂量为52~58 Gy。肿瘤复发或转移后各组患者接受不同疗程的化疗,方案为第1、8天吉西他滨(GEM) 1 000 mg/m2+第1~14天卡培他滨(CAP) 2 000 mg/m2,28 d为1周期。
3.评价标准:所有患者自放疗结束至肿瘤复发或转移之前未行其他抗肿瘤治疗,初次随访时间为放疗后2~3个月。胰腺癌疗效评估标准(WHO):(1)完全缓解(complete response, CR):病灶完全消失超过1个月。(2)部分缓解(partial response, PR):肿瘤最大直径及最大垂直直径的乘积缩小达50%以上,持续超过1个月。(3)稳定(stable disease, SD):病变两径乘积缩小不超过50%,增大不超过25%,持续超过1个月。(4)进展(progressive disease, PD):病变两径乘积增大超过25%。肿瘤达CR+PR患者为控制有效例数,肿瘤为SD+PD患者为肿瘤控制无效例数。每例患者均记录空腹血糖的变化,应用降糖药物的患者记录药量改变情况,且根据不同药物的半衰期检测其停用药物1~3 d的空腹血糖值。根据美国糖尿病学会标准,经有效治疗后血糖≤6.0 mmol/L,且不再应用降糖药物定为糖尿病痊愈。
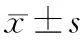
二、结果
1.各组患者的相关临床特征分析:各组患者的年龄、性别、症状、肿瘤部位、肿瘤分期及化疗疗程差异均无统计学意义(表1)。
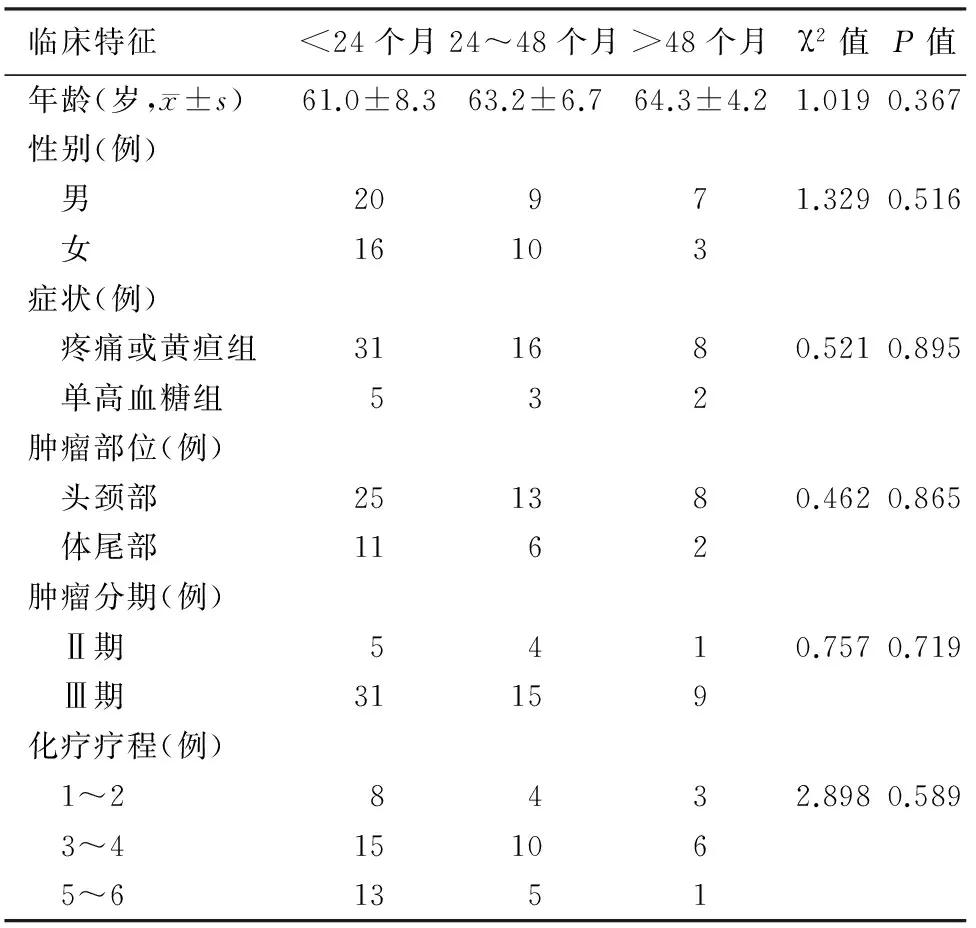
表1 各组患者的相关临床特征比较
2.不同糖尿病病程的胰腺癌患者治疗后血糖的变化情况:病程<24个月、24~48个月、>48个月患者肿瘤控制率分别为77.8%(28/36)、84.2%(16/19)、80.0%(8/10),各组之间差异无统计学意义;糖尿病治愈率分别为41.7%(15/36)、10.5%(2/19)、0,病程<24个月者的治愈率显著高于24~48个月及>48个月组(P值分别为0.030、0.019),而24~48个月与>48个月组间的差异无统计学意义。
3.胰腺癌合并糖尿病患者的生存时间:至随访结束,有9例患者存活,其中糖尿病病程24个月以内组5例,24~48个月组3例,>48个月组1例,不同病程组间的差异无统计学意义(χ2=2.214,P=0.331,图1);但10例胰腺癌伴单纯糖尿病患者较55例伴有疼痛或黄疸的患者预后更好(中位生存期18.0个月比9.7个月,χ2=8.947,P=0.003,图2)。
讨论 流行病学证据表明,糖尿病患者对某些癌症的发生及死亡风险增加,其中最常见的是胰腺癌[3]。Li等[4]分析了3个大型临床对照研究的2 192例糖尿病患者与5 113例对照患者的临床资料,发现糖尿病患者患胰腺癌的相对风险为1.8(95%CI=1.5~2.1),且随糖尿病病史的延长发病风险逐渐下降,而拉丁美洲和亚洲人群患糖尿病相关胰腺癌发生的风险更高,但不同人群的差异无统计学意义。该研究认为,尽管长期糖尿病患者随着病史的延长胰腺癌的发病风险降低,但仍是独立于肥胖和吸烟以外的胰腺癌的风险因素。

图1 不同糖尿病病程组的胰腺癌患者的生存曲线
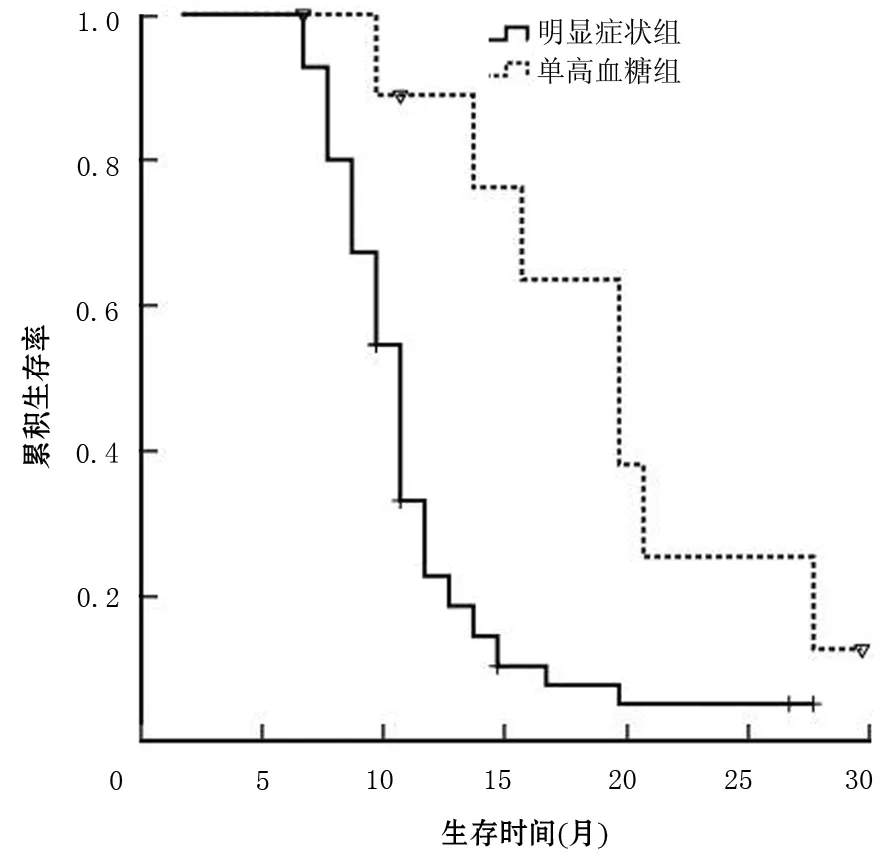
图2 胰腺癌伴单纯糖尿病组及伴有疼痛或黄疸组患者的生存曲线
Stevens等[5]系统回顾了3个队列研究和6个病例对照研究,结果显示Ⅰ型糖尿病患者和年轻的糖尿病患者,胰腺癌的发病相对风险是2.0(95%CI=1.37~3.01),明显高于非糖尿病患者。关于糖尿病导致胰腺癌的可能机制如下:(1)糖尿病患者葡萄糖代谢相关基因的改变增加了个体对胰腺癌的易感性。Dong等[6]从5个葡萄糖代谢相关基因中获得了26个单核苷酸多肽序列,在1 654例胰腺癌患者与1 182例非胰腺癌患者之间进行对照研究,发现己糖激酶2(HK2)R844K GA/AA基因型使糖尿病患者胰腺癌的易感性明显增加(OR=3.69; 95%CI=2.34~5.82)。此外,胰岛素样生长因子(insulin-like growth factor,IGF)轴的基因变异可使胰腺癌患者有更差的预后[7]。(2)糖尿病患者促胰腺癌相关蛋白表达增加。糖尿病患者因存在不同程度的胰岛素抵抗,外周胰岛素呈高水平状态,胰岛素及IGF-1均可与IGF-1受体结合,使受体后酪氨酸激酶发生磷酸化而激活下游信号通路,最终促进胰腺细胞有丝分裂,刺激胰腺细胞恶性增殖、侵袭及转移[7]。另外,再生基因-α(regenerating gene-alpha,REG-α)蛋白在糖尿病胰腺癌患者的表达远高于非糖尿病胰腺癌患者,其在体内和体外实验中均被发现可促进细胞的增殖和恶性转化[8]。(3)高血糖。高血糖可使敏感细胞线粒体电子传递链产生过多的超氧化物,其可促进细胞的有丝分裂和过度增殖[9]。高血糖还降低抗氧化酶的活力,进而使胰腺癌细胞系BxPC-3、MIAPaCa-2和AsPC-1的倍增时间缩短[10]。
糖尿病是胰腺癌的高危因素,可促进胰腺癌的发生发展,但部分胰腺癌患者经有效治疗后,与之伴随的糖尿病也恢复正常。本研究发现所有胰腺癌伴糖尿病的患者经有效治疗后治愈率为26.2%(17/65),且糖尿病病史越短治愈率越高,因此糖尿病可能是胰腺癌的一种临床表现。
糖尿病与胰腺癌的诊断有时间相关性。Gullo等[11]发现,糖尿病与胰腺癌同时发现的占40%,在胰腺癌诊断前两年内发现者占16%。一项纳入了736例胰腺癌患者和年龄性别相似的1 875例对照的病例研究发现,在736位胰腺癌患者中符合糖尿病诊断的占40.2%(296/736),其中50%为新发糖尿病,而对照组只有19.2%(360/1 875)。胰腺癌组在肿瘤发现之前36个月,糖尿病的发病率与对照组无明显差别,距离诊断为胰腺癌时间越近糖尿病发生率越高(36~24个月P=0.04;24~12个月P<0.001;12~0个月P<0.001)[12]。吴建新等[13]研究发现约17%的胰腺癌患者在发现肿瘤占位病灶之前可能已有糖代谢异常,其中88.2%的患者出现在2年以内,临床上可将新近出现糖代谢异常作为早期诊断胰腺癌的重要线索。在本研究中,糖尿病史在24个月以内的胰腺癌患者所占比例达55.4%,远高于其他组,且随糖尿病病程的延长所占比例明显降低。经过立体定向放疗消除癌肿后,糖尿病史在24个月以内的胰腺癌患者中41.7%的糖尿病获得痊愈;而糖尿病史在24个月以上的患者则改善不明显。这种时间相关性表明,在胰腺癌明确诊断的前2年,已经发生了可能因胰腺癌导致的胰岛功能紊乱或糖耐量降低,这种糖尿病是继发的,是胰腺癌的并发症;而糖尿病病史大于24个月的患者,糖尿病可能主要是胰腺癌的促发因素。在动物实验中发现,把胰腺癌细胞系MIAPaCa2的培养上清液每天注射到免疫缺陷的小鼠腹腔,可导致血糖水平明显升高和糖耐量降低,而腹腔注射生理盐水的对照组则无此反应,表明胰腺癌细胞系的确分泌某种可溶性物质干扰葡萄糖的代谢,从而导致糖尿病的发生[14],其具体机制还需进一步研究。
临床上,大部分胰腺癌患者的初发症状是无痛性黄疸、腹部疼痛、消瘦腹泻和与之相关的血清肿瘤标志物的升高,此类症状的出现往往是不能手术切除和预后较差的标志。本研究中55例患者出现了上述典型症状,10例胰腺癌患者仅伴有单纯糖尿病。生存分析表明后者比前者有更好的预后,这10例中有8例是胰腺癌Ⅱ期患者,还未发展到局部明显侵袭而出现明显症状,糖尿病只是胰腺癌早期的一种临床表现。而继发糖尿病可能早于胰腺癌明确诊断前2年就可能发现,因此对于大于50岁无家族糖尿病史的新发糖尿病患者(尤其伴有消瘦者),应定期检查(包括血清肿瘤标志物CEA及CA19-9、腹部CT增强扫描或超声探查)以排除胰腺癌的可能性。
[1] Pannala R, Basu A, Petersen GM, et al. New-onset diabetes: a potential clue to the early diagnosis of pancreatic cancer. Lancet Oncol,2009,10(1):88-95. DOI: 10.1016/S1470-2045(08)70337-1.
[2] Werner J, Combs SE, Springfeld C, et al. Advanced-stage pancreatic cancer: therapy options. Nat Rev Clin Oncol,2013,10(6):323-33. DOI:10.1038/nrclinonc.2013.66.
[3] Giovannucci E, Harlan DM, Archer MC, et al. Diabetes and cancer: a consensus report[J]. Diabetes Care, 2010, 33(7):1674-1685. DOI: 10.2337/dc10-0666.
[4] Li D, Tang H, Hassan MM, et al. Diabetes and risk of pancreatic cancer: a pooled analysis of three large case-control studies[J]. Cancer Causes Control, 2011,22(2):189-197. DOI:10.1007/s10552-010-9686-3.
[5] Stevens RJ, Roddam AW, Beral V. Pancreatic cancer in type 1 and young-onset diabetes: systematic review and meta-analysis[J]. Br J Cancer,2007,96(3):507-509. DOI: 10.1038/sj.bjc.6603571.
[6] Dong X, Li Y, Chang P, et al. Glucose metabolism gene variants modulate the risk of pancreatic cancer[J]. Cancer Prev Res,2011,4(5):758-766. DOI: 10.1158/1940-6207.CAPR-10-0247.
[7] Dong X, Javle M, Hess KR, et al. Insulin-like growth factor axis gene polymorphisms and clinical outcomes in pancreatic cancer[J]. Gastroenterology,2010,139(2):464-473. DOI: 10.1053/j.gastro.2010.04.042.
[8] Zhou L, Zhang R, Wang L, et al. Upregulation of REG Ialpha accelerates tumor progression in pancreatic cancer with diabetes[J].Int J Cancer,2010,127(8):1795-1803. DOI: 10.1002/ijc.25188.
[9] Brownlee M. Biochemistry and molecular cell biology of diabetic complications[J]. Nature,2001, 414(6865):813-820. DOI: 10.1038/414813a.
[10] Cullen JJ, Weydert C, Hinkhouse MM, et al. The role of manganese superoxide dismutase in the growth of pancreatic adenocarcinoma[J]. Cancer Res,2003,63(6):1297-1303.
[11] Gullo L, Pezzilli R, Morselli-Labate AM. Diabetes and the risk of pancreatic cancer[J]. N Engl J Med, 1994, 331(2):81-84. DOI: 10.1056/NEJM199407143310203.
[12] Chari ST, Leibson CL, Rabe KG, et al. Pancreatic cancer-associated diabetes mellitus: Prevalence and temporal association with diagnosis of cancer[J]. Gastroenterology, 2008,134(1):95-101. DOI: 10.1053/j.gastro.2007.10.040.
[13] 吴建新,孟祥军,李定国,等. 糖代谢异常与胰腺癌的早期临床表现[J]. 中华医学杂志,2002,82(5):312-314. DOI:10.3760/j:issn:0376-2491.2002.05.008.
[14] Basso D, Brigato L, Veronesi A, et al. The pancreatic cancer cell line MIAPaCa2 produces one or more factors able to induce hyperglycemia in SCID mice[J]. Anticancer Res, 1995,15(6B):2585-2588.
(本文编辑:冀凯宏)
10.3760/cma.j.issn.1674-1935.2017.04.011
吴阶平医学基金会专项基金资助项目(TNB1005)
201103 上海,武警部队肿瘤放射诊疗中心,武警上海总队医院
潘绵顺,Email: panmianshun@126.com
2016-08-02)

