急性胰腺炎合并感染性坏死的诊治策略
吴东 钱家鸣
·综述与讲座·
急性胰腺炎合并感染性坏死的诊治策略
吴东 钱家鸣
大部分急性胰腺炎(AP)患者病情较轻,对症治疗可完全恢复,少数患者病情较重,有不同程度的器官衰竭和局部并发症,需接受重症监护治疗,病死率达20%~30%[1-2]。目前AP缺少特异性药物,在病程早期阶段仅有液体复苏、止痛和肠内营养等支持治疗[3]。15%~20%的AP患者可发生胰腺(胰周)坏死,即急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP),临床处理的难度明显增加[4-5]。在ANP中,由于肠黏膜屏障功能受损和肠道细菌易位,约1/3的患者可继发感染,被称为感染性坏死(infected necrosis, IN)。急性胰周液体积聚或假性囊肿也可继发IN,但发生率较低。合并IN的患者往往比无菌性坏死病情更重,预后更差[5]。IN好发于ANP起病1~2周之后,但可见于病程的任何阶段,导致全身炎症反应、感染性休克、多脏器功能衰竭,甚至死亡[6]。大量研究证实,与持续性器官衰竭相似,IN也是AP不良预后的独立危险因素[6-8]。
抗生素是IN的首要治疗措施,少数IN患者应用抗生素即可控制病情,但多数仍需通过介入、内镜或手术等方法进行坏死组织引流和清创。目前,采用“升阶梯”的策略尽可能选择微创方法治疗IN已成为学术界共识,外科开放清创术应用逐渐减少[9-10]。IN的识别、诊断和治疗有一定难度,患者个体差异大,加之高质量研究证据较少,不同医院及医师之间诊疗实践差别明显,因此IN已成为制约AP成功救治的“瓶颈”因素[11-12]。本文根据近年来临床研究进展,简要介绍IN的诊疗策略,特别是如何在病程不同阶段合理选择治疗方式。
一、诊断方法
由于无菌性坏死也可造成发热、心率增快、血白细胞升高等全身炎症反应,与IN不易鉴别,在病初1~2周尤其如此,因此需要仔细观察患者的症状和体征,特别是动态监测临床表现可以为诊断提供线索。例如,当AP患者病情突然恶化、新出现发热或脓毒血症,或器官衰竭加重时,应高度怀疑IN,此时需尽快完善检查并开始经验性抗生素治疗[11,13]。CT检查发现“气泡征”对IN有诊断意义,但其敏感性仅为42%[13]。需要强调的是,“气泡征”可源于感染性坏死物中细菌产气,也可能提示胃肠道瘘,需提高警惕以避免漏诊后者。
细针穿刺(fine needle aspiration, FNA)是诊断IN的有效手段,其特异性很高(95%~100%),但敏感性稍低(约80%)[14]。近年来FNA的应用逐渐减少,原因包括以下几个方面:(1)FNA系有创检查,操作不便。(2)研究证实,通过观察临床表现并结合CT征象,可检出80%~90%的IN,诊断效力与FNA相仿[13]。(3)FNA仅用于诊断,不能同时实现引流,若IN患者病情较重,多数医师倾向于直接经皮引流,在首次引流的无菌操作中留取病原学标本送检。因此,FNA适用于临床怀疑IN但其他方法无法明确时,尤其是需要获得病原学资料以调整抗生素方案的患者。
目前主张尽量待IN包裹局限(AP起病4周后)后再行介入或手术处理,有利于坏死物液化以提高引流效果,同时减少出血等操作并发症。因此,重症AP病程早期(起病1~2周)的主要治疗目标是维护器官功能,若临床及影像表现未提示感染,通常不必行FNA检查。若病程早期IN明确,则先给予针对性抗生素治疗,若有效可推迟介入或手术治疗[2-3]。
二、治疗策略
尽管重症AP合并IN的风险较高,但多项随机对照研究未证实预防性应用抗生素的效果,故国内外指南均不推荐常规应用抗生素来预防IN[2-3,11]。胰腺感染的致病菌主要为革兰阴性菌和厌氧菌,因此对于确诊IN的患者,应选择胰腺局部药物浓度较高、对上述病原体效果较好的抗生素,包括喹诺酮、青霉素-β内酰胺类、头孢菌素、碳青霉烯类、甲硝唑等。常用的方案包括单用碳青霉烯类或青霉素-β内酰胺酶抑制剂,或联合第三代头孢菌素及甲硝唑,以及喹诺酮联合抗厌氧菌[2,11]。
约1/3的IN患者单纯抗生素治疗即可收效,不必实施引流或清创术[10]。应用抗生素需遵循“降阶梯”的原则,以避免细菌耐药。疗程一般为7~14 d,特殊情况下可延长应用时间[2,11]。IN患者较长时间使用广谱抗生素,需警惕细菌耐药、肠道菌群紊乱和继发真菌感染等问题。当无法用细菌感染来解释发热,或常规抗生素治疗无效时,应怀疑真菌感染,必要时可经验性应用抗真菌药物,同时积极完善病原学检查。
以往认为IN是外科清创手术的指征。但外科手术本身创伤较大,容易加剧炎症反应造成病情恶化,围术期病死率(40%)和并发症率(95%)相对较高[15]。近年来微创治疗的理念日益深入人心,越来越多的学者主张采用“升阶梯”的策略来控制IN[9,10,12]。所谓“升阶梯”,是指先在超声或CT引导下实施经皮导管引流(PCD),视IN范围常放置多根引流管并冲洗,约1/3的IN患者经PCD即可治愈;若PCD不能完全控制IN,再应用视频辅助下腹膜后清创术(VARD)、腹腔镜手术或小切口手术等进一步清除坏死感染组织[9-10]。van Santvoort等[10]报道,升阶梯治疗组虽然与开放手术组病死率差异无统计学意义(16%比19%),但显著减少了严重并发症(40%比69%)、多器官功能衰竭(12%比40%)以及新发糖尿病(16%比38%)。经内镜清创术(PEN)是近年来开始兴起的一种微创方法,采用超声内镜引导下经穿刺胃壁进入IN,直视下清除脓肿坏死物,也可应用塑料或金属支架引流IN。Bakker等[16]报道,PEN治疗组的联合终点事件(主要并发症或死亡,20%比80%)、多器官衰竭(0比50%)及胰瘘(10%比70%)的发生率均低于开放手术组,且PEN术后炎症反应亦较轻,初步显示了很好的应用前景。但PEN要求IN离胃壁较近且相对包裹,因此病程早期难以实施,加之对术者技术及经验要求较高,目前还难以广泛开展。需要指出的是,无论PCD、PEN或微创手术均以控制全身脓毒血症为主要目的,不追求大量清除坏死物,其出发点是以损伤最小的局部治疗换来整体病情的相对稳定,为后续治疗赢得时间。当然,在具体临床工作中,若IN不具备经皮或经胃穿刺路径,或其他方法引流效果不好时,仍应选择开放手术治疗。
三、干预时机
关于何时是IN最佳引流时机,学术界争议较大。目前指南或共识仍推荐“延期”原则,即先应用抗生素治疗,尽量等待IN成熟形成包裹性坏死(WON)后,视病情需要再实施引流[3,17-18]。形成WON通常需要至少4周时间,这就意味着在病初2~3周内,若患者病情允许则尽量避免干预IN[3]。这样做理论上的好处是形成WON后感染坏死物充分液化,可提高引流效果,另外IN机化包裹后与周边正常组织界限相对清楚,有助于减少操作并发症如出血、肠瘘等。
然而,支持上述观点的证据几乎均来自早期开放外科手术的相关研究[9,19]。考虑到微创治疗如PCD等本身损伤较小,对患者内环境影响有限,是否仍有必要和传统手术一样延期实施值得商榷。支持早期干预IN的理由包括:(1)早期引流有助于及时控制脓毒血症,缩短病程;(2)IN是AP器官衰竭的危险因素,二者同时存在时病死率最高,因此尽早控制IN可能有助于维护器官功能,改善预后;(3)一部分IN患者通过早期引流或许可避免外科手术;(4)对于起病急骤,病程初期即出现胰腺严重坏死、多脏器功能衰竭和腹腔间隔室综合征的危重AP,尽早引流或许是唯一的选择[9]。目前一项关于IN最佳干预时机的随机对照试验正在进行中,期待其结果能够早日发表[20]。根据以上讨论内容,结合文献证据和笔者经验将目前AP合并IN的治疗方法总结见图1[19,17]。
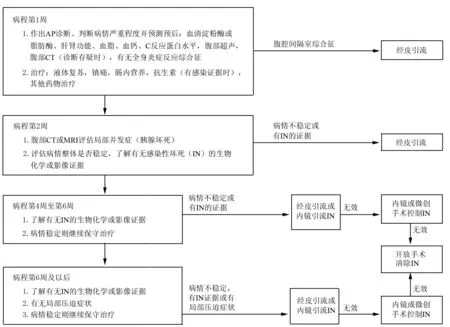
图1 急性胰腺炎合并感染性坏死的治疗方案
综上所述,IN是AP的严重并发症,可增加患者病死率并延长病程,值得临床高度重视。大多数IN患者可根据临床表现和影像学检查获得诊断,少数可能需依靠FNA等方法确诊。及时而合理的抗生素治疗是IN的首要处理,少数患者可通过药物治疗而恢复。对于需要引流的IN病例,应优先选择微创性方法,尽量延迟或避免开放外科手术。联合抗生素和经皮引流可成功治疗约2/3的IN患者,部分仍需手术。目前微创手术应用日益增多,包括视频辅助下腹膜后清创术(VARD)、腹腔镜手术或小切口手术等。经内镜引流和清除IN在未来有广阔的发展空间。IN的最佳干预时机目前尚不肯定,需结合患者病情进行个体化决策。
[1] Lankisch PG, Apte M, Banks PA. Acute pancreatitis[J]. Lancet, 2015, 386(9988): 85-96. DOI: 10.1016/S0140-6736(14)60649-8.
[2] 中国医师协会胰腺病学专业委员会. 中国急性胰腺炎多学科(MDT)诊治共识意见(草案)[J].中华胰腺病学杂志, 2015, 15(4): 217-224. DOI:10.3760/cma.j.issn. 1674-1935.2015.04.001
[3] Tenner S, Baillie J, DeWitt J, et al. American College of Gastroenterology guideline: management of acute pancreatitis[J]. Am J Gastroenterol, 2013,108(9):1400-1415. DOI: 10.1038/ajg.2013.218.
[4] Johnson CD, Abu-Hilal M. Persistent organ failure during the first week as a marker of fatal outcome in acute pancreatitis[J]. Gut, 2004, 53(9): 1340-1344.
[5] Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis -2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1):102-111.DOI: 10.1136/gutjnl-2012 -302779.
[6] Petrov MS, Shanbhag S, Chakraborty M, et al. Organ failure and infection of pancreatic necrosis as determinants of mortality in patients with acute pancreatitis[J]. Gastroenterology, 2010, 139(3): 813-820. DOI: 10.1053/j. gastro.2010.06.010.
[7] Dellinger EP, Forsmark CE, Layer P, et al. Determinant-based classification of acute pancreatitis severity: an international multidisciplinary consultation[J]. Ann Surg, 2012, 256(6): 875-880. DOI: 10.1097/SLA.0b013e318256f778.
[8] Zubia-Olaskoaga F, Maraví-Poma E, Urreta-Barallobre I, et al. Comparison between revised atlanta classification and determinant-based classification for acute pancreatitis in intensive care medicine. Why do not use a modified determinant-based classification[J]? Crit Care Med, 2016,44(5): 910-917. DOI: 10.1097/CCM.0000000000001565.
[9] van Grinsven J, van Santvoort HC, Boermeester MA, et al. Timing of catheter drainage in infected necrotizing pancreatitis[J]. Nat Rev Gastroenterol Hepatol, 2016, 13(5): 306-312. DOI: 10.1038/nrgastro.2016.23.
[10] van Santvoort HC, Besselink MG, Bakker OJ, et al. A step-up approach or open necrosectomy for necrotizing pancreatitis[J]. N Engl J Med, 2010, 362(16): 1491-1502.DOI:10.1056/NEJMoa0908821.
[11] 中华医学会消化病学分会胰腺疾病学组,《中华胰腺病杂志》编辑委员会,《中华消化杂志》编辑委员会.中国急性胰腺炎诊治指南(2013年,上海)[J].中华消化杂志, 2013,33(4):217-222. DOI: 10.3760/cma.j.issn.0254-1432.2013.04.001.
[12] van Grinsven J, van Brunschot S, Bakker OJ, et al. Diagnostic strategy and timing of intervention in infected necrotizing pancreatitis: an international expert survey and case vignette study[J]. HPB (Oxford), 2016, 18(1): 49-56. DOI: 10.1016/j.hpb.2015.07.003.
[13] van Baal MC, Bollen TL, Bakker OJ, et al. The role of routine fine-needle aspiration in the diagnosis of infected necrotizing pancreatitis[J]. Surgery, 2014, 155(3): 442-448. DOI: 10.1016/j.surg.2013.10.001.
[14] Gerzof SG, Banks PA, Robbins AH, et al. Early diagnosis of pancreatic infection by computed tomography-guided aspiration[J]. Gastroenterology, 1987, 93(6): 1315-1320.
[15] Rodriguez JR, Razo AO, Targarona J, et al. Debridement and closed packing for sterile or infected necrotizing pancreatitis: insights into indications and outcomes in?167 patients[J]. Ann Surg, 2008, 247(2): 294-299. DOI: 10.1097/SLA.0b013e31815b6976.
[16] Bakker OJ, van Santvoort HC, van Brunschot S, et al. Endoscopic transgastric vs surgical necrosectomy for infected necrotizing pancreatitis: a randomized trial[J]. JAMA, 2012, 307(10): 1053-1061. DOI: 10.1001/jama.2012.276.
[17] da Costa DW, Boerma D, van Santvoort HC, et al. Staged multidisciplinary step-up management for necrotizing pancreatitis[J]. Br J Surg, 2014, 101(1): e65-e79. DOI: 10.1002/bjs.9346.
[18] Freeman MF, Werner J, van Santvoort HC, et al. Interventions for necrotizing pancreatitis. Summary of a multi-disciplinary consensus conference[J]. Pancreas, 2012, 41(8): 1176-1194. DOI: 10.1097/MPA.0b013e318269c660.
[19] Besselink MG, Verwer TJ, Schoenmaeckers EJ, et al. Timing of surgical intervention in necrotizing pancreatitis[J]. Arch Surg, 2007, 142(12): 1194-201.
[20] van Brunschot S, van Grinsven J, Voermans RP, et al. Transluminal endoscopic step-up approach versus minimally invasive surgical step-up approach in patients with infected necrotising pancreatitis (TENSION trial): design and rationale of a randomised controlled multicenter trial [ISRCTN09186711][J]. BMC Gastroenterol, 2013, 13: 161. DOI: 10.1186/1471-230X-13-161.
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2017.04.017
100730 北京,中国医学科学院 北京协和医学院 北京协和医院消化科
钱家鸣,Email:qianjiaming1957@126.com
2016-07-19)

