FPTⅢ对哮喘大鼠气道平滑肌细胞分泌IL-6及Rantes的影响
李娜 邱晨 荀安营 季乐财 卓宋明
FPTⅢ对哮喘大鼠气道平滑肌细胞分泌IL-6及Rantes的影响
李娜 邱晨 荀安营 季乐财 卓宋明
目的 观察FPTⅢ对哮喘大鼠气道平滑肌细胞(ASMCs)分泌IL-6及Rantes的影响。方法 建立大鼠哮喘模型,采用酶消化法培养ASMCs,并经免疫组织化学、免疫荧光鉴定。取第3代ASMCs,设哮喘组、对照组,各分成5个亚组:对照空白组(不加任何干预剂)、对照PBS组(加入PBS)、对照诱导组(加入10ng/ml IL-1β、TNF-α、IFN-γ混合液)、对照干预A组(加入10μM的FPTⅢ)、对照干预B组(加入混合物刺激物24h,再加入10μM的FPTⅢ);哮喘空白组、哮喘PBS组、哮喘诱导组、哮喘干预A组、哮喘干预B组,干预方式与对照组相同。采用ELISA法检测各组ASMCs分泌IL-6及Rantes水平。 结果 α-Actin经荧光染色后呈绿色荧光,哮喘空白组较对照空白组荧光强度减弱。哮喘干预A、B组ASMCs分泌IL-6、Rantes水平均明显低于哮喘空白组(均P<0.05),且抑制效应呈时间依赖性。FPTⅢ浓度达5~10μM时,抑制作用达到最大。 结论 FPTⅢ干预可以使哮喘大鼠ASMCs分泌IL-6及Rantes减少,伴随细胞内α-Actin的变化,进一步导致细胞表型发生变化,为哮喘治疗提供新思路。
气道平滑肌细胞 FPTⅢ 哮喘
哮喘是由多种细胞和细胞组分参与的气道慢性炎症[1],气道重塑是慢性炎症的结构基础,气道平滑肌细胞(ASMCs)是重要的结构及功能细胞。ASMCs的增生肥大是哮喘气道重塑的显著特征之一,同时伴随着细胞表型转化发生。表型转化指细胞形态上发生改变的同时伴随合成分泌功能的改变。研究表明,p21Ras介导包括MAPK、PI3K在内的多条信号转导途径[2],它是哮喘气道炎症中的重要调节因子。FPTⅢ是法尼基蛋白转移酶抑制剂,可特异性阻止p21Ras蛋白定位于细胞膜,10μM时即可产生明显的抑制效果[3]。本实验采用FPTⅢ特异性阻止Ras定位,进而阻断其生物学效应,并改变FPTⅢ的作用时间及剂量,观察它对哮喘大鼠ASMCs分泌IL-6及Rantes的影响。
1 材料和方法
1.1 材料 成年SPF级SD雄性大鼠8只,6~8周龄,体重150~180g,由南方医科大学实验动物中心提供。卵清蛋白(OVA)、鼠抗平滑肌α-Actin单克隆抗体均购自美国Sigma公司;DMEM干粉培养基、标准胎牛血清均购自美国Gibico公司;D-Hanks干粉购自美国HyClon公司;SP免疫组化试剂盒、DAB显色试剂盒均购自北京中山生物技术有限公司;p21Ras抑制剂FPTⅢ购自美国Calbiochem公司;FTIC标记山羊抗小鼠IgG、大鼠IL-6 ELISA试剂盒均购自美国Bender MedSystems公司;大鼠Rantes ELISA试剂盒购自美国R&B公司;IL-1β、TNF-α、IFN-γ均购自美国peprotech公司。
1.2 方法
1.2.1 实验分组及模型制备[4-5]将8只大鼠按体重编号,采取随机数字表法分为两组,即哮喘组、对照组各4只。第1、8天,哮喘组腹腔注射10%OVA致敏液1ml,对照组注射等体积的0.9%氯化钠溶液;第15天起,将大鼠置于一密闭的有机玻璃容器(40cm×30cm×20cm)中,哮喘组用超声雾化器予1%OVA激发液雾化吸入,对照组予等量 0.9%氯化钠溶液雾化吸入;1次/d,30min/次,连续4周。
1.2.2 大鼠ASMCs的培养及纯化 参照Deng等[6]的方法加以改进,造模完成24h内处死大鼠。无菌分离气管、支气管,去内、外膜,将组织剪成1mm×1mm的组织块;加入0.2%Ⅰ型胶原酶,37℃消化30min;加入含20%胎牛血清的DMEM培养液。5~7d后传代培养,取第3代细胞用于后续实验。
1.2.3 大鼠ASMCs的鉴定 (1)免疫组织化学法:将第3代细胞按1×105个/ml接种于无菌盖玻片上,4%多聚甲醛固定,PBS冲洗,步骤参照试剂盒,晾干后中性树胶封片。(2)免疫荧光法:将第3代细胞按1×104个/ml接种于无菌盖玻片上,贴壁后取出,4%多聚甲醛固定20min,冲洗3min×3次;0.1%TritonX-100室温下渗透10min,PBS冲洗;滴加封闭山羊血清,室温孵育15min;滴加小鼠抗大鼠α-Actin抗体按1∶400稀释,37℃孵育3h,PBS冲洗,3min×3次;滴加FITC标记山羊抗小鼠荧光二抗(按1∶300稀释),室温孵育30min,PBS冲洗;在倒置相差显微镜、荧光显微镜下观察α-Actin的分布及含量;激发波与放射波波长分别为490、520nm。
1.2.4 ASMCs处理 取两组经鉴定的ASMCs。其中对照组分为5个亚组:对照空白组(不加任何干预剂)、对照PBS组(加入PBS)、对照诱导组(加入10ng/ml IL-1β、TNF-α、IFN-γ混合液)、对照干预A组(加入10μM的FPTⅢ)、对照干预B组(加入混合物刺激物24h,再加入10μM的FPTⅢ)。哮喘组分为5个亚组:哮喘空白组、哮喘PBS组、哮喘诱导组、哮喘干预A组、哮喘干预B组;各组干预方式与对照组相同。加入处理因素前24h换成含0.1%FCS的培养基培养,细胞上清液均于上述因素施加24h后收集。
1.2.5 时间、浓度效应的处理 将哮喘空白组细胞以1×105个/ml接种于24孔板中,贴壁后换用无血清培养基培养,分析不同预因素对ASMCs分泌功能的影响。按5、10、20、30、40M不同浓度加入p21Ras抑制剂作用24h,收集上清液,分析FPTⅢ的浓度效应;加入FPTⅢ10μM,于0、24、48、72h不同时段收集上清液,分析FPTⅢ的时间效应。
1.2.6 检测方法 采用ELISA法测定ASMCs分泌IL-6、Rantes水平,均参照试剂盒说明书进行操作。
1.3 统计学处理 应用SPSS 13.0统计软件。计量资料用表示,两组各亚间比较采用单因素方差分析,两两比较采用SNK-q检验;哮喘组与对照组比较,采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠ASMCs培养及鉴定结果 在倒置相差显微镜下,单个平滑肌细胞呈梭形或不规则三角形,有多个细胞突起,胞质丰富,密度高,核圆形居中。细胞密度低时常交织成网状,密度高时排列为旋涡状或栅栏状。α-Actin免疫细胞化学染色后,胞质内细肌丝沿长轴分布,呈阳性反应,鉴定培养的细胞为ASMCs,见图1(插页)。
2.2 α-Actin在ASMCs中的表达 α-Actin经荧光染色后,在荧光显微镜下呈绿色荧光。对照组荧光在胞质均匀分布;哮喘组细胞体积增大,细胞核亦有所增大。其中哮喘空白组荧光强度弱于对照空白组,哮喘空白组、哮喘诱导组荧光强度弱于哮喘干预A、B组,见图2(插页)。
2.3 FPTⅢ对ASMsC分泌IL-6及Rantes的影响 与对照空白组比较,对照其他各组大鼠ASMCs分泌IL-6水平变化均不明显(均P>0.05)。与对照空白组比较,哮喘空白组大鼠ASMCs分泌IL-6水平明显增加(P<0.05);哮喘诱导组变化不明显(P>0.05)。与哮喘空白组比较,哮喘干预A、B组IL-6水平均明显降低(均P<0.05)。
与对照空白组比较,对照诱导组大鼠ASMC分泌Rantes水平明显增加(P<0.05),对照PBS组、对照干预A组及B组分泌Rantes水平改变均不明显(均P>0.05)。与对照空白组比较,哮喘空白组大鼠ASMCs分泌Rantes水平明显增加(P<0.05);哮喘诱导组改变不明显(P>0.05)。与哮喘空白组比较,哮喘干预A、B组Rantes水平均明显降低(P<0.05),见表1。
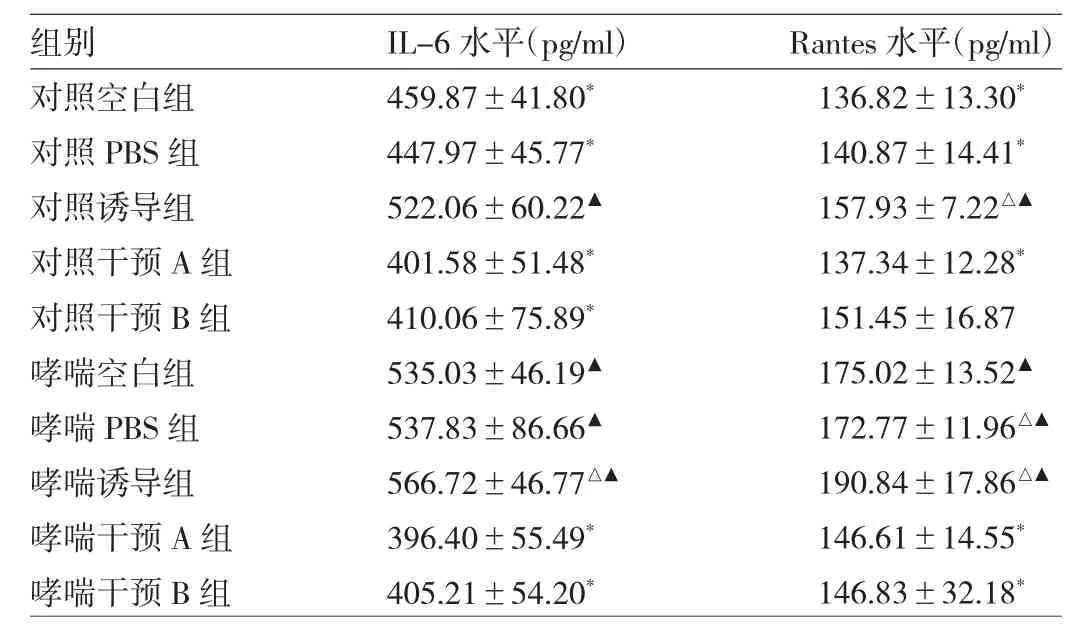
表1 FPTⅢ对ASMCs分泌IL-6及Rantes的影响
2.4 FPTⅢ对ASMCs分泌IL-6的时间、浓度效应 细胞初始同步化后,细胞分泌功能处于基础状态;p21Ras抑制剂干预后,哮喘空白组在24h后出现一个分泌高峰;继而随着时间增加,IL-6水平不断下降;即FPTⅢ可以抑制IL-6分泌,呈时间依赖性,见图3a。FPTⅢ浓度达5~10μM时,抑制作用最大;>10μM时,IL-6分泌增加,见图3b。
2.5 FPTⅢ对ASMCs分泌Rantes的时间、浓度效应细胞同步化后,哮喘空白组基础分泌水平24h达到高峰,继而出现下降,最后趋向平坦;经p21Ras抑制剂干预后,Rantes水平降低,72h达到最低点,其变化趋势与IL-6相似,呈时间依赖性,见图4a。对于哮喘空白组,5μM FPTⅢ的抑制效应最大,见图4b。
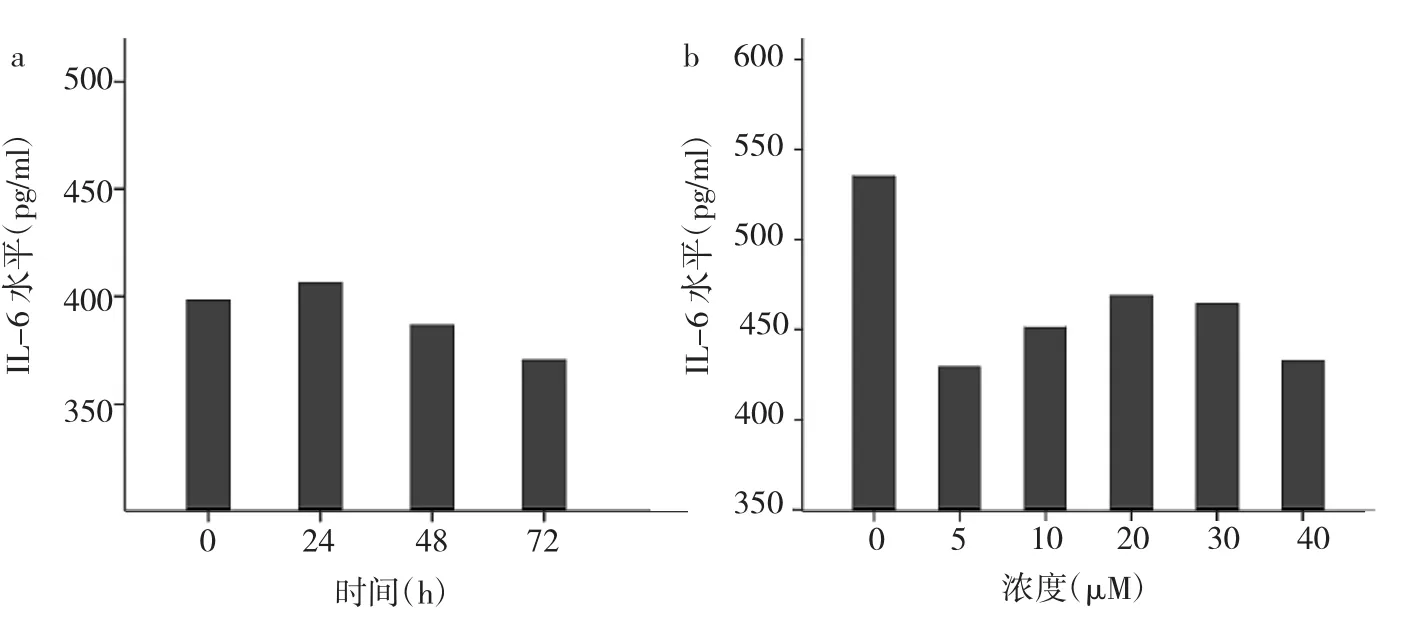
图3 FPTⅢ对ASMCs分泌IL-6的时间、浓度效应(a:时间效应;b:浓度效应)
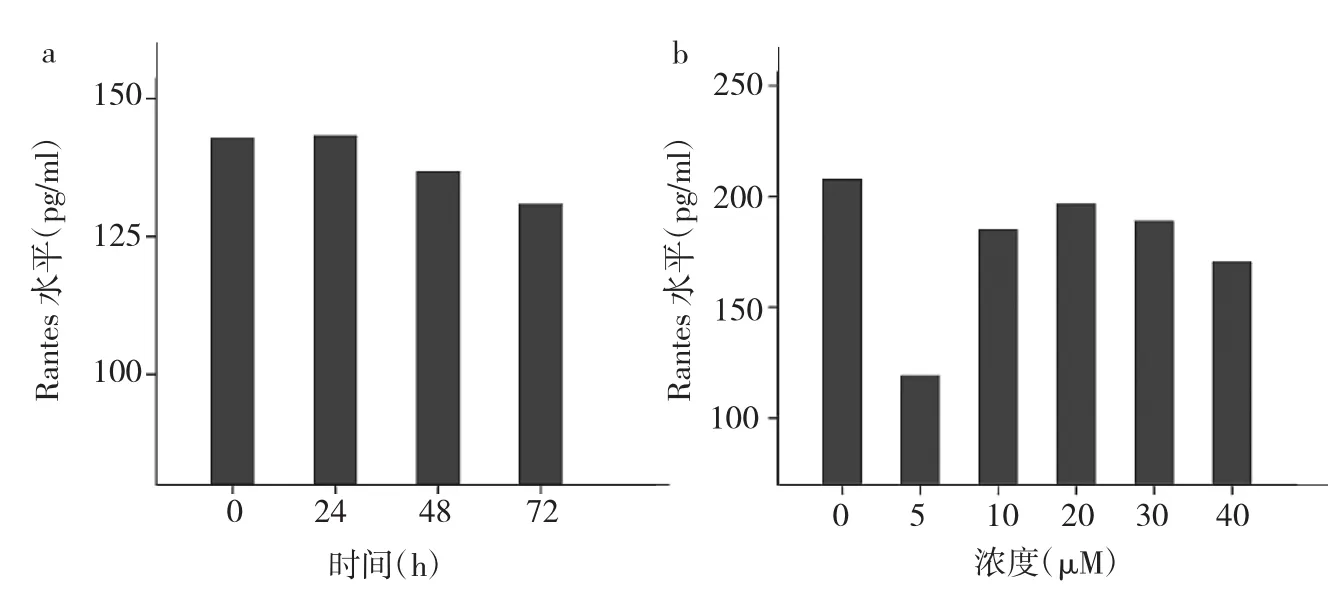
图4 FPTⅢ对ASMCs分泌Rantes的时间、浓度效应(a:时间效应;b:浓度效应)
3 讨论
α-Actin是细胞骨架微丝的基本蛋白,在平滑肌细胞中特异性表达,表型转化的标志蛋白,构成细胞支架、维持细胞基本形状,参与细胞变形运动、细胞迁移,介导细胞内信号传递及参与蛋白质的合成等[7]。本实验通过免疫组化鉴定、免疫荧光观察,发现FPTⅢ会影响ASMCs形态改变(细胞骨架蛋白α-Actin的变化)。IL-6是一种具有广泛生物学活性的细胞因子,是炎性细胞分化的主要调节因子。ASMCs是其产生的重要来源[8]。本实验发现对照空白组与对照其他各组比较,ASMCs分泌IL-6水平差异均无统计学意义;这表明正常细胞对于炎症介质刺激及FPTⅢ干预的灵敏度均不高,提示FPTⅢ干预对于正常ASMCs无明显影响。哮喘大鼠较正常大鼠ASMCs的IL-6基础分泌水平明显增加,提示感染等刺激因素作用于机体时,p21Ras的激活参与IL-6异常分泌,启动补体及C反应蛋白的表达,产生细胞损害,进一步导致炎性反应的加剧[9],对哮喘气道重塑平滑肌表型起重要作用[10]。
哮喘诱导组ASMCs分泌的IL-6水平增加,但与哮喘空白组比较差异无统计学意义;推测哮喘组由于ASMCs长期接受炎症介质刺激已充分活化,在此基础上即使进一步刺激,细胞分泌功能改变也不明显,可能是定位于细胞膜的p21Ras已经达到或接近饱和状态;与哮喘空白组比较,哮喘干预A、B组IL-6水平均明显降低,提示FPTⅢ干预可抑制哮喘大鼠ASMCs的IL-6分泌。由此,笔者认为FPTⅢ对正常ASMCs合成分泌IL-6影响并不明显;但在病理状态下p21Ras已被激活,在此基础上进行干预,会产生明显的抑制效果,即对于哮喘ASMCs分泌合成IL-6起到重要的调控作用。此外,本研究观察了FPTⅢ对ASMCs分泌IL-6及Rantes的时间、浓度效应。当FPTⅢ浓度为10~20μM时,IL-6水平增加,可能由于抑制了Ras途径,同时激活了其他旁路途径,当FPTⅢ浓度进一步增加时,IL-6分泌减少,考虑与FPTⅢ细胞毒性有关。目前IL-6基因表达被认为至少有2条信号转导通路可触发,一条依赖蛋白激酶C(PKC)途径,一条依赖腺昔酸环化酶途径,以上2条途径均以Ras/MAPK为共同通路[11]。由此,该试验也证实了Ras/MAPK途径参与了ASMCs的IL-6分泌。值得注意的是,体外实验与在体情况存在差异,体内是否也存在类似现象尚需进一步研究。
ASMCs不仅能分泌炎症介质,也能分泌趋化因子。受激活调节正常T细胞表达和分泌因子(RANTES)是趋化性细胞因子cc亚族成员(CCL5),参与调节机体的免疫应答[12]。该实验结果显示,经诱导后,对照空白组分泌Rantes水平明显增加,表明正常ASMCs可以通过外界炎症介质的刺激增强分泌合成功能;哮喘空白组较对照空白组分泌Rantes水平明显增加,说明哮喘ASMCs的分泌功能较正常ASMCs增强,基础分泌水平更高;FPTⅢ干预后,哮喘空白组分泌Rantes水平明显减少,提示FPTⅢ干预也会影响哮喘ASMCs的Rantes分泌。通过比较对照PBS组、哮喘PBS组与对照空白组及哮喘空白组的差异,可排除施加外界干预因素所造成的影响。
综上所述,FPTⅢ对正常大鼠ASMCs分泌IL-6、 Rantes的影响不明显,而对于哮喘大鼠ASMCs分泌IL-6、Rantes则有抑制作用,可能是哮喘气道炎症中调节免疫的重要因素。
[1] Borish L.The immunology of asthma:Asthma phenotypes and their implications for personalized treatment[J].Ann Allergy Asthma Immunol,2016,117(2):108-114.
[2] Guenther M K,Graab U,Fulda S.Synthetic lethal interaction between PI3K/Akt/mTOR and Ras/MEK/ERK pathway inhibition in rhabdomyosarcoma[J].Cancer Lett,2013,337(2):200-209.
[3] Richard T,Buckner F S,Yokoyama K,et al.Thematic review series: lipid posttranslational modifications.Fighting parasitic disease by blocking protein farnesylation[J].Journalof Lipid Research,2006, 47(2):233-240.
[4] 许淑云,徐永健.支气管哮喘模型大鼠气道重建的特征及机制[J].华中科技大学学报(医学版),2006,35(4):465-468
[5] 高伟良,邱晨,袁庆莉,等.哮喘大鼠模型气道重构的病理形态学改变[J].广东医学,2006,27(2):176-178.
[6] Deng L H,Fairbank N J,Fabry B,et al.Localized mechanical stress induces time-dependent actin cytoskeletal remodeling and stiffening in cultured airway smooth muscle cells[J].Am J PhysiolCellPhysiol,2004,287(2):440-448.
[7] Kühn S,Mannherz H G.Actin:structure,function,dynamics,and interactions with bacterial toxins[J].Curr Top Microbiol Immunol, 2016,16:45.
[8]Charalambos M,Maria B S,Nadia M,et al.TGF-β regulates Nox4,MnSOD and catalase expression,and IL-6 release in airway smooth muscle cells[J].Am J Physiol Lung Cell Mol Physiol, 2011,300(2):295-304.
[9] Steven P O,Patrick L S,Christy E.Cholangiocyte N-Ras protein mediates lipopolysaccharide-induced interleukin 6 secretion and proliferation[J].J BiolChem,2011,286(35):30352-30360.
[10] Gautam D,Reynold A,Panettieri Jr.Does airway smooth muscle express an inflammatory phenotype in asthma?[J].Br J Pharmacol,2011,163(1):68-80.
[11] Ugo Moens,Sergiy Kostenko,Baldur Sveinbjo rnsson.The role of mitogen-activated protein kinase-activated protein kinases (MAPKAPKs)in inflammation[J].Genes(Basel),2013,4(2): 101-133.
[12] Donatella Aldinucci,Alfonso Colombatti.The inflammatory chemokine CCL5 and cancer progression[J].Mediators Inflamm, 2014,2:292-376.
Effects of FPTⅢ on the secretion of IL-6 and Rantes in airway smooth muscle cells of asthmatic rats
LI Na,QIU Chen,XUN Anying,et al.Department of Respiratory Medicine,Longgang District Central Hospital of Shenzhen,Shenzhen 518116,China
Airway smooth muscle cells FPTⅢ Asthma
2017-02-15)
(本文编辑:陈丹)
10.12056/j.issn.1006-2785.2017.39.14.2017-288
深圳市龙岗区科技计划项目(201505143001004)
518116 深圳市龙岗中心医院呼吸内科(李娜、季乐财、卓宋明);暨南大学第二临床医学院呼吸内科(邱晨);北京大学深圳医院内科(荀安营)
李娜,E-mail:lanying5204@sina.com
【 Abstract】 Objective to investigate the effects of FPTIII on the secretion of IL-6 and Rantes in airway smooth muscle cells of asthmatic rats. Methods To establish the rat model of asthma,the enzyme digestion method is adopted to cultivate airway smooth muscle cells,identified by immunohistochemistry and immunofluorescence.After using p21Ras specific inhibitor FPTIII intervention,IL-6 and Rantes were determinated by ELISA.The intracellular distribution of α-Actin was observed by fluorescence microscopy. Results The fluorescence intensity of α-Actin was stained by fluorescence,and the fluorescence intensity of the blank group was weaker than that of the control group.Secretion of IL-6 and Rantes were significantly decreased (P<0.05)in asthmatic group after using FPTⅢ,and the inhibitory effect was time-dependent.When the concentration of FPTⅢwas up to 5-10 M,the inhibitory effect reached the maximum. Conclusion FPTⅢintervention can make the asthmatic rat airway smooth muscle cells secreting IL-6 and Rantes decreased,accompanied by intracellular α-Actin changes,which further leads to the change of cell phenotypes,provide new ideas for the treatment of asthma.

