HIF-1α介导上调BNIP3在蛛网膜下腔出血后早期皮层神经元凋亡中的作用机制
胡强 俞文华 陈高 杜权
HIF-1α介导上调BNIP3在蛛网膜下腔出血后早期皮层神经元凋亡中的作用机制
胡强 俞文华 陈高 杜权
目的 探讨缺氧诱导因子-1α(HIF-1α)、BNIP3在蛛网膜下腔出血(SAH)后早期皮层神经元凋亡中的作用机制。方法 采用颈内动脉穿刺法建立SAH大鼠模型,设SAH组、2-甲氧雌二醇(2ME2)组和假手术(sham)组,每组10只。造模后24h对SAH大鼠神经功能进行评价;取大鼠脑组织,采用TUNEL法检测凋亡指数,免疫荧光染色检测HIF-1α的组织细胞定位,Western blot检测HIF-1α、BNIP3蛋白表达水平。 结果 与sham组比较,造模后24h SAH组大鼠脑组织中HIF-1α、BNIP3蛋白表达水平均明显升高(均P<0.05),凋亡指数明显增高(P<0.05),神经功能评分明显降低(P<0.05)。与SAH组比较,2ME2组大鼠脑组织中HIF-1α、BNIP3蛋白表达水平均明显下降(均P<0.05),凋亡指数明显下降(P<0.05),神经功能评分明显升高(P<0.05)。HIF-1α主要定位表达于神经元。 结论 HIF-1α介导上调BNIP3并参与了SAH后早期皮层神经元凋亡过程。
蛛网膜下腔出血 缺氧诱导因子-1α 凋亡 BNIP3
蛛网膜下腔出血(SAH)具有较高的致残率、病死率,约85%由颅内动脉瘤破裂所致[1]。目前治疗手段(手术夹闭、介入栓塞)以及神经影像技术等不断进步,然而SAH患者预后改善并不显著。近年来研究表明早期脑损伤(EBI)与SAH患者高风险致残、病死等密切相关,及时对EBI进行有效干预可能改善患者预后[2-4]。EBI涉及一系列病理、生理变化,具体发病机制尚不清楚,现有研究指出细胞凋亡在SAH后EBI中发挥重要作用[5-6]。相关文献报道缺氧诱导因子-1α(HIF-1α)在SAH后脑组织表达明显增多[7-8],但它在SAH后EBI中的具体机制尚未清楚。BNIP3是HIF-1α的重要靶基因之一,它是Bcl-2家族蛋白,参与细胞凋亡过程。本研究通过建立SAH大鼠模型,并予HIF-1α抑制剂干预,检测大鼠脑组织HIF-1α和BNIP3表达水平、细胞凋亡情况、神经功能评分及HIF-1α的组织细胞定位,以初步探讨HIF-1α、BNIP3在SAH后早期皮层神经元凋亡中的作用机制。
1 材料和方法
1.1 实验动物及主要试剂 健康雄性SD大鼠30只,月龄2~3个月,体重280~320g,均购于上海斯莱克实验动物中心;按照随机数字表法分为SAH组、2-甲氧雌二醇(2ME2)组和假手术(sham)组,每组10只。2ME2、二甲亚砜、多聚甲醛均购自美国Sigma公司,TUNEL试剂盒和4′,6-二脒基-2-苯基吲哚(DAPI)均购自美国Roche公司,兔抗HIF-1α和小鼠抗BNIP3一抗均购自Abcom公司,小鼠抗胶质纤维酸性蛋白(GFAP)、小鼠抗神经元特异性核蛋白(NeuN)一抗均购自美国Millipore公司,TRITC标记羊抗兔和FITIC标记羊抗小鼠二抗均购自北京中杉金桥公司,荧光显微镜购自日本Olympus公司。
1.2 SAH造模及评价 本研究采用颈内动脉穿刺法制作SAH模型。大鼠经麻醉后取颈部正中入路,充分显暴右侧颈外动脉(ECA)、颈内动脉(ICA)及颈总动脉(CCA)。结扎并切断ECA远端,取单股尼龙线从ECA轻轻插入ICA颅内段,刺破血管壁,造成SAH,拔出尼龙线,用丝线结扎颈外动脉残端,严密缝合颈部切口。sham组大鼠除了不进行穿刺血管壁外,其余步骤同上。2ME2组大鼠在SAH造模成功后1h按5mg/kg腹腔注射1%二甲亚砜溶解的2ME2试剂;SAH组和sham组大鼠均在造模后1h腹腔注射等体积1%二甲亚砜。造模后24h取脑组织标本,此时可见Willis动脉环周围存在血凝块。SAH出血评分参照Sugawara等[9]改良的方法进行评价,出血评分≤8分的大鼠予以剔除,用备用大鼠替代补充。若术中或术后24h内出现大鼠死亡情况,及时补充以确保各组10只样本。造模后24h参照Carcia等[10]制订经改良的18分评价法对各组大鼠神经功能进行评价。
1.3 免疫组化染色
1.3.1 组织学标本采集 造模后24h,将大鼠(每组5只)深度麻醉,经左心室灌注后取出脑组织,放入4%多聚甲醛溶液固定24h,再经30%蔗糖溶液脱水直至沉底。用恒冷箱冰冻切片机取大脑冠状位切薄片贴敷于载玻片,置于-80°C超低温冰箱中保存。
1.3.2 TUNEL染色 严格按照试剂盒说明书操作。切片经复温、封闭及透膜,滴加50μl TUNEL反应液,避光孵育60min,漂洗后DAPI染色,漂洗后封片,观察拍照。每张切片在右侧额底皮层区随机取3个视野(×400),观察阳性细胞并计算凋亡指数。
1.3.3 荧光双标染色 切片经复温及封闭,滴加一抗稀释液(兔抗HIF-1α和小鼠抗NeuN混合物,1∶200);4°C湿盒孵育过夜,漂洗,滴加荧光二抗稀释液(TRITC标记羊抗兔和FITIC标记羊抗小鼠混合物,1∶150);37°C避光孵育90min,漂洗后DAPI染色,清洗后封片,观察拍照。HIF-1α与GFAP荧光双标染色用小鼠抗GFAP单抗替代小鼠抗NeuN单抗,其余操作步骤同上。HIF-1α与TUNEL荧光双标染色先行TUNEL染色,再行HIF-1α染色。
1.4 Western blot检测蛋白表达 造模后24h,将大鼠(每组5只)深度麻醉,经灌注后断头取脑;从右侧额底皮层取少量组织,称重、裂解、匀浆、离心(15 000g,15min,4℃);将等量的蛋白样品(60μg)加入上样缓冲液,变性(95℃,10min),将样品加入SDS-PAGE垂直电泳,转移至PVDF膜,封闭(30 min),滴加一抗(HIF-1α,1∶1 000;BNIP3,1∶1 000;β-actin,1∶2 000) 孵育过夜(4℃);洗膜后滴加二抗,室温下孵育60min,经洗膜、曝光、显影并作定量分析。
1.5 统计学处理 应用SPASS 19.0统计软件。计量资料用表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠SAH出血及神经功能评分比较 SAH组、2ME2组SAH出血评分为(14.00±1.70)、(13.30±1.89)分,两组比较差异无统计学意义(P>0.05),见图1a;这表明两组大鼠SAH损伤程度基本一致。SAH组大鼠造模后24h神经功能评分为(12.40±1.34)分,明显低于sham组的(17.10±0.74)分(P<0.05);2ME2组大鼠神经功能评分为(13.90±1.10)分,较SAH组明显升高(P<0.05),见图1b。sham组大鼠基底动脉环周围未见出血;SAH组、2ME2组大鼠基底动脉环周围可见血凝块,表明模型建立成功,见图2。
2.2 3组大鼠凋亡指数比较 sham组同侧前额底皮层几乎未观察到TUNEL阳性细胞,其凋亡指数为(0.74± 0.61)%;SAH组同侧前额底皮层出现大量的TUNEL阳性细胞,呈散在性分布,其凋亡指数为(30.78±6.63)%,较sham组明显增多(P<0.05);2ME2组同侧前额底皮层TUNEL阳性细胞数明显减少,其凋亡指数为(16.79± 5.92)%,较SAH组明显减少(P<0.05)。
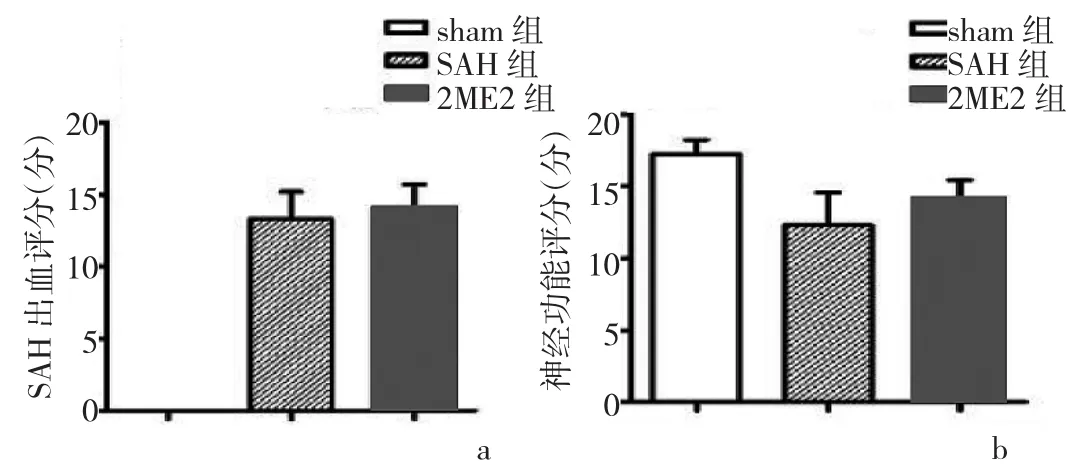
图1 3组大鼠SAH出血及神经功能评分
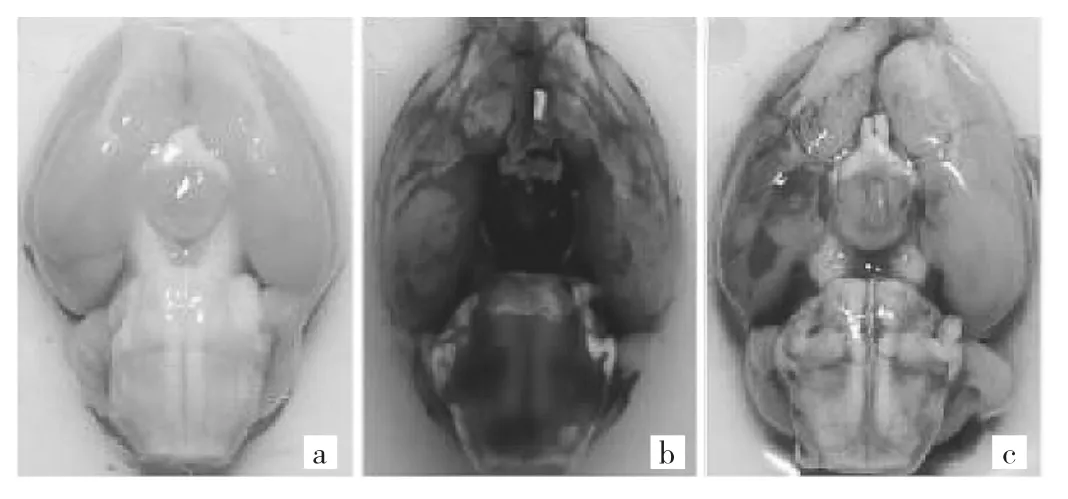
图2 3组大鼠基底动脉环周围所见(a:sham组大鼠基底动脉环周围未见出血;b:SAH组和2ME2组大鼠基底动脉环周围可见血凝块;c:SAH出血评分≤8分的标本,予以剔除)
2.3 3组大鼠荧光双标染色结果 SAH组大鼠造模后24h在出血同侧前额皮层可见大量HIF-1α阳性细胞;部分细胞呈现HIF-1α/NeuN双重阳性,而未见HIF-1α/ GFAP双重阳性细胞,可见HIF-1α主要定位表达于神经元,见图3a-f;部分细胞呈现HIF-1α/TUNEL双重阳性,提示部分细胞HIF-1α蛋白和凋亡共表达,见图3g-i。

图3 HIF-1α分别与NeuN、GFAP及TUNEL荧光双标染色结果
2.4 3组大鼠皮层HIF-1α、BINP3蛋白表达比较 sham组同侧大脑额底皮层HIF-1α、BINP3蛋白表达水平均很低,分别为1.00±0.16、1.00±0.29;与sham组比较,SAH组造模后24h同侧大脑额底皮层HIF-1α、BINP3蛋白表达水平均明显升高,分别为2.49±0.36、1.85±0.29(均P<0.05);与SAH组比较,2ME2组大鼠同侧大脑额底皮层HIF-1α、BINP3蛋白表达水平均明显下降,分别为1.66±0.29、1.40±0.18(均P<0.05),见图4。
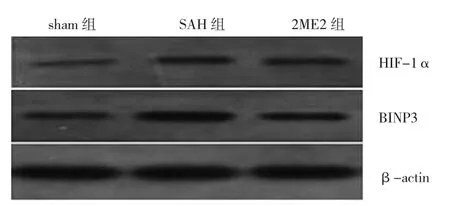
图4 3组大鼠皮层HIF-1α、BINP3蛋白表达的电泳图
3 讨论
通常在缺氧条件下,HIF-1α的降解会受抑制而转录活性增加,在细胞质中积累并进入细胞核与HIF-1β结合成异源二聚体HIF-1,通过调节下游基因适应缺氧环境。动物实验表明,HIF-1α在脑缺氧、脑出血时大量表达[11]。动物缺血缺氧脑损伤模型研究提示HIF-1α的作用仍须进一步探讨[12-13]。低氧预处理诱导HIF-1α在动物脑组织中表达具有神经保护作用[14],而在缺血缺氧脑损伤研究提示上调表达的HIF-1α可通过其靶基因介导神经元凋亡[11]。虽然已有研究报道SAH后HIF-1α在脑组织中表达升高,但关于其在SAH后EBI中的作用仍有争议。有学者发现大鼠SAH后去铁胺诱导的HIF-1α表达水平上升,可减轻基底动脉血管痉挛,并改善脑干血流量[15]。Yan等[16]研究表明SAH后基底动脉血管中稳定表达的HIF-1α在脑血管痉挛过程中发挥着重要作用,应用HIF-1α抑制剂干预HIF-1α的表达,可减轻SAH后脑血管痉挛。笔者前期研究结果表明,SAH后早期HIF-1α与细胞凋亡之间存在相关性[17]。早期凋亡过程中线粒体功能被干扰,在介导细胞凋亡时发挥着重要作用。BNIP3通过影响线粒体功能降低Bcl-2蛋白对凋亡的抑制作用,从而发挥促凋亡作用。大鼠缺氧脑损伤模型中脑组织HIF-1α介导BNIP3上调,可诱导细胞凋亡。
为探讨HIF-1α、BINP3在SAH后早期皮层神经元凋亡的作用机制,笔者采用颈内动脉穿刺法建立SAH模型进行研究。该模型造成瞬时颅内压升高、脑灌注压急剧下降及神经功能障碍,比较真实地模拟了临床上动脉瘤破裂的病理、生理过程,是国内外研究SAH后EBI常用模型之一[18]。此外,本研究参照Sugawara等[9]改良的评分法对SAH严重程度进行评价,剔除SAH出血评分≤8分的标本。该模型手术同侧前额底为血流冲击最大、血凝块最明显的区域,多数学者选取额底皮层作为研究SAH后EBI的部位。本研究发现HIF-1α主要定位表达于神经元,同时HIF-1α与部分凋亡细胞共同表达;这表明SAH后大量表达的HIF-1α与早期皮层神经元凋亡存在相关性。TUNEL染色结果发现SAH组造模后24h额底皮层大量细胞凋亡,呈散在性分布;2ME2组(HIF-1α抑制剂干预后)细胞凋亡明显减少;Western blot检测结果显示,造模后24h SAH组大鼠大脑额底皮层HIF-1α、BNIP3大量表达,而2ME2可抑制这一效果。大鼠神经功能评价结果显示,2ME2能明显改善大鼠神经功能。
综上所述,SAH后大量表达的HIF-1α介导上调BNIP3表达并参与了早期皮层神经元凋亡过程,进一步明确了HIF-1α、BNIP3在SAH后EBI中的作用,为临床治疗EBI提供了新思路。但是HIF-1α下游参与BNIP3调控的具体分子机制仍需进一步研究。
[1] Jr C E,Rabinstein A A,Carhuapoma J R,et al.Guidelines for the management of aneurysmal subarachnoid hemorrhage:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J].Stroke,2012,43(6):1711-1737.
[2] Chen J,Wang L,Wu C,et al.Melatonin-enhanced autophagy protects against neural apoptosis via a mitochondrial pathway in early brain injury following a subarachnoid hemorrhage[J].J PinealRes,2014,56(1):12-19.
[3] 李群,李建儒,曹生龙,等.二甲胺四环素在蛛网膜下腔出血中保护作用的研究[J].浙江医学,2015,37(3):193-194.
[4] 张立新,严锋,王林,等.内质网应激在蛛网膜下腔出血后早期脑损伤中的作用机制[J].浙江医学,2015,37(3):184-188.
[5] Palade C,Ciurea A V,Nica D A,et al.nterference of apoptosis in the pathophysiologyofsubarachnoid hemorrhage[J].Asian J Neurosurg,2013,8(2):106-111.
[6] YukselS,Tosun YB,CahillJ,et al.Early brain injury following aneurysmal subarachnoid hemorrhage:emphasis on cellular apoptosis[J].Turk Neurosurg,2012,22(5):529-533.
[7] Wang Z,Meng C J,Shen X M,et al.Potential contribution of hypoxia-inducible factor-1α,aquaporin-4,and matrix metalloproteinase-9 to blood-brain barrier disruption and brain edema after experimental subarachnoid hemorrhage[J].J Mol Neurosci, 2012,48(1):273-280.
[8] Xu W,Xu R,Li X,et al.Downregulating hypoxia-inducible factor-1α expression with perfluorooctyl-bromide nanoparticles reduces early brain injury following experimental subarachnoid hemorrhage in rats[J].Am J TranslRes,2016,8(5):2114-2126.
[9] Sugawara T,Ayer R,Jadhav V,et al.A new grading system evaluating bleeding scale in filament perforation subarachnoid hemorrhage rat model[J].J NeurosciMethods,2008,167(2):327-334.
[10] Garcia J H,Wagner S,Liu K F,et al.Neurological deficit and extent of neuronalnecrosis attributable to middle cerebralartery occlusion in rats[J].Statistical validation,Stroke,1995,26(4): 627-634.
[11] Chen C,Hu Q,Yan J,et al.Multiple effects of 2ME2 and D609 on the cortical expression of HIF-1α and apoptotic genes in a middle cerebral artery occlusion-induced focal ischemia rat model[J].J Neurochem,2007,102(6):1831-1841.
[12] Yeh S H,Ou L C,Gean P W,et al.Selective inhibition of early-but not late-expressed HIF-1α is neuroprotective in rats after focal ischemic brain damage[J].Brain Pathol,2011,21(3): 249-262.
[13] Lopez-Hernandez B,Posadas I,Podlesniy P,et al.HIF-1α is neuroprotective during the early phases of mild hypoxia in rat corticalneurons[J].Exp Neurol,2012,233(1):543-554.
[14] Jones N M,Lee E M,Brown T G,et al.Hypoxic preconditioning producesdifferential expression of hypoxia-inducible factor-1α(HIF-1α)and its regulatory enzyme HIF prolyl hydroxy-lase 2inneonatalratbrain[J].NeurosciLett,2006,404(1-2):72-77.
[15] Hishikawa T,Ono S,Ogawa T,et al.Effects of deferoxamine-activated hypoxia-inducible factor-1 on the brainstem after subarachnoid hemorrhage in rats[J].Neurosurgery,2008,62 (1):232-240.
[16] Yan J,Chen C,LeiJ,et al.2-methoxyestradiolreduces cerebral vasospasm after 48 hours of experimental subarachnoid hemorrhage in rats[J].Exp Neurol,2006,202(2):348-356.
[17] Hu Q,Wu C,Chen J Y,et al.The relationship between hypoxia-inducible factor-1α expression and apoptosis in early brain injury after subarachnoid hemorrhage[J].Journal of Zhejiang University,2014,43(1):58-65.
[18] Lee J Y,Sagher O,Keep R,et al.Comparison of experimental rat models of early brain injury after subarachnoid hemorrhage [J].Neurosurgery,2009,65(2):331-343.
HIF-1α mediated up-regulation of BNIP3 involving in early cortical apoptosis after subarachnoid hemorrhage
HU Qiang,YU Wenhua,CHEN Gao,et al.Department of Neurosurgery,Hangzhou First People's Hospital,Hangzhou 310006,China
Objective To investigate the role of hypoxia inducible factor-1α(HIF-1α)and BCL2/adenovirus E1B 19 kDa protein-interacting protein 3 (BNIP3)in early cortical apoptosis after subarachnoid hemorrhage (SAH). Methods Thirty Sprague-Dawley rats were randomly divided into sham,2-methoxyestradiol(2ME2),and SAH groups with 10 animals in each. The SAH model was induced by endovascular perforation on internal carotid in rats of 2ME2 and SAH groups.The neurological scores were recorded 24h after SAH induced.The expression of HIF-1α and BNIP3 was detected by Western blotting. TdT-mediated dUTP-biotin nick end-labeling(TUNEL)technique was adopted to detect apoptotic cell.HIF-1α-positive cells were observed by double fluorescence labeling. Results Compared to sham group,expression of HIF-1α and BNIP3 was increased,marked cell apoptosis and neurologic function decline were observed in brain tissue of SAH group 24 h after model induced (P<0.05).Compared to SAH group,the expression of HIF-1α and BNIP3 was suppressed,cell apoptosis was diminished and neurologic function improved in 2ME2 group(P<0.05).Double fluorescence labeling showed that HIF-1α was mainly located in neurons. Conclusion These data indicated that HIF-1α-mediated up-regulation of BNIP3 in involved in early cortical apoptosis after subarachnoid hemorrhage.
Subarachnoid hemorrhage Hypoxia-inducible factor-1α Apoptosis BNIP3
2017-02-15)
(本文编辑:陈丹)
10.12056/j.issn.1006-2785.2017.39.14.2017-787
国家自然科学基金(81171094)
310006 杭州市第一人民医院(南京医科大学附属杭州医院)神经外科(胡强、俞文华、杜权);浙江大学医学院附属第二医院神经外科(陈高)
俞文华,E-mail:ywh669@126.com

