氨基胍对乳酸盐腹膜透析液致人腹膜间皮细胞损伤及血管内皮生长因子表达的影响
傅碧玲,冯朝瑜,朱赛香,邹世海,彭鑫
(深圳市宝安区人民医院肾脏内科,广东深圳518101)
氨基胍对乳酸盐腹膜透析液致人腹膜间皮细胞损伤及血管内皮生长因子表达的影响
傅碧玲,冯朝瑜,朱赛香,邹世海,彭鑫
(深圳市宝安区人民医院肾脏内科,广东深圳518101)
目的研究氨基胍(AG)对乳酸盐腹膜透析液(L-PDS)致人腹膜间皮细胞(HMrSV5)损伤及血管内皮生长因子(VEGF)表达的影响。方法采用人腹膜间皮细胞株HMrSV5为体外实验模型,分为无血清DMEM培养液对照组、L-PDS组(2.5%L-PDS)、L-PDS+AG组(2.5%L-PDS+10 mmol/LAG)、单纯AG组(终浓度10 mmol/L)。各组以上不同干预因素与HMrSV5细胞共孵育。MTT法检测各组细胞增殖、评估细胞活力,Western blot和逆转录-聚合酶链反应(RT-PCR)检测VEGF蛋白及mRNA的表达。结果MTT试验表明,L-PDS组OD值为(0.120±0.019),明显低于对照组的(0.298±0.031),差异有统计学意义(P<0.05);L-PDS+AG组OD值为(0.289±0.022),明显高于L-PDS组,差异有统计学意义(P<0.05)。Western blot和RT-PCR结果均表明,与对照组比较,L-PDS组细胞中VEGF蛋白和mRNA表达明显增加,与L-PDS组比较,PDS+AG组VEGF蛋白和mRNA的表达明显减低,差异均有统计学意义(P<0.05)。结论AG可拮抗乳酸盐腹膜透析液致人腹膜间皮细胞损伤并下调VEGF的表达。
氨基胍;乳酸盐腹膜透析液;人腹膜间皮细胞;血管内皮生长因子
持续不卧床腹膜透析(CAPD)是目前最重要的肾脏替代治疗手段之一,其中超滤衰竭是患者退出腹膜透析的重要原因。国内外专家均积极探索在使用现有生物不相容性的腹膜透析液条件下防治腹膜透析失超滤的策略。目前国内普遍使用的是低pH值、高糖、高渗、含葡萄糖降解产物(GDPs)的以乳酸盐为缓冲碱的腹膜透析液(PDS),乳酸盐作为缓冲碱的缺点之一是降低腹膜间皮细胞的代谢及存活率,减低腹腔白细胞功能,使腹腔抵抗微生物入侵能力减弱[1]。同时,此类透析液能够促进血管内皮生长因子(VEGF)的表达,进而促进腹膜血管新生,后者与PD超滤衰竭密切相关[2]。氨基胍(AG)作为糖基化终产物受体(RAGEs)的抑制剂,可以抑制糖基化终产物(AGEs)的形成。已有试验证实,在建立的大鼠腹膜透析模型中,PD液中加入AG有助于抑制血管增生[3]。但AG能否抑制腹膜透析液诱导的腹膜间皮细胞损伤及影响细胞因子VEGF的表达,国内外尚未见报道。故本研究以体外培养的人腹膜间皮细胞株(HMrSV5)为研究对象,观察AG对L-PDS致HMrSV5损伤及VEGF表达的影响。为腹膜超滤衰竭的防治提供新的理论依据和治疗靶点。
1 材料与方法
1.1 试验材料胎牛血清、胰蛋白酶和DMEM培养基分别购自杭州四季青公司、美国Invitrogen公司;四甲基偶氮唑蓝(MTT),氨基胍(aminoguanidine,AG),兔抗GAPDH抗体、小鼠抗人VEGF单抗均购自Sigma公司(美国);RT-PCR试剂盒购自日本TaKaRa公司。
1.2 试验方法
1.2.1 人腹膜间皮细胞(HMrSV5)的培养使用含10%小牛血清的DMEM培养液培养HMrSV5(中科院上海细胞库),培养箱条件为37℃、5%CO2。换液间隔时间为2~3 d,实验达标要求:细胞生长融合度达80%左右。实验时传代细胞,细胞贴壁后,用培养液(含1%小牛血清)进行同步培养24 h,大部分细胞处于静止状态。
1.2.2 细胞分组实验分为以下各组:(1)对照组:无血清DMEM培养液;(2)L-PDS组:含2.5% L-PDS(美国Baxter公司提供);(3)L-PDS+AG组:含2.5%L-PDS及10 mmol/L AG;(4)单纯AG组(终浓度10 mmol/L)。
1.2.3 MTT法检测HMrSV5的增殖胰酶消化细胞后制成细胞悬液,将细胞密度调整为1×105个/mL,接种到96孔培养板内,接种要求为每孔100 μL细胞悬液,置于培养箱中培养96 h,然后再用培养液(含1%小牛血清)同步24 h,使大部分细胞处于静止状态。弃去培养液,磷酸盐缓冲液(PBS)洗两遍,每组设3个重复孔,各组加入相应的处理因素100 μL,分别与HMrSV5作用45~60 min。弃去培养液(处理因素),PBS洗两遍,加入5%小牛血清培养液100 μL,继续培养20 h后,每个培养孔均加入MTT(100 μL),使其终浓度保持在0.5 mg/mL,调零组则不加,振荡然后继续孵育4 h。将培养液弃去,每孔加入100 μL DMSO,摇匀大概10 min左右,当结晶被完全溶解后,在Bio-Rad550酶标仪上测定各组的平均吸光度值(OD值),将波长设定为570 nm。实验重复3次。
1.2.4 免疫印迹(Western-blot)技术检测VEGF蛋白质的表达将细胞接种于6孔细胞培养板中,以105/孔的密度,细胞长至80%融合时,将细胞培养基更换为培养液(1%小牛血清DMEM),同步24 h后,各组加入相应的处理因素2.5 mL,与HMrSV5共孵育60 min。然后将各组细胞予以收集、裂解,取其上清液,对蛋白浓度进行测定,取30 μg细胞总蛋白进行配置,要求为配成等体积等量,放置于沸水中予以煮5 min,电泳分离(10%SDS-聚丙烯酰胺),将蛋白通过电转移至硝酸纤维素膜上,使用5%无脂奶粉进行封闭,一抗孵育杂交过夜,为小鼠抗人VEGF单抗,洗膜后在抗鼠IgG中孵育1 h,其中抗鼠IgG是由过氧化物酶标记的;最后结果用化学发光法以X线片自显影进行显示。图像经图像分析软件Quantity One(BioRad公司)对特异性条带进行灰度扫描分析,求得各组蛋白电泳条带灰度与内参GAPDH的比值,反映为VEGF表达含量变化,从而半定量比较目的蛋白。实验重复3次。
1.2.5 逆转录-聚合酶链反应(RT-PCR)法检测VEGF mRNA的表达同样在6孔细胞培养板中将细胞以105/孔进行接种,再细胞长至80%融合时,对细胞培养基进行更换分组培养。各组加入相应的处理因素2.5 mL,分别与HMrSV5作用60 min后,将各组细胞予以收集,对细胞总RNA进行提取,扩增产物以RT-PCR法得到,PCR产物进行电泳及分析:凝胶在UVP凝胶成像系统中扫描以对结果进行观察、拍照,对电泳带灰度进行分析,计算VEGF mRNA相对表达量也就是VEGF mRNA特异性扩增带灰度/内参GAPDH扩增带灰度。实验重复3次。
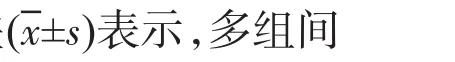
2 结果
2.1 AG对L-PDS诱导的HMrSV5细胞增殖的影响L-PDS组OD值明显低于对照组,差异有统计学意义(P<0.05);L-PDS+AG组OD值明显高于L-PDS组,差异有统计学意义(P<0.05),见表1。
表1AG对L-PDS诱导的HMrSV5细胞增殖的影响

表1AG对L-PDS诱导的HMrSV5细胞增殖的影响
注:与对照组比较,aP<0.01;与L-PDS组比较,bP<0.01。
组别OD值对照组L-PDS组L-PDS+AG组单纯AG组F值P值0.298±0.031 0.120±0.019a0.289±0.022b0.302±0.028 289.200<0.01
2.2 AG对L-PDS诱导的HMrSV5细胞VEGF蛋白表达的影响与对照组比较,L-PDS组细胞中VEGF蛋白表达明显增加,差异有统计学意义(t=5.62,P<0.05);而单纯AG组没有显著影响细胞内VEGF的表达(t=0.75,P>0.05)。与L-PDS组比较,L-PDS+AG组VEGF蛋白的表达明显降低,差异有统计学意义(t= 5.17,P<0.05),见图1。
2.3 AG对L-PDS诱导的HMrSV5细胞VEGF mRNA表达的影响与对照组比较,L-PDS组细胞中VEGF mRNA表达明显增加,差异有统计学意义(t= 4.91,P<0.05);而单纯AG组,没有影响细胞内VEGF mRNA的表达(t=0.71,P>0.05)。与L-PDS组比较,L-PDS+AG组VEGF mRNA的表达明显降低,差异有统计学意义(t=4.09,P<0.05),见图2。
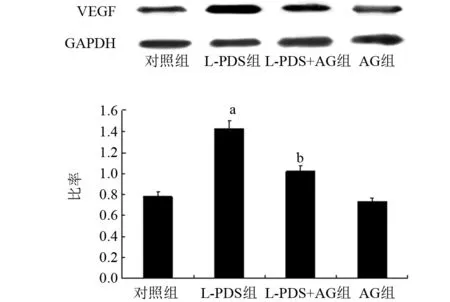
图1 四组细胞VEGF蛋白表达的情况
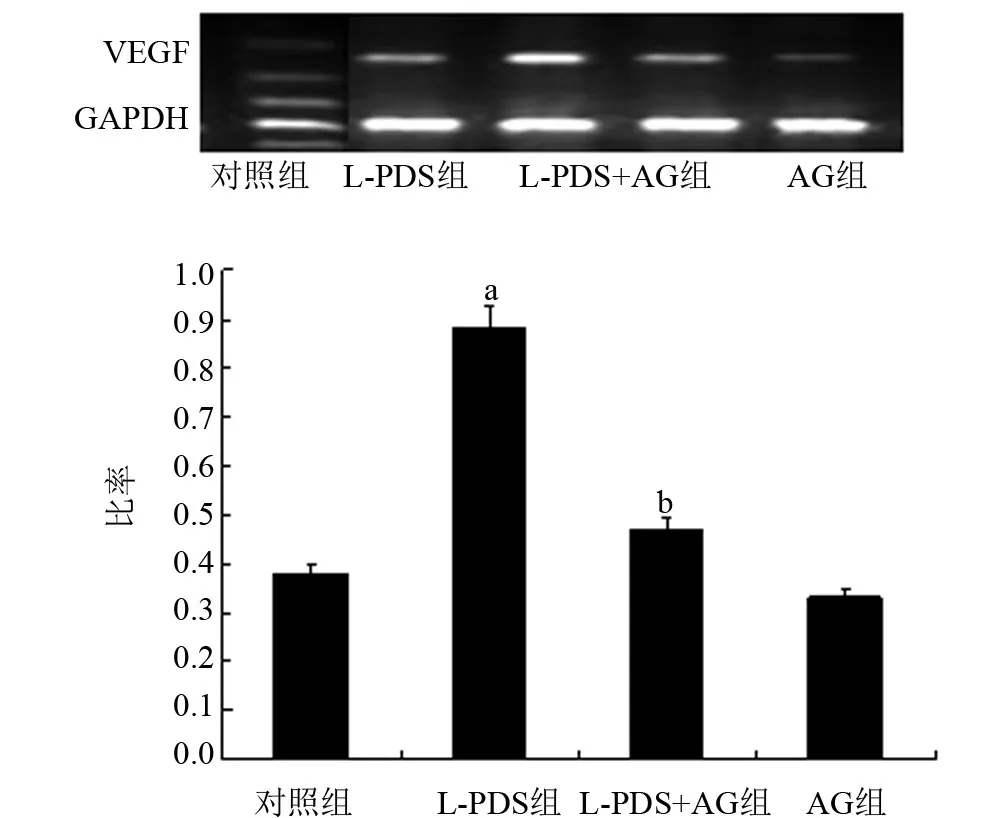
图2 四组细胞VEGF mRNA表达的情况
3 讨论
在我国,血液透析(HD)和腹膜透析(PD)是终末期肾脏病(ESRD)患者肾脏替代治疗的两种主要方式。随着国家政策的扶持,PD技术的推广,PD患者生存期的延长,腹膜透析液(PDS)的非生物相容性问题日益凸显。血液透析有多种透析器可供选择,且为一次性使用,不再复用。而腹膜透析利用的是生物膜,无可替代或转换,腹膜持续或重复地暴露于非生物相容性的透析液,更易于损伤。
目前普遍使用的仍然是以乳酸盐为载体的高糖、高渗、低pH、含葡萄糖降解产物(GDPs)的透析液。pH中性、低GDPS的新型PDF虽具有更好的生物相容性、可减轻炎症反应、保护腹膜功能、有更好的超滤能力和代谢效益,但对减少腹膜炎的发生、提高远期技术存活效率和生存率方面待更大样本的RCT证实[4],且较昂贵,我国尚未能推广使用。故在现有乳酸盐腹膜透析液的条件下,仍需要积极探索防治腹膜透析超滤衰竭的方法,减少PD患者的退出。腹膜透析超滤衰竭与腹膜血管新生、间皮细胞损伤以及腹膜的纤维化等因素密切相关。
乳酸盐腹膜透析液可使腹膜间皮细胞活力下降、损伤,细胞因子(VEGF)表达上调,进而导致腹膜间皮细胞损伤、腹膜血管新生。VEGF通过活化间皮细胞的RAGEs刺激血管的形成[5],并可通过与一氧化氮合酶(NOS)同工酶的反应使毛细血管通透性增加[6]。RAGEs的阻断剂,可以干预上述进程。在大鼠腹膜透析模型的体内试验中证实,AG(RAGEs的阻断剂)有助于抑制血管增生[3]。
本研究使用MTT法观察不同干预因素对HMrSV5细胞增殖的影响。L-PDS对于体外培养的HMrSV5增殖具有明显抑制作用。与对照组比较,L-PDS组OD值明显减小(P<0.05)。与L-PDS组比较,L-PDS+AG组OD值明显增大,说明AG对L-PDS诱导的HMrSV5损伤具有一定保护作用。因此,本研究为运用AG对抗乳酸盐PDF对腹膜间皮细胞损伤提供了实验依据。
Western blot和RT-PCR结果分别从蛋白及mRNA水平证实,与对照组比较,L-PDS组细胞中VEGF蛋白和mRNA表达明显增加(P<0.05);与L-PDS组比较,L-PDS+AG组VEGF蛋白和mRNA的表达明显减低(P<0.05),说明AG可拮抗乳酸盐腹膜透析液诱导的HMrSV5细胞VEGF的表达。VEGF是促进血管新生的主要因素和始动因子。VEGF在腹膜间皮细胞表达不断增强,进而促进形成新生血管,增加了腹膜对小分子溶质的转运,加快了透析液葡萄糖的吸收,减弱了跨膜渗透压梯度,最终使超滤减少甚至引起超滤能力丧失。动物模型中,与使用传统乳酸盐PDF组比较,使用中性的、低GDP含量(neutral pH,low-GDP,NpHLGDP)的PDS组,其流出液的VEGF水平、VEGF染色、血管新生等明显降低[7]。腹膜间皮细胞可能受到前炎症因子和AGEs影响,而非葡萄糖本身的刺激从而产生(合成)VEGF[8]。AG具有抑制NOS活性和AGEs形成的作用,可以显著降解GDPs以及明显抑制L-PDS所致的AGEs堆积。本研究在体外试验证实,AG可拮抗乳酸盐腹膜透析液诱导的HMrSV5细胞VEGF过表达。为运用AG对抗L-PDS对腹膜间皮VEGF表达上调提供了实验依据。
综上所述,AG可拮抗乳酸盐腹膜透析液致人腹膜间皮细胞损伤并下调VEGF的表达,可能与其阻断了RAGE受体通路有关。
[1]Perl J,Nessim SJ,Bargman JM,et al.The biocompatibility of neutral PH,low-GDP peritoneal dialysis solutions:benefit at bench,bedside,or both?[J].Kidney Int,2011,79(8):814-824.
[2]Liu J,Wu X,Liu Y,et al.High-glucose-based peritoneal dialysis solution induces the upregulation of VEGF expression in human peritoneal mesothelial cells:The role of pleiotrophin[J].Int J Mol Med, 2013,32(5):1150-1158.
[3]Zareie M,Tangelder GJ,ter Wee PM,et al.Beneficial effects of aminoguanidine on peritoneal microcirculation and tissue remodelling in a rat model of PD[J].Nephrol Dial Transplant,2005,20(12):2783-2792.
[4]娄丽璇.不同腹膜透析液的特点及临床应用评价[J].肾脏病与透析肾移植杂志,2016,25(2):186-190.
[5]Hong FY,Bao JF,Hao J,et al.Methylglyoxal and advanced glycation end-products promote cytokines expression in peritoneal mesothelial cells via MAPK signaling[J].Am J Med Sci,2015,349(2):105-109.
[6]Sharifpanah F,Behr S,Wartenberg M,et al.Mechanical strain stimulates vasculogenesis and expression of angiogenesis guidance molecules of embryonic stem cells through elevation of intracellular calcium,reactive oxygen species and nitric oxide generation[J].Biochim Biophys Acta,2016,1863(12):3096-3105.
[7]Cho Y,Johnson DW,Badve SV,et al.The impact of neutral-pH peritoneal dialysates with reduced glucose degradation products on clinical outcomes in peritoneal dialysis patients[J].Kidney Int,2013,84 (5):969-979.
[8]庄薇,钟宁.VEGF、Ang-2在腹膜透析大鼠腹膜组织中的表达[J].继续医学教育,2013,27(10):50-51.
Effect of aminoguanidine on damage in human peritoneal mesothelial HMrSV5 cells caused by lactate peritoneal dialysis solution andexpression of VEGF.
FU Bi-ling,FENG Zhao-yu,ZHU Sai-xiang,ZOU Shi-hai,PENG Xin. Department of Nephrology,Shenzhen Baoan District People's Hospital,Shenzhen 518101,Guangdong,CHINA
ObjectiveTo investigate the effect of aminoguanidine(AG)on damage in human peritoneal mesothelial cells(HMrSV5)caused by lactate peritoneal dialysis solution(L-PDS)and expression of vascular endothelial growth factor(VEGF).MethodsDepending on the culture of the cell,the cultured HMrSV5 cells were divided to control group(cultured in DMEM),L-PDS group(2.5%L-PDS),L-PDS+AG group(2.5%L-PDS+10 mmol/LAG),and AG group(at a final concentration of 10 mmol/L).MTT assay was used to assess the viability and proliferation of the cells. VEGF protein was determined by western blot,and VEGF mRNA was determined by RT-PCR.ResultsThe optical density(OD)value in L-PDS group was(0.120±0.019),significantly lower than(0.298±0.031)in the control group(P<0.05).The OD value in L-PDS+AG group was(0.289±0.022),which was significantly higher than that in L-PDS group (P<0.05).Expression of VEGF protein and mRNA increased significantly in L-PDS group as compared with those in control group(P<0.05),while the expression decreased significantly in PDS+AG group as compared with those in L-PDS group(P<0.05).ConclusionAG can antagonize the injury of HMrSV5 caused by L-PDS and down-regulate the expression of VEGF.
Aminoguanidine(AG);Lactate peritoneal dialysis solution(L-PDS);Human peritoneal mesothelial cells(HMrSV5);Vascular endothelial growth factor(VEGF)
R459.5
A
1003—6350(2017)14—2251—04
10.3969/j.issn.1003-6350.2017.14.005
2017-04-05)
广东省深圳市宝安区科技计划社会公益项目(编号:2013027)
傅碧玲。E-mail:13226686502@139.com

