急性肾损伤组织中细胞周期调控蛋白的表达变化及其意义
曹雷,郑灼,李宁,赵讯,张颖轩
(哈励逊国际和平医院,河北衡水053000)
急性肾损伤组织中细胞周期调控蛋白的表达变化及其意义
曹雷,郑灼,李宁,赵讯,张颖轩
(哈励逊国际和平医院,河北衡水053000)
目的 观察细胞周期蛋白B1(Cyclin B1)、细胞周期蛋白依赖性蛋白激酶4(CDK4)、p21在不同原因所致急性肾损伤(AKI)组织中的表达变化,并探讨其意义。方法 选择行肾穿刺活检术的患者纳入研究,包括AKI患者108例和无器质性肾脏病变的肾功能异常的患者(对照组)39例。AKI患者中,肾毒性AKI 63例(肾毒性AKI组)、缺血性AKI 45例(缺血性AKI组)。取各组肾穿刺活检标本,采用免疫组织法检测Cyclin B1、CDK4、p21蛋白。结果 肾毒性AKI组、缺血性AKI组的肾小管细胞和肾间质中p21、Cyclin B1、CDK4蛋白表达积分均高于对照组(P均<0.05)。肾毒性AKI组及缺血性AKI组肾组织中Cyclin B1、CDK4、p21蛋白表达积分相比,P均>0.05。结论 AKI组织中p21、Cyclin B1、CDK4蛋白表达上调,在肾毒性AKI和缺血性AKI中三种细胞周期调控蛋白表达变化的趋势一致;细胞周期调控蛋白的表达与AKI病因无关。
急性肾损伤;细胞周期调控蛋白;细胞周期蛋白B1;细胞周期蛋白依赖性蛋白激酶;细胞周期蛋白依赖性蛋白激酶抑制剂;p21蛋白
急性肾损伤(AKI)病情变化较快,是临床常见的危急重症[1,2]。AKI根据病因不同可分为缺血性AKI及肾毒性AKI两种。缺血性AKI主要是由于肾脏灌注压下降造成的,肾毒性AKI主要是由于化学物质引起的肾毒性作用。细胞周期正调控蛋白包括细胞周期蛋白(Cyclins)及细胞周期蛋白依赖性蛋白激酶(CDK)。p21蛋白为CDK抑制剂(CKI)家族中的一种,能够广谱抑制细胞周期正性调控蛋白的活性[3]。肾损伤等异常刺激作用使得有丝分裂原增加,细胞周期调控蛋白异常表达,调控能力受限,从而造成肾脏结构重塑及组织纤维化[4]。细胞周期调控蛋白表达异常与AKI引起的肾脏细胞增生、肥大及凋亡密切相关[5]。相关研究[6]表明,细胞周期适当的阻滞能够有利于已经损伤细胞的修复。本研究观察了Cyclin B1、CDK4、p21在缺血性和肾毒性AKI组织中的表达变化,并探讨其临床意义。
1 资料与方法
1.1 临床资料 选择在我院就诊的需行肾穿刺活检术的患者纳入研究,患者既往无慢性肾功能不全病史,无孤立肾、小肾,无肾结核、肾周围组织脓肿,无肾盂肾炎、肾盂积水或积脓,无肾肿瘤或肾动脉瘤,无多囊肾或肾脏大囊肿,无肾脏位置过高或游走肾,3个月内均未使用激素进行相关疾病的治疗。共纳入AKI患者108例和无器质性肾脏病变的肾功能异常患者(对照组)39例。AKI患者中,依据其病因、病史分为肾毒性AKI 63例(肾毒性AKI组)男31例、女32例,年龄(53.3±9.2)岁;缺血性AKI 45例(缺血性AKI组)男23例、女22例,年龄(53.6±6.7)岁。对照组39例,男19例、女20例,年龄(54.1±3.5)岁。三组患者性别比例、年龄资料差异无统计学意义。
1.2 肾组织中Cyclin B1、p21、CDK4蛋白检测 采用免疫组化法。取各组肾穿刺活检标本置于4 ℃、4%多聚甲醛溶液中固定2 h,常规乙醇梯度脱色,二甲苯透明、浸蜡、包埋。将常规石蜡连续切片(3 μm)烘干(60 ℃)8 h,浸入二甲苯Ⅱ、Ⅰ液中各10 min后经梯度浓度乙醇水洗各3 min,使石蜡切片脱蜡至水。3% H2O2封闭内源性过氧化物酶15 min,蒸馏水中止3 min,PBS液浸泡5 min。微波修复抗原15 min,充分暴露抗原决定簇后自然冷却。消除非特异性背景染色。滴加一抗,4 ℃冰箱过夜,PBS液冲洗3次、每次5 min。滴加生物素标记的二抗,37 ℃,30 min,PBS液冲洗3次、每次5 min。二氨基联苯胺(DAB)显色5~10 min,自来水充分冲洗以中止显色反应。苏木素衬染3 min,水洗,1%盐酸及99%乙醇分化20 s,充分水洗后梯度乙醇脱水,二甲苯透明后中性树胶封片。用对照组肾组织标本做阴性对照。根据染色程度和阳性细胞百分比判定免疫组化结果:细胞染色以胞核、胞质或胞膜呈黄色为阳性,否则为阴性;根据染色程度为无着色、淡黄色、棕黄色、棕褐色分别计0、1、2、3分;随机选择10个不重叠视野(400倍光镜下),每个视野各计数100个细胞,阳性细胞百分比为0计0分、≤10%计l分、>10%~50%计2分、>50%~75%计3分、>75%~100%计4分;上述两项得分相加,0分以上判定为蛋白表达阳性。
1.3 统计学方法 采用SPSS17.0对数据进行统计分析。蛋白表达积分以中位数和百分位数(25%,75%)表示,等级资料组间比较用秩和检验。P<0.05为差异有统计学意义。
2 结果
对照组肾组织中未见p21表达,但AKI组中可见p21染色呈棕黄色及棕褐色,其阳性细胞主要见于肾间质、肾小球系膜细胞、毛细血管内皮细胞胞核及新月体内,阳性细胞数占75%~90%。对照组肾小球及肾间质内Cyclin B1蛋白阳性染色呈棕褐色;AKI组肾小管上皮细胞、肾小球系膜细胞及肾间质中可见Cyclin B1染色深度减弱。各组肾组织中CDK4表达与Cyclin B1表达情况相似,但对照组肾小球细胞中无CDK4阳性表达。肾毒性AKI组、缺血性AKI组的肾小管细胞和肾间质中p21、Cyclin B1、CDK4蛋白表达积分均高于对照组(P均<0.05)。肾毒性AKI组及缺血性AKI组肾组织中Cyclin B1、CDK4、p21蛋白表达积分相比,P均>0.05。
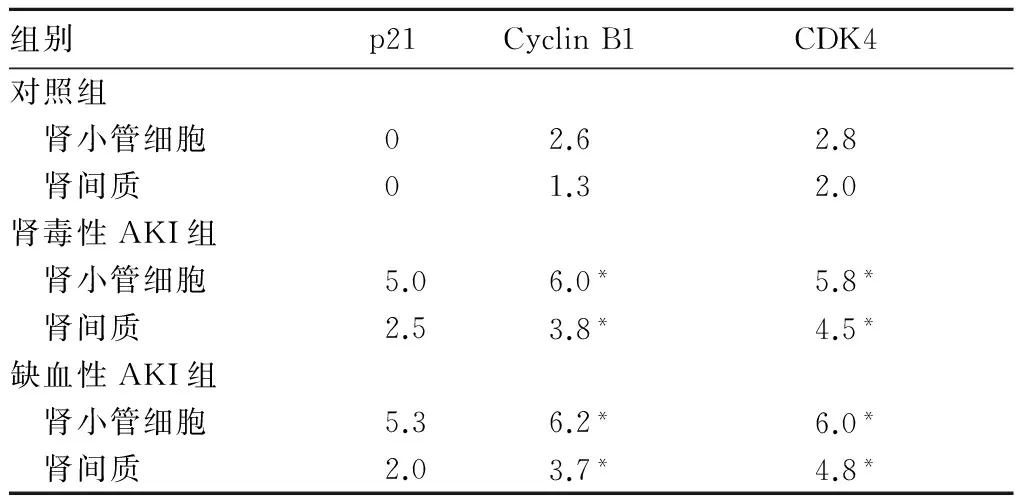
表1 各组肾小管细胞及肾间质中p21、Cyclin B1、CDK4蛋白表达积分比较(分)
注:与对照组相比,*P<0.05。
3 讨论
AKI是慢性肾功能不全的常见病因[7,8],以往对AKI的诊断金标准是SCr值升高,但SCr水平与患者的年龄、性别及机体代谢状况等有关,其数值变化与AKI引起GFR的变化相比具有延迟性。肾组织细胞凋亡及肾小管上皮细胞急性坏死是肾毒性AKI及缺血性AKI的细胞学基础和主要病理改变[9]。肾小管上皮细胞是急性肾损伤的主要靶细胞,其增殖异常直接导致肾纤维化的发生与发展。研究[10]表明肾小管上皮细胞的再生和重建有利于受损肾脏组织修复。肾脏固有细胞为暂时休止细胞,病理因素或损伤因素产生的有丝分裂原使其活化进入新的细胞周期[11],而细胞周期调节蛋白在肾小管上皮细胞增殖、分化及凋亡中起着不可替代的作用。一个完整的细胞周期包括G1期(DNA合成前期)、S期(DNA合成期)、G2期(DNA合成后期)和M期(有丝分裂期)。细胞周期的每一时象均有其特异性的正负性调控蛋白。了解细胞周期调控蛋白在AKI发病中的作用机制有重要的临床意义。
Cyclin B1在S期开始形成,G2/M期时达到高峰,是重要的细胞周期正性调控因子之一。研究[16]表明Cyclin B1能激活CDK1参与细胞周期G2/M期转换,Cyclin B1复合物又称为成熟促进因子(MPF),能够在无蛋白合成或被ede25e活化后促进真核细胞进行有丝分裂,其表达水平与AKI病变程度呈正相关。CDK是丝氨酸/苏氨酸蛋白激酶中的一种,其复合物形式是调控细胞周期的中心环节。CDK4是CDK家族的重要组成成员之一,对细胞由G1期进入S期起重要作用。然而,在外界不良刺激的作用下,Cyclin D1与CDK4结合形成复合物,能够激活CDK4并促使其下游的pRb蛋白磷酸化[13],通过E2F转录子的释放及活化,启动信号系统,使细胞周期跨越关卡点,缩短细胞周期,引起细胞周期调节失控和细胞异常增殖[14]。在系膜增生型大鼠肾炎模型中CDK活性明显升高,且Cyclins免疫染色程度增强。本研究结果显示,AKI肾组织中Cyclin B1、CDK4阳性表达较强,且其表达变化与急性肾损伤中肾组织细胞的细胞周期分布变化基本一致。
p21蛋白也称野生型p53激活片段,是一种细胞周期负性调控因子,正常情况下野生型p53半衰期较短,免疫组化法通常检测不出p21蛋白;但当p53发生基因突变、半衰期延长,p21蛋白可以被检出。p21能够与Cyclin B1-CDK1及Cyclin D1-CDK4复合物相黏附,与其特异性结合并使其失活,从而使细胞周期(G1期向S期转化)被阻滞,促进细胞凋亡。有研究表明p21缺失的小鼠在注射顺铂后比野生鼠更迅速地出现急性肾衰竭症状,肾脏形态学损害更加严重。本研究中肾毒性AKI组、缺血性AKI组中均发现p21阳性表达水平显著提高,较对照组的肾小管上皮细胞及肾间质中阳性表达明显,推测p21阳性表达对肾损伤有一定的抑制作用,这可能与p21调节细胞增殖与凋亡平衡有关。
总之,虽然细胞周期调控蛋白的表达及其功能执行受多种因素影响及干扰,但在肾毒性AKI及缺血性AKI的病变发展中Cyclin B1、CDK4、p21蛋白的表达与其执行的功能相一致。深入研究细胞周期调控蛋白在AKI中的作用,有助于了解AKI的发病机制,在病变早期进行干预,控制病情进展。
[1] Rewa O, Bagshaw SM. Acute kidney injury-epidemiology, outcomes and economic[J]. Nat Rev Nephrol, 2014,10(4):193-207.
[2] 陈智.急性肾损伤致远隔器官损伤[J].中华实用儿科临床杂志,2015,30(5):323-324.
[3] 秦福芳,邵凤民.细胞周期调控蛋白与肾脏疾病[J].医药论坛杂志,2011,32(23):205-206.
[4] 唐怡,张凌,付平.细胞凋亡与急性肾损伤[J].中国医学前沿杂志(电子版),2014,6(9):5-8.
[5] Homsi E, Janino P, de Faria JB. Role of caspases on cell death, inflammation, and cell cycle in glycerol-induced acute renal failure[J]. Kidney Int, 2006,69(8):1385-1392.
[6] 沈云琳,黄文彦.急性肾损伤与细胞周期调控[J].国际儿科学杂志,2014,41(3):331-336.
[7] Goldstein SL. Acute kideny injury in children and its potential consequence in adulthood[J]. Blood Purif, 2012,33(1-3):131-137.
[8] Singbartl K, Kellum JA. AKI in the ICU:definition, epidemiology,risk stracification,and outcomes[J]. Kidney Int, 2012,81(9):819-825.
[9] 林婷,庄永泽.细胞周期调控蛋白在肾脏疾病中的表达及意义[J].中国中西医结合肾病杂志,2010,11(8):743-746.
[10] 龙超,吴明正,何迷,等.骨髓间充质干细胞移植治疗肾损伤的修复理论及归巢机制的研究进展[J].医学综述,2015,21(21):3852-3855.
[11] Obaya AJ, SedivyJM. Regulation of cyclin-CDK activity in mammalian cells[J]. Cell Mol Life Sci, 2002,59(1):126-142.
[12] May M, Wang T, Muller M, et al. Difference in F-Actin depolymerization induced by toxin B from the variant clostridium difficile serotype F striain 1470[J]. Toxins(Basel), 2013,5(1):106-119.
[13] Ehrenthal DB, Jurkovitz C, Hoffman M, et al. Prepregnancy body mass index as an independent risk factor for pregnancy-induced hypertension[J]. J Womens Health, 2011,20(1):67-72.
[14] 金文虎,王达利,聂开瑜,等.增生性瘢痕成纤维细胞中CyclinD1, CDK2,CDK4作用及与细胞周期的相关性[J].中国组织工程研究,2012,16(24):4422-4426.
河北省自然科学基金项目(20150431)。
10.3969/j.issn.1002-266X.2017.27.025
R365
B
1002-266X(2017)27-0082-03
2017-03-08)

