特发性膜性肾病患者肾组织中PLA2R表达及其与免疫治疗疗效的关系
凌炜权,江杰
(东莞市人民医院,广东东莞523000)
特发性膜性肾病患者肾组织中PLA2R表达及其与免疫治疗疗效的关系
凌炜权,江杰
(东莞市人民医院,广东东莞523000)
目的 观察特发性膜性肾病(IMN)患者肾组织中M型磷脂酶A2受体(PLA2R)的表达情况,并分析其与免疫治疗疗效的关系。方法 选取我院肾内科住院治疗且经肾活检病理证实的IMN患者82例,采用免疫荧光法检测患者肾组织中的PLA2R,根据PLA2R表达情况分为PLA2R阳性组和PLA2R阴性组。所有患者给予激素联合环磷酰胺免疫治疗2个月,随访12个月。对比PLA2R阳性组与PLA2R阴性组治疗后3、6、12个月的血清白蛋白水平、24 h尿蛋白定量、治疗总有效率,比较两组治疗时间及不良反应发生率。结果 82例IMN患者中,PLA2R表达阳性58例、阴性24例。IMN患者肾组织中PLA2R阳性表达率为70.73%。PLA2R阳性组患者治疗后3、6、12个月血清白蛋白水平均低于PLA2R阴性组,24 h尿蛋白定量均高于PLA2R阴性组(P均<0.05)。PLA2R阳性组治疗后3、6、12个月总有效率均低于PLA2R阴性组(P均<0.05)。PLA2R阳性组治疗时间长于PLA2R阴性组,不良反应发生率高于PLA2R阴性组(P均<0.05)。结论 IMN患者肾组织中PLA2R阳性表达率较高。PLA2R表达阳性的IMN患者较PLA2R表达阴性者免疫治疗效果差、治疗时间长、不良反应发生率高。
特发性膜性肾病;M型磷脂酶A2受体;免疫治疗
特发性膜性肾病(IMN)属于成人肾病综合征中较为常见的病理类型之一,该病的治疗效果在不同患者间有明显差异性,部分患者无法得到有效治疗,进而发展为终末期肾病[1]。究其原因,可能主要与IMN的发病机制复杂,临床长期以来缺乏对IMN足细胞靶抗原的认识有关[2]。近年来,随着M型磷脂酶A2受体(PLA2R)在IMN患者血清中被测出,PLA2R抗体已成为IMN相关研究的热点[3]。有研究认为血清PLA2R抗体表达水平对IMN的诊断存在一定局限性。有学者[4]研究表明,PLA2R可在足细胞中持续表达,约有75%的IMN患者肾组织中PLA2R表达呈阳性。因此,肾组织中PLA2R检测或可为临床诊断IMN提供帮助。本研究观察了IMN患者肾组织中PLA2R的表达情况,并分析其与免疫治疗疗效的关系,现报告如下。
1 资料与方法
1.1 临床资料 选择2014年5月~2016年7月我院收治的IMN患者82例,男52例、女30例,年龄35~72(52.1±13.4)岁。所有患者均经肾组织活检确诊为IMN,入院前未接受激素与免疫抑制剂治疗,排除病毒性肝炎、药物、肿瘤等继发性因素。入组研究对象均签署知情同意书,本研究经医院伦理委员会批准。
1.2 肾组织中PLA2R检测及分组 选取IMN患者的肾活检组织冰冻切片,采用免疫荧光法检测IMN患者肾组织中的PLA2R,严格按照PLA2R抗体试剂盒说明书进行操作。结果判定标准:阳性对照液的每孔吸光度/阴性对照液的每孔吸光度≥2.1记为阳性,反之记为阴性。根据PLA2R检测结果将IMN患者分为PLA2R阳性组和PLA2R阴性组。
1.3 治疗及观察方法 所有患者均给予激素联合环磷酰胺治疗,剂量0.6~0.8 g/月,采用静脉给药,累积剂量在8~10 g;同时给予泼尼松治疗,起始剂量为每次1 mg/kg、1次/d,连续治疗2个月后根据病情恢复情况逐渐减量。随访12个月。对比PLA2R阳性组与PLA2R阴性组治疗后3、6、12个月的血清白蛋白水平、24 h尿蛋白定量、治疗总有效率,比较两组治疗时间及不良反应发生率。疗效判定标准参考文献[5]:患者血清白蛋白、肌酐水平恢复正常,且24 h尿蛋白低于0.3 g为完全缓解;患者血清白蛋白、肌酐水平趋于稳定,且24 h尿蛋白低于3.5 g为部分缓解;未达到上述标准判定为未缓解。以(完全缓解例数+部分缓解例数)/总例数计算总有效率。
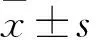
2 结果
2.1 IMN患者肾组织中PLA2R表达情况 PLA2R表达阳性者可见眼肾小球毛细血管半颗粒样分布的荧光,而阴性患者则无法观察到相应荧光。82例IMN患者中,PLA2R表达阳性58例、阴性24例。IMN患者肾组织中PLA2R阳性表达率为70.73%。
2.2 PLA2R阳性组、阴性组治疗后不同时间血清白蛋白与24 h尿蛋白定量比较 PLA2R阳性组患者治疗后3、6、12个月血清白蛋白水平均低于PLA2R阴性组,24 h尿蛋白定量均高于PLA2R阴性组(P均<0.05)。详见表1。

表1 PLA2R阳性组、阴性组治疗后不同时间血清白蛋白与24 h尿蛋白定量比较
2.3 PLA2R阳性组、阴性组治疗总有效率比较 PLA2R阳性组治疗后3、6、12个月总有效率分别为56.90%(33/58)、63.79%(37/58)、67.24%(39/59),PLA2R阴性组分别为87.50%(21/24)、95.83%(23/24)、100.00%(24/24),PLA2R阳性组治疗后3、6、12个月总有效率均低于PLA2R阴性组(P均<0.05)。
2.4 PLA2R阳性组、阴性组治疗时间及不良反应发生率比较 PLA2R阳性组治疗时间为(10.8±1.5)个月、不良反应发生率为36.21%(21/58),PLA2R阴性组分别为(5.7±1.1)个月和33.33%(8/24),PLA2R阳性组治疗时间长于PLA2R阴性组、不良反应发生率高于PLA2R阴性组(P均<0.05)。
3 讨论
目前临床上广泛用于治疗IMN的方案为糖皮质激素联合环磷酰胺,有一定的临床疗效[6]。IMN患者临床预后存在较大差异,对IMN的发病机制及预后的相关研究一直是国内外学者关注的热点[7,8]。多项研究[9,10]表明IMN的主要发病机制可能是足细胞免疫复合物沉积后激活补体,导致足细胞损伤,进一步产生蛋白尿。随着对PLA2R研究的不断深入,有学者推测其对IMN存在一定致病性,而IMN患者肾组织中表达的PLA2R属于重要靶抗原[11,12]。且有研究报道认为,膜攻击复合物的局部形成会导致足细胞的损伤,从而引起蛋白尿形成,而PLA2R在膜攻击复合物引发足细胞损伤过程中发挥着至关重要的作用,其不但可通过介导细胞膜磷脂水解引发足细胞损伤,亦可通过释放血栓素A2及花生四烯酸等导致足细胞损伤。
有研究显示,临床上只有20%左右的IMN患者病情可自发缓解,这部分患者体内无法检测到血清PLA2R抗体,推测血清PLA2R抗体与病情严重程度存在一定的相关性,也提示临床工作中可通过检测患者血清PLA2R抗体水平辅助诊断IMN。有学者在检测IMN患者血清PLA2R抗体时发现,治疗后病情得以缓解的IMN患者血清中PLA2R表达阳性率显著下降。国内外大量研究表明,肾脏PLA2R主要是通过胞内再循环于足细胞表面表达,且并不受患者病情变化而发生改变,因此可作为临床上较为稳定的标志物对IMN进行诊断[12,13]。
本研究观察了IMN患者肾组织中PLA2R的表达情况,并分析其与免疫治疗疗效的关系,期望为IMN发病机制的研究及临床治疗提供参考。本研究中,IMN患者肾组织中PLA2R阳性表达率为70.73%(58/82),与以往的报道相似。吕颖等[14,15]研究发现,PLA2R表达阳性与PLA2R表达阴性的IMN患者血肌酐、血清白蛋白及24 h尿蛋白定量存在显著差异,提示IMN患者肾组织中PLA2R表达水平与其病情严重程度可能有关。本研究结果显示,PLA2R阳性组患者治疗后3、6、12个月血清白蛋白水平均低于PLA2R阴性组,24 h尿蛋白定量均高于PLA2R阴性组,说明PLA2R表达阴性的IMN患者采用免疫治疗可更显著地改善血清白蛋白及24 h尿蛋白定量水平[16,17]。且PLA2R阳性组治疗后3、6、12个月总有效率均低于PLA2R阴性组,这提示PLA2R表达阴性的IMN患者采用免疫治疗的临床疗效更显著,说明IMN患者肾组织中PLA2R的表达水平对患者免疫治疗的反应及疗效具一定预测作用[18]。另外我们还发现PLA2R阳性组治疗时间长于PLA2R阴性组,不良反应发生率高于PLA2R阴性组,也佐证了上述观点,提示我们在临床治疗IMN过程中,可通过检查肾组织中PLA2R的表达情况,进一步对患者预后进行评估,同时也可为临床治疗提供参考依据[19,20]。
综上所述,IMN患者肾组织中PLA2R阳性表达率较高,PLA2R表达阳性的IMN患者较PLA2R表达阴性者免疫治疗效果差、治疗时间长、不良反应发生率高。检测肾组织中的PLA2R有助于评估IMN治疗效果和预后。但本研究纳入样本量较少,随访时间较短,上述结论需要增加样本量、延长随访时间进一步研究证实。
[1] Hu R, Xing G, Wu H, et al. Clinicopathological features of idiopathic membranous nephropathy combined with IgAnephropathy: a retrospective analysis of 9 cases[J]. Diagn Pathol, 2016,11(1):86.
[2] 王述莲,孙钧,郑继伟,等.抗磷脂酶A2受体抗体表达在特发性膜性肾病人肾组织及血液中的检测价值[J].实用医学杂志,2016,32(3):434-436.
[3] Bally S, Debiec H, Ponard D, et al. Phospholipase A2 Receptor-Related Membranous Nephropathy and Mannan-Binding Lectin Deficiency[J]. J Am Soc Nephrol, 2016,27(12):3539-3544.
[4] 王莉君,尚明花,诸葛一峰,等.特发性膜性肾病患者肾组织PLA2R的表达及其与免疫治疗疗效关系的初步探讨[J].中华医学杂志,2016,96(1):4-8.
[5] 及臻臻,管海玉,李成杰,等.特发性膜性肾病患者血清和肾组织中PLA2R、Nephrin的检测及其与病情的相关性[J].海南医学院学报,2016,22(18):2139-2142.
[6] Kubota K, Hoshino J, Ueno T, et al. Phospholipase A2 receptor-positive idiopathic membranous glomerulonephritis with onset at 95 years: case report[J]. Case Rep Nephrol Dial, 2016,6(2):76-82.
[7] 符克英,蔡俊宏,符生苗,等.抗磷脂酶A2受体抗体检测在老年人特发性膜性肾病肾组织及血液中的表达[J].中国老年学杂志,2016,36(17):4281-4283.
[8] Hihara K, Iyoda M, Tachibana S, et al. Anti-phospholipase A2 receptor (PLA2R) antibody and glomerular PLA2R expression in japanese patients with membranous nephropathy[J]. PLoS One, 2016,11(6):158154-158155.
[9] 董鸿瑞,王艳艳,王国勤,等.免疫组织化学和免疫荧光染色在肾活检组织石蜡切片磷脂酶A2受体检测中的应用[J].中国医学科学院学报,2015,37(5):562-566.
[10] 马莲子,刘郑荣,田建伟,等.特发性膜性肾病中血清M型磷脂酶A2受体1的临床意义[J].中华肾脏病杂志,2016,32(9):653-658.
[11] 邱杰山,胡良峰,张丽红,等.血清抗M型磷脂酶A2受体抗体对特发性膜性肾病的诊断价值[J].中华临床免疫和变态反应杂志,2016,10(1):15-20.
[12] Wen J, Xie K, Zhang M, et al. HLA-DR, and not PLA2R, is expressed on the podocytes in kidney allografts in de novomembranous nephropathy[J]. Medicine (Baltimore), 2016,95(37):4809-4810.
[13] Ge YC, Jin B, Zeng CH, et al. PLA2R antibodies and PLA2R glomerular deposits in psoriasis patients with membranousnephropathy[J]. BMC Nephrol, 2016,17(1):185-185.
[14] 吕颖,宓恩娜,周杨,等.肾小球IgG4和磷脂酶A2受体抗原对特发性膜性肾病诊断价值的研究[J].中国中西医结合肾病杂志,2016,17(3):256-257.
[15] 张丽丽,王祥,范小丽,等.成人特发性膜性肾病血清抗M型磷脂酶A2受体抗体与病情的相关性研究[J].中国现代医学杂志,2016,26(9):44-48.
[16] 林力,陈楠.磷脂酶A2受体抗体在膜性肾病临床诊治中的新进展[J].中华肾脏病杂志,2015,31(8):632-635.
[17] 秦华章.磷脂酶A2受体与特发性膜性肾病[J].肾脏病与透析肾移植杂志,2015,24(2):165-170.
[18] 丁丽娜,陈孟华,俞敏,等.特发性膜性肾病患者肾组织PLA2R抗体联合IgG4检测的临床意义[J].宁夏医科大学学报,2015,37(11):1256-1260.
[19] Dou Y, Zhang L, Liu D, et al. The accuracy of the anti-phospholipase A2 receptor antibody in the diagnosis of idiopathic membranous nephropathy: a comparison of different cutoff values as measured by the ELISA method[J]. Int Urol Nephrol, 2016,48(6):845-849.
[20] Gupta G, Fattah H, Ayalon R, et al. Pre-transplant phospholipase A2 receptor autoantibody concentration is associated with clinically significant recurrence of membranous nephropathy post-kidney transplantation[J]. Clin Transplant, 2016,30(4):461-469.
10.3969/j.issn.1002-266X.2017.27.024
R692.9
B
1002-266X(2017)27-0079-03
2017-01-18)

