纳米氧化锌对小鼠腹腔巨噬细胞Ana-1的毒性作用及机制
褚天雪,邢立国,袁娟,戴维,王媛,龙新宇,刘亭,左代英,吴英良
(1.沈阳药科大学生命科学与生物制药学院,辽宁沈阳110016;2.沈阳化工研究院安全评价中心,辽宁沈阳110021)
纳米氧化锌对小鼠腹腔巨噬细胞Ana-1的毒性作用及机制
褚天雪1,邢立国2,袁娟1,戴维1,王媛1,龙新宇1,刘亭1,左代英1,吴英良1
(1.沈阳药科大学生命科学与生物制药学院,辽宁沈阳110016;2.沈阳化工研究院安全评价中心,辽宁沈阳110021)
目的 研究纳米氧化锌(ZnO-NP)对小鼠腹腔源巨噬细胞(Ana-1)的毒性作用及机制。方法ZnO-NP 2.5~160 mg·L-1与Ana-1细胞作用24 h后,MTT法检测Ana-1细胞的存活率;吖啶橙-溴化乙锭(AO-EB)染色及流式细胞术观察Ana-1细胞凋亡;流式细胞术检测细胞对ZnO-NP的摄取;锌离子荧光探针测定细胞内的锌离子;乙二胺四乙酸(EDTA)螯合锌离子,检测细胞存活率。结果 ZnO-NP在2.5,5,10和20 mg·L-1浓度范围内能够浓度依赖性地抑制Ana-1细胞存活(r=0.905,P<0.05);ZnO-NP 20 mg·L-1组细胞存活率为细胞对照组的27.9%,细胞出现明显的凋亡样改变;ZnO-NP 40,80和160 mg·L-1组细胞摄取的ZnO-NP比细胞对照组显著增加(P<0.05);EDTA 2.5 mmol·L-1能够明显降低细胞内的自由锌离子,改善ZnO-NP 10 mg·L-1引起的细胞存活率下降(P<0.05)。螯合锌离子后,ZnO-NP对Ana-1细胞的毒性明显降低(P<0.05)。结论ZnO-NP可浓度依赖性增加Ana-1细胞的毒性,引起凋亡样改变,其毒性可能与其进入细胞并释放锌离子有关。
纳米;氧化锌;Ana-1细胞;细胞毒性
随着纳米科技的迅速发展,纳米材料被越来越广泛地应用于各个领域。纳米氧化锌(zinc oxide nanoparticles,ZnO-NP)是一种应用前景广泛的多功能无机纳米材料,其具有粒径微小、比表面积大和化学性质稳定等特点,被广泛应用于化妆品、电子产品、药物载体、治疗和诊断等各个领域[1-3],ZnO-NP对人类健康的潜在影响也日益引起人们关注。ZnO-NP具有一般普通微米级ZnO所无法比拟的性能和用途。然而,随着ZnO-NP的广泛应用,其安全性也越来越受到研究人员的广泛重视。ZnO-NP一旦进入生物体,与细胞膜作用形成微孔,或直接进入某些细胞器甚至细胞核内,产生一定的生物毒性[4]。
巨噬细胞作为免疫系统的一部分,以不同形式广泛分布于人体不同部位,在体液免疫和细胞免疫中发挥重要作用。受外界刺激后,巨噬细胞会产生一系列反应,吞噬外来物质,同时巨噬细胞本身也与免疫反应和炎症反应有关,并分泌一系列活性物质[5]。小鼠腹腔巨噬细胞Ana-1细胞,被广泛用于免疫毒性相关的研究中[6-8]。有研究表明,ZnO-NP有较强的体内毒性和体外细胞毒性;ZnO-NP可引起小鼠明显的肝、肺、肾和脑等器官的氧化应激及病理损伤[9-14];ZnO-NP也能够引起人肺上皮细胞、小鼠成纤维细胞、大鼠肾上皮细胞和人单核细胞等的明显细胞毒性改变[15-18]。大量研究都表示,ZnO-NP对细胞生长有极强的抑制作用,且明显高于其他类金属氧化物的纳米颗粒[19-24];在不同浓度ZnO-NP对人体主动脉细胞内皮的毒性效应的研究中,纳米颗粒出现内在化进入细胞的现象,ZnO-NP 50 mg·L-1有细胞毒性,可导致大量细胞死亡,但关于细胞死亡的机制尚不清楚,需进一步研究[25]。
ZnO-NP可通过呼吸道、消化道和皮肤等多种途径进入人体,并能通过体循环分布到各组织中。进入机体的ZnO-NP作为外来异物可能会引起机体特异性免疫反应。然而,尚无关于ZnO-NP对小鼠腹腔巨噬细胞Ana-1的毒性及相关机制研究报道。因此,为探讨ZnO-NP对正常免疫细胞的潜在影响,研究ZnO-NP对小鼠腹腔巨噬细胞Ana-1细胞的毒性及其机制,旨在为ZnO-NP的安全性评价提供实验依据。
1 材料与方法
1.1 细胞、试剂和仪器
Ana-1细胞购自中国中科院上海生物细胞所,用含10%胎牛血清的RPMI 1640培养基在37℃,5%CO2培养箱中培养,每天换液1次,培养至细胞融合70%~80%以上,倒置显微镜观察细胞生长情况,传代培养,取对数生长期细胞用于实验。
RPMI 1640培养基(批号:1663936),购自美国Gibco公司;胎牛血清(批号:09087213-2272),购自中国天津市灏洋生物制品科技有限责任公司;96孔板(批号:701001)购自中国NEST公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT,批号:705B054),购自美国Sigma公司;吖啶橙-溴化乙锭(acridine orange-ethidium bromide,AO-EB,批号:20151023)染料和碘化丙啶(propidium iodide,PI,批号:C0080),均购自中国索莱宝公司;ZnO-NP(50 nm),购自中国皓田纳米科技有限公司;Zinquin ethyl ester探针(批号:JM829),购自日本同仁化学研究所。
1.2 ZnO-NP悬液的制备
ZnO-NP在使用前经183℃干热灭菌3 h。灭菌后的ZnO-NP用无血清RPMI 1640培养基(pH 7.3)配成悬液。加ZnO-NP悬液前,用超声波仪超声30 min,以防ZnO-NP产生凝聚现象。
1.3 MTT法检测细胞存活率
将计数后的细胞悬液(4×108L-1)加入96孔板,每孔3.2×104个细胞,分为ZnO-NP 2.5,5,10,20,40,80和160 mg·L-1组和不加ZnO-NP的正常细胞对照组,各组设3复孔,待细胞与ZnO-NP共孵育24 h后,取出96孔板,每孔加入20 μL MTT(5 g·L-1),4 h后每孔加入100 μL三联液(5 mL异丁醇,10 g SDS,0.1 mL HCl 10 mol·L-1),过夜后,用多功能酶标仪测量570和630 nm处的吸光度值(A)。采用双波长法计算细胞存活率。细胞存活率(%)=(处理组A570nm-处理组A630nm)/(对照组A570nm-对照组A630nm)×100%。
1.4 流式细胞术检测Ana-1细胞对ZnO-NP的摄取
纳米颗粒被细胞摄取后,细胞会由于吞噬行为内部结构变复杂,细胞所摄取的纳米颗粒与细胞内结构的复杂程度正相关,流式细胞仪检测侧向散射(SSC)与细胞内颗粒结构呈近直线关系。细胞内颗粒越复杂,其SSC越大,细胞摄取的颗粒越多。取对数生长期Ana-1细胞,吹打、重悬、计数后,以1×109L-1的密度接种于6孔板,分为ZnO-NP 10,20,40,80或160 mg·L-1组和不加ZnO-NP的细胞对照组,4 h后收集细胞。472×g离心5 min,重悬,上样,计数1×104个细胞,数据采用Cell Quest软件(Becton Dickison)进行分析处理。
1.5 AO-EB染色法检测细胞膜完整性
取对数生长期Ana-1细胞,吹打、重悬、计数后,以1×109L-1的密度接种于24孔板中,根据MTT结果 ,使用ZnO-NP 40 mg·L-1与Ana-1细胞共孵育24 h,收集细胞。每孔加入200 μL AO-EB应用液(5 mg·L-1),避光孵育5 min,118×g离心5 min,弃上清,加入PBS重悬,吸取50 μL滴于载玻片上,盖上盖玻片,于荧光显微镜下观察。AO能透过完整细胞膜并嵌入细胞核DNA,使之发出亮绿色荧光,而EB仅能透过细胞膜受损的细胞,嵌入DNA后发出橘黄色荧光。
1.6 PI染色法检测细胞凋亡
取对数生长期Ana-1细胞,吹打、重悬和计数后,以1×106L-1的密度接种于6孔板中,分为ZnO-NP 10,20,40和80 mg·L-1组和不加ZnO-NP的细胞对照组,作用48 h后收集细胞。472×g离心10 min,弃上清,加入500 μL的PBS,混匀。再加入10 mL 70%冰乙醇,-20℃保存,实验前1天置于4℃预冷。472×g离心10 min,弃上清。PBS重悬,洗涤3次,上样,计数10 000个细胞,数据采用Cell Quest软件(Becton Dickison)进行分析处理。PI是一种DNA荧光染料,结合DNA后发出荧光,以流式细胞仪进行测量,可得出细胞内DNA含量分布情况,亚G1期是细胞凋亡的特征之一,由此分析细胞凋亡。
1.7 荧光探针法检测细胞内自由锌离子
按1.5处理细胞,作用4 h后收集细胞。472×g离心5 min,加入锌离子荧光探针悬液,终浓度为2.4 μmol·L-1,避光、共孵育30 min,用无血清RPMI 1640培养基洗3次,然后加入50 μL封片剂,混匀,滴于载玻片上,盖上盖玻片,操作过程避免振动。于共聚焦显微镜下观察。zinquin ethyl ester具有膜通透性,自身也有荧光,但它自身的荧光强度几乎可忽略不计,被细胞内的酯酶剪切,从而被滞留在细胞内,结合锌离子后在紫外激发下发蓝色荧光。
1.8 EDTA螯合锌离子MTT法检测细胞存活
使用乙二胺四乙酸(ethylene diamine tet-raacetic acid,EDTA)2.5,5,10和20 mmol·L-1分别与ZnO-NP 0,10,20,40和80 mg·L-1共孵育Ana-1细胞24 h,MTT法检测细胞存活,采用双波长法计算细胞存活率。
1.9 统计学分析
实验结果 数据均用x±s表示,使用SPSS 13.0软件对实验数据进行单因素方差分析(one-way ANOVA),方差齐时用LSD法,方差不齐时用Dunnettt法,以P<0.05为差异有统计学意义。
2 结果
2.1 ZnO-NP对细胞存活率的影响
Ana-1细胞与ZnO-NP 2.5,5,10和20 mg·L-1共同孵育24 h后,细胞的存活率随ZnO-NP浓度的增加呈浓度依赖性地降低(r=0.905,P<0.05)(图1)。ZnO-NP 20 mg·L-1组细胞存活率下降至细胞对照组的27.9%,ZnO-NP浓度≥40 mg·L-1时,细胞存活率<14.5%。

Tig.1 Effect of zinc oxide nanoparticles(ZnO-NPs)on viability of Ana-1 cells by MTT assay.Ana-1 cells were incubated with ZnO-NPs 2.5,5,10,20,40,80 and 160 mg·L-1for 24 h.x±s,n=3.*P<0.05 compared with cell control(0)group.
2.2 ZnO-NP对Ana-1细胞摄取能力的影响
Ana-1细胞摄取ZnO-NP结果 如图2所示,与细胞对照组比较,ZnO-NP 40,80和160 mg·L-1组摄取ZnO-NP的细胞百分率显著增多(P<0.05)。ZnO-NP 10和20 mg·L-1组摄取ZnO-NP细胞的百分率与细胞对照组无显著差异。
2.3 ZnO-NP对Ana-1细胞膜完整性的影响
AO染色结果 (图3)显示,细胞对照组细胞核呈现为均匀的绿色,位于细胞中央,EB基本未见着色;而ZnO-NP 40 mg·L-1组可见细胞核发出明亮的绿色荧光,部分细胞被EB染色,表现为橘红色荧光增强,提示细胞膜完整性被破坏,凋亡及坏死细胞逐渐增多。
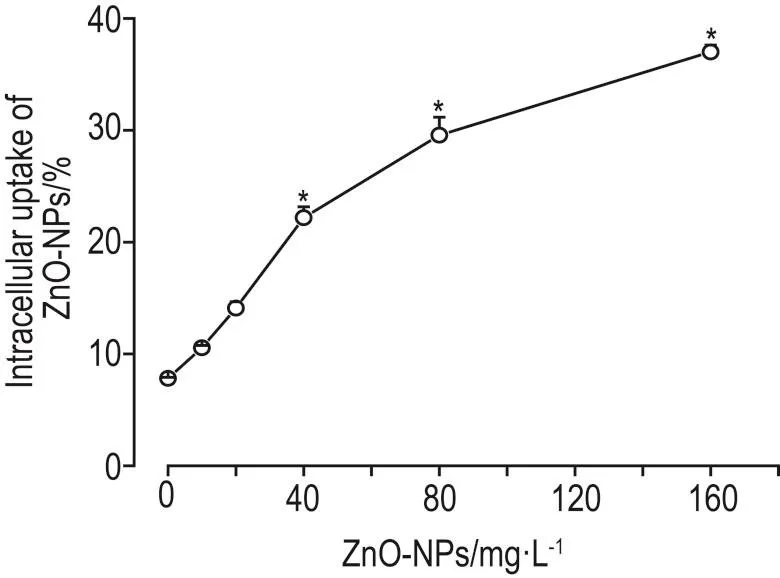
Fig.2 Effect of ZnO-NP on uptake of Ana-1 cells.Ana-1 cells were incubated with ZnO-NPs 10,20,40,80 and 160 mg·L-1for 4 h.x±s,n=3.*P<0.05,compared with cell control(0)group.

Fig.3 Effect of ZnO-NPs on integrity of cell membrane of Ana-1 cell by AO-EB staining.Ana-1 cells were incubated with ZnO-NPs 40 mg·L-1for 24 h.Arrows show cells stained by ethidium bromide(EB).
2.4 ZnO-NP对Ana-1细胞凋亡的影响
流式细胞仪检测结果 (图4)显示,与细胞对照组相比,ZnO-NP 20,40和80 mg·L-1组亚G1期细胞数明显增多(r=0.776,P<0.05),提示ZnO-NP能够诱导Ana-1细胞凋亡,产生明显的毒性反应。
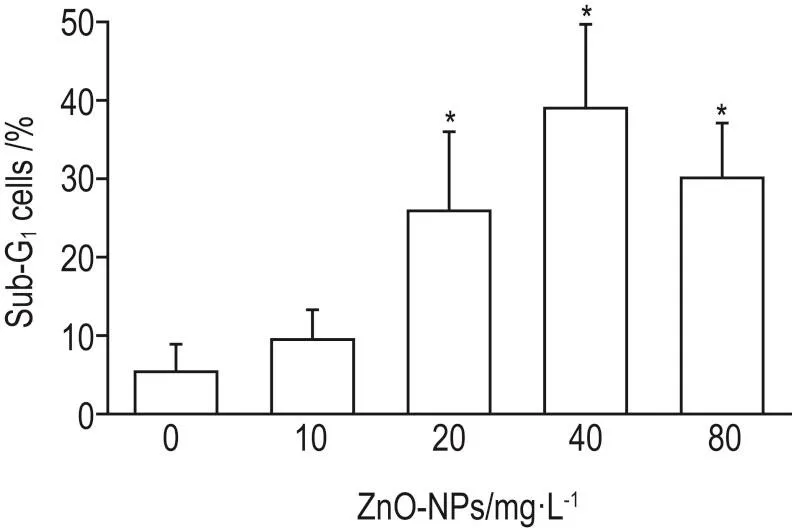
Fig.4 Effect of ZnO-NPs on Ana-1 cell number at sub-G1by flow cytometry.Ana-1 cells were incubated with ZnO-NPs for 48 h.x±s,n=3.*P<0.05,compared with cell control(0)group.
2.5 ZnO-NP对细胞内锌离子的影响
细胞内自由锌离子检测结果 (图5)显示,细胞对照组细胞内未检测到自由锌离子;加入ZnO-NP 40 mg·L-14 h后细胞内检测到自由锌离子;提示ZnO-NP可被Ana-1细胞摄取,并在细胞内释放出自由锌离子。

Fig.5 Effect of ZnO-NPs on intracellular free zinc ion of Ana-1 cells by zinquin ethyl ester.Ana-1 cells were incubated with ZnO-NPs 40 mg·L-1for 4 h.
2.6 EDTA螯合锌离子后ZnO-NP对细胞存活率的影响
EDTA 2.5和5 mmol·L-1能够明显改善ZnO-NP 10 mg·L-1所引起的细胞存活率下降(P<0.05)。EDTA 10 mmol·L-1能够明显改善ZnO-NP 20 mg·L-1所引起的细胞存活率下降(P<0.05),而EDTA 20 mmol·L-1能够明显改善ZnO-NP 10,20和40 mg·L-1所引起的细胞存活率下降(P<0.05)(图6)。提示ZnO-NP在细胞内产生的锌离子是ZnO-NP对细胞产生毒性的主要途径之一。
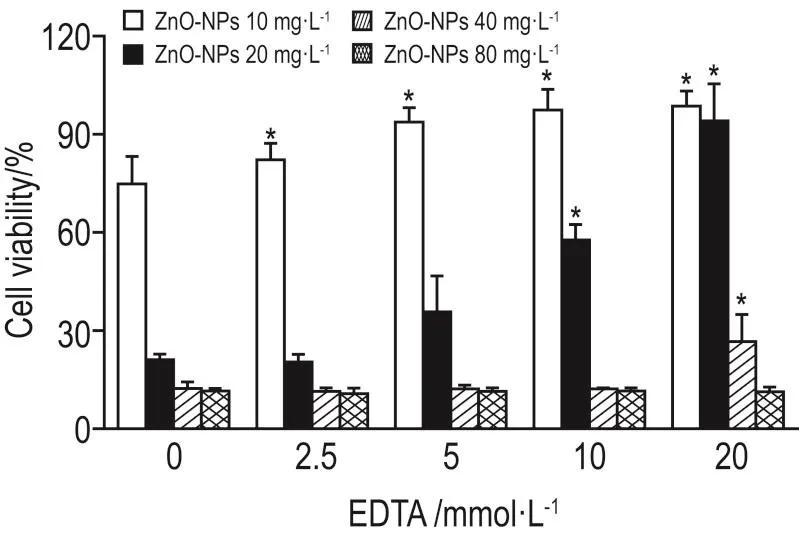
Fig.6 Effect of ZnO-NPs on viability of Ana-1 cells after chelating zinc ions with EDTA by MTT assay.Ana-1 cells were incubated with ZnO-NPs and EDTA for 24 h.x±s,n=3.*P<0.05,compared with ZnO-NPs only group.
3 讨论
本研究结果 表明,ZnO-NP随着浓度增加,对细胞产生的毒性也逐渐加大,表现为细胞存活率降低,这与文献中报道的ZnO-NP对细胞具有极强的抑制作用一致[19-24]。AO-EB染色和PI单染流式细胞术检测结果 显示,ZnO-NP作用Ana-1细胞后,均出现明显的凋亡样改变。流式细胞术测定细胞摄取ZnO-NP颗粒的结果 表明,细胞内ZnO-NP颗粒浓度依赖性增多,这与MTT法测定不同浓度ZnO-NP对细胞存活率影响的趋势一致;随着细胞内ZnO-NP颗粒的增加,产生的毒性也显著升高。文献报道,纳米颗粒在体外和体内条件下都易被摄入细胞膜,从而影响细胞功能[26],这与本研究的流式细胞术测定细胞摄取ZnO-NP颗粒的结果 一致。同时,检测细胞内自由锌离子时,只有加入ZnO-NP组可检测到锌离子,未加ZnO-NP的对照组则无法检测到锌离子的存在,提示ZnO-NP颗粒会在介质中解离出锌离子,并进入细胞内。当采用EDTA螯合介质中的锌离子时,ZnO-NP产生的毒性明显降低,提示ZnO-NP可能通过介质中解离出的自由锌离子产生细胞毒性。已有研究表明,解离的锌离子是纳米氧化锌颗粒产生毒性作用的原因,这个观点在本研究的结果 中得到印证[27]。
AO-EB染色与PI单染流式细胞术的结果 共同表明,ZnO-NP可诱导细胞凋亡。在ZnO-NP暴露24 h后,AO-EB染色结果 出现凋亡样改变,但仅有少量细胞出现细胞凋亡现象。在PI单染流式细胞术结果 中,ZnO-NP暴露48 h后,细胞出现显著的凋亡现象。这可能是由于ZnO-NP通过多种方式诱导细胞死亡,如接触初期主要通过其他途径诱导细胞死亡,ZnO-NP长时间暴露才会诱导细胞凋亡。ZnO-NP是通过何种途径诱导细胞死亡,尚有待于进一步研究。
综上所述,ZnO-NP在低浓度时产生的毒性较小,当浓度40 mg·L-1时产生明显的细胞毒性,所以在ZnO-NP的应用过程中,应注意ZnO-NP使用剂量的安全范围。ZnO-NP确实对免疫细胞产生毒性,且随着暴露浓度增大而加大。同时,ZnO-NP产生毒性的机制可能与细胞摄取纳米颗粒的量和ZnO-NP解离出自由锌离子的量有关。
[1]Xiong HM.ZnO nanoparticles applied to bioimaging and drug delivery[J].Adv Mater,2013,25(37):5329-5335.
[2]Wiesenthal A,Hunter L,Wang S,Wickliffe J,Wilkerson M.Nanoparticles:small and mighty[J].nt J Dermatol,2011,50(3):247-254.
[3]Gao GY,Chen ML,Li MY,Yang ZB,Li ZP,Mei XG.Current status and prospect of translational medicine in nanotechnology[J].Acta Pharm Sin(药学学报),2015,50(8):919-924.
[4]Kim YR,Park SH,Lee JK,Jeong J,Kim JH,Meang EH,et al.Organization of research team for nano-associated safety assessment in effort to study nanotoxicology of zinc oxide and silica nanoparticles[J].Int J Nanomed,2014,9(Suppl 2):3-10.
[5]Kim S,Oh WK,Jeong YS,Hong JY,Cho BR,Hahn JS,et al.Cytotoxicity of,and innate immune response to,size-controlled polypyrrole nanoparticles in mammalian cells[J].Biomaterials,2011,32(9):2342-2350.
[6]Liu D,Yang PS.Minocycline hydrochloride nanoliposomes inhibit the production of TNF-α in LPS-stimulated macrophages[J].Int J Nanomed,2012,7:4769-4775.
[7]Wei J,Guo H,Kuo PC.Endotoxin-stimulated nitric oxide production inhibits expression of cytochrome c oxidase in ANA-1 murine macrophages[J].J Immunol,2002,168(9):4721-4727.
[8]Qin Q,Niu J,Wang Z,Xu W,Qiao Z,Gu Y. Astragalus membranaceus inhibits inflammation via phospho-P38 mitogen-activated protein kinase(MAPK)and nuclear factor(NF)-κB pathways in advanced glycation end product-stimulated macrophages[J].Int J Mol Sci,2012,13(7):8379-8387.
[9]Yang X,Shao H,Liu W,Gu W,Shu X,Mo Y,et al.Endoplasmic reticulum stress and oxidative stress are involved in ZnO nanoparticle-induced hepatotoxicity[J].Toxicol Lett,2015,234(1):40-49.
[10]Adamcakova-Dodd A,Stebounova LV,Kim JS,Vorrink SU,Ault AP,O′Shaughnessy PT,et al. Toxicity assessment of zinc oxide nanoparticles using sub-acute and sub-chronic murine inhalation models[J].Part Fibre Toxicol,2014,11:15.
[11]Shrivastava R,Raza S,Yadav A,Kushwaha P,Flora SJ.Effects of sub-acute exposure to TiO2,ZnO and Al2O3nanoparticles on oxidative stress and histological changes in mouse liver and brain[J].Drug Chem Toxicol,2014,37(3):336-347.
[12]Esmaeillou M,Moharamnejad M,Hsankhani R,Tehrani AA,Maadi H.Toxicity of ZnO nanoparticles in healthy adult mice[J].Environ Toxicol Pharmacol,2013,35(1):67-71.
[13]Sharma V,Singh P,Pandey AK,Dhawan A. Induction of oxidative stress,DNA damage and apoptosis in mouse liver after sub-acute oral exposure to zinc oxide nanoparticles[J].Mutat Res,2012,745(1-2):84-91.
[14]Li CH,Shen CC,Cheng YW,Huang SH,Wu CC,Kao CC,et al.Organ biodistribution,clearance,and genotoxicity of orally administered zinc oxide nanoparticles in mice[J].Nanotoxicology,2012,6(7):746-756.
[15]Uzar NK,Abudayyak M,Akcay N,Algun G,Özhan G.Zinc oxide nanoparticles induced cytoand genotoxicity in kidney epithelial cells[J].Toxicol Mech Methods,2015,25(4):334-339.
[16]Javidi M,Zarei M,Omidi S,Ghorbani A,Gharechahi M,Rad MS.Cytotoxicity of a new nano zinc-oxide eugenol sealer on murine fibroblasts[J]. Iran Endod J,2015,10(4):231-235.
[17]Sahu D,Kannan GM,Vijayaraghavan R,Anand T,Khanum F.Nanosized zinc oxide induces toxicity in human lung cells[J].ISRN Toxicol,2013,2013:316075.
[18]Senapati VA,Kumar A,Gupta GS,Pandey AK,Dhawan A.ZnO nanoparticles induced inflammatory response and genotoxicity in human blood cells:a mechanistic approach[J].Food Chem Toxicol,2015,85:61-70.
[19]Deng X,Luan Q,Chen W,Wang Y,Wu M,Zhang H,et al.Nanosized zinc oxide particles induce neural stem cell apoptosis[J].Nanotechnology,2009,20(11):115101.
[20]Jeng HA,Swanson J.Toxicity of metal oxide nanoparticles in mammalian cells[J].J Environ Sci Health A Tox Hazard Subst Environ Engng,2006,41(12):2699-2711.
[21]Beckett WS,Chalupa DF,Pauly-Brown A,Speers DM,Stewart JC,Frampton MW,et al.Comparing inhaled ultrafine versus fine zinc oxide particles in healthy adults:a human inhalation study[J].Am J Respir Crit Care Med,2005,171(10):1129-1135.
[22]Horie M,Nishio K,Fujita K,Endoh S,Miyauchi A,Saito Y,et al.Protein adsorption of ultrafine metal oxide and its influence on cytotoxicity toward cultured cells[J].Chem Res Toxicol,2009,16;22(3):543-553.
[23]Lin WS,Xu Y,Huang CC,Huang YW.Toxicity of nano-and micro-sized ZnO particles in human lung epithelial cells[J].J Nanopart Res,2009,11(1):25-39.
[24]Sayse CM,Reed KL,Subramoney S,Warheit D. Can in vitro assays substitute for in vivo studies inassessing the pulmonary hazards of fine and nanoscale materials?[J].J Nanopart Res,2009,11(2):421-431.
[25]Sayes CM,Reed KL,Warheit DB.Assessing toxicity of fine and nanoparticles:comparing in vitro measurements to in vivo pulmonary toxicity profiles[J].Toxicol Sci,2007,97(1):163-180.
[26]Li XM.Properties and applications of nanometer ZnO[J].J Tonghua Teach Coll(通化师范学院学报),2004,25(4):54-56.
[27]Song W,Zhang J,Guo J,Zhang J,Ding F,Li L,et al.Role of the dissolved zinc ion and reactive oxygen species in cytotoxicity of ZnO nanoparticles[J].Toxicol Lett,2010,199(3):389-397.
Cytotoxicity and mechanism of zinc oxide nanoparticles on murine macrophage Ana-1 cells
CHU Tian-xue1,XING Li-guo2,YUAN Juan1,DAI Wei1,WANG Yuan1,LONG Xin-yu1,
LIU Ting1,ZUO Dai-ying1,WU Ying-liang1
(1.College of Life Science and Biopharmaceuticals,Shenyang Pharmaceutical University, Shenyang 110016,China;2.Safety Evaluation Center of Shenyang Research Institute of Chemical Industry Ltd.,Shenyang 110021,China)
OBJECTIVETo study the toxicity of zinc oxide nanoparticles(ZnO-NPs)on murine macrophage Ana-1 cells and the mechanism.METHODSAna-1 cells were incubated with ZnO-NP (2.5-160 mg·L-1).Cell viability was investigated by MTT assay.The integrity of cell membrane was investigated by acridine orange-ethidium bromide(AO-EB)staining.The intracellular uptake of ZnO-NP and the percentage of sub-G1of Ana-1 cells were detected by flow cytometry.Zinc ions were determined by fluorescent probe.The change of cell viability was studied after chelating zinc ions with ethylene diamine tetraacetic acid(EDTA).RESULTSZnO-NP 2.5,5,10 and 20 mg·L-1decreased cell viability of Ana-1 cells(r=0.905,P<0.05)in a concentration-dependent manner.The cell viability was decreased to 27.9%after exposure to ZnO-NP 20 mg·L-1.Intracellular uptake of ZnO-NP was increased after Ana-1 cell incubated with ZnO-NP at concentrations ranging from 40 to 160 mg·L-1(P<0.05).There were obvious free zinc ions in the cells.EDTA 2.5 mmol·L-1significantly increased the cell viability decreased by ZnO-NP 20 mg·L-1(P<0.05).Chelating free zinc ions significantly mitigated ZnO-NP induced cell toxicity (P<0.05).CONCLUSIONCytotoxicity and apoptosis of Ana-1 cells induced by ZnO-NP might be related to intracellular uptake of ZnO-NP and release of zinc ions.
nanoparticles;zinc oxide;Ana-1 cells;cytotoxicity
The project supported by National Science and Technology Major Project of China(2013ZX09302304); and Liaoning Province Undergraduate Training Program for Innovation and Entrepreneurship(125010128)
ZUO Dai-ying,E-mail:zuodaiying@163.com;WU Ying-liang,E-mail:yingliang_1016@163.com
R99
A
1000-3002-(2017)06-0636-06
10.3867/j.issn.1000-3002.2017.06.020
2016-04-22接受日期:2017-05-23)
(本文编辑:贺云霞)
国家科技重大专项(2013ZX09302304);辽宁省大学生创新创业训练计划项目(125010128)
褚天雪,女,硕士研究生,主要从事纳米材料的毒性研究。
左代英,E-mail:zuodaiying@163.com;吴英良,E-mail:yingliang_1016@163.com

