毒理学研究的高内涵筛选及其在药物肝毒性研究中的应用
葛帅,汤纳平,付立杰,马璟
(中国医药工业研究总院国家上海新药安全评价研究中心,上海201203)
毒理学研究的高内涵筛选及其在药物肝毒性研究中的应用
葛帅,汤纳平,付立杰,马璟
(中国医药工业研究总院国家上海新药安全评价研究中心,上海201203)
药物性肝损伤(DILI)是导致药物研发终止或从市场撤回的重要原因之一,建立可预测、高通量的临床前检测系统以评估临床潜在的肝毒性是药物研发的迫切需要。基于细胞成像的高内涵筛选(HCS)技术,允许同时检测多个细胞参数,通过实时监测多种信号通路阐明细胞损伤的机制,具有高度的敏感性和特异性。目前已有多种肝细胞模型用于高内涵毒性筛选。本文介绍了HCS技术,回顾了近年来利用高内涵成像技术获得的药物肝毒性资料,探讨了其在肝毒性机制探索中的应用,以及高内涵成像技术在DILI研究中的作用。
高内涵筛选;肝毒性;毒理学
药物性肝损伤(drug-induced liver injury,DILI)是一种常见的药物不良反应,在药物性靶器官毒性中排第二位,仅次于心脏毒性[1]。尤其是特异质DILI对一些患者的严重性和不可预测性,已成为制药行业、监管机构以及临床上面临的主要挑战[2]。DILI已被证实是一个由多种机制参与的复杂病理过程[3],传统的细胞毒性筛选依赖于对不同毒性指标的单终点测定,无法准确反映一个细胞群体的损伤或死亡状况。而高内涵筛选(high-content screening,HCS)技术能够定量和动态监测由药物或其他化合物引起的细胞形态学、生化指标和细胞功能的改变,实现了对单细胞群的多参数和多靶点分析。本文整合了近年来利用HCS技术获得的药物肝毒性资料及其在肝毒性机制探索中的应用,以探讨HCS技术在早期肝毒性筛选中的应用前景。
1 高内涵筛选技术的原理
1.1 高内涵筛选技术概述
HCS技术是一种结合自动化荧光显微镜的细胞定量成像分析系统。它可以在保持细胞结构和功能完整的前提下,检测药物或化合物对细胞的作用,确定药物或化合物的生物活性或潜在毒性。其基本工作流程是:化合物处理后的细胞与指示不同细胞毒性参数的多种荧光探针混合物孵育,通过自动化荧光显微镜多通道波长照射细胞成像,由成像技术捕获图像信息后,经专业的图像处理软件在单个细胞水平对大量的细胞及相关靶点进行识别和运算,最后由数据管理软件统计分析得到相应的生物学特性的数据(图1)。与单细胞毒性试验检测药物的毒性相比,这种多参数检测策略为提高检测轻微毒性的敏感度提供了可能性[4-5],进而可大大减少细胞、试剂和待测化合物的用量。同时,多通道复合检测结果 可以通过软件计算出在同一细胞中不同参数值之间的关系,有助于更好地解释由细胞处理引起的潜在改变[6]。
1.2 高内涵筛选系统的组成
高内涵检测仪是实现HCS的必备仪器,一般由自动化荧光图像获取系统、图像分析系统和数据管理系统组成,有的还配备自动加样器和环境控制系统,实现多孔板自动加样以及维持细胞检测时正常的生存环境。
HCS区别于普通荧光显微镜的最大特点是其图像获取系统的全自动化和高速化。成像系统通常包括连续光源带、多通道激发和发射滤光片、显微镜模块和高速高分辨率图像传感器。新型显微镜成像技术的发展大大提高了获取图像的速度、质量和灵活度,如全自动水浸物镜浸液扫描的应用大大提高了图像分辨率;与传统共聚焦技术固定针孔相比,高速转盘和可变针孔自动对焦,短时间内精确扫描多通道的荧光信号;大芯片电荷耦合器件(charge coupled device,CCD)相机的成像视野约是标准芯片相机的4倍,能够更细致地获取细胞微观结构。
对于真正的HCS高通量实验,需要评估成千上万个图像,单纯依靠手动评分变得不可行,这对图像的自动化处理提出了很高的要求。图像和数据分析的主要步骤包括:图像处理、象分割、特征提取和选择以及统计分析。在图像采集之后,首先需要通过滤波器消除噪声,对图像进行背景校正;接下来通过相应的算法对细胞进行分割并定义显微镜图像中感兴趣的区域,提取如细胞核与细胞面积比等定量特征;不是所有提取的特征都适用于要解决的生物学问题,需要研究人员根据给定的生物学问题选择特征子集用于后续分析;最后通过数据挖掘模块,可视化和量化所检测的参数,并对其进行统计比较,将每个细胞的大量测量结果 转化为生物学上有意义的结果 。
另外,HCS产生的信息丰富,越来越复杂的图像分析算法会产生TB级容量的图像数据,为此开发的数据管理系统应运而生,如科学图像数据库(the Scientific Image DataBase)和开放显微镜检查环境(the Open Microscopy Environment)等高内涵数据管理平台的应用[7-8],在数据分析过程中可以方便地注释、建档、检索及存储高内涵图像和数据。
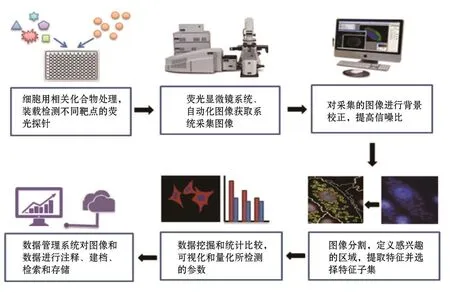
图1 高内涵筛选工作流程
2 高内涵筛选技术在药物性肝损伤筛选中的应用
HCS现已成为公认的药物研发早期毒性筛选的有力工具。不同的多探针HCS检测技术已用于药物肝毒性分类及候选化合物优先开发分级。
Tolosa等[5]采用HepG2细胞通过HCS技术确定78种化合物的肝毒性类型。待测化合物处理后的细胞装载细胞核指示剂Hoechst33342、细胞核指示剂碘化丙啶(propidium iodide,PI)、线粒体膜电位(mitochondrial membrane potential,MMP)指示剂四甲基罗丹明甲酯(tetramethylrhodamine methyl ester,TMRM)、脂肪指示剂氟硼二吡咯(BODIPY)665/676和钙离子指示剂氟-4乙烯氧甲酯(fluo-4 acetoxymethyl ester,Fluo-4 AM),利用Scan和In Cell Analyzer系统联合获取细胞图像,Scan分析模块对细胞图像分析,最终可分别通过不同肝毒性作用机制和肝损伤程度2种方式对78种化合物分类,所得结果 有很高的敏感性(MMP、氧化应激、细胞内钙离子浓度和核型变化的敏感性分别为83%,97%,100%和63%)。
Persson等[9]开发了一种“四探针法”HCS检测用于新药开发早期候选化合物的DILI风险评估。该实验选取临床已知肝毒性谱的100种药物进行验证,将这些药物分为严重、中度和无肝毒性3个级别,分别与HepG2细胞孵育后加入4种混合荧光探针,检测细胞毒作用相关的6个参数:核数、核面积、质膜完整性、溶酶体活性、MMP和线粒体面积。实验结果 发现,当药物浓度<100倍人体最大血浆药物浓度时,若细胞≥2个参数表示毒性效应,通常该药物具有肝毒性;若细胞<2个参数表示毒性效应,一般为非肝毒性药物。综合6个参数检测结果 并进行分层聚类分析,证明该方法能够在实验浓度范围内准确鉴别肝细胞毒性药物(肝毒性导致撤市药物、严重或中度肝毒性药物)和非肝毒性药物,而且可以实现有效预测先导化合物或候选药物是否具有诱导肝毒性的倾向,为新药标准化预测肝细胞毒性提供了整体视角。
3 高内涵筛选技术在药物性肝损伤机制研究中的应用
3.1 线粒体损伤
线粒体在细胞存活中扮演着整合各种细胞信号通路与维持细胞代谢的关键角色,其结构和功能的损伤是造成DILI的常见机制。线粒体损伤会造成各种有害结果 ,如氧化应激、ATP耗竭、脂肪变性和细胞死亡。这些结果 进而造成DILI不同的临床表现,从临床无症状的血清生化指标轻度改变到严重的毒性反应包括脂肪性肝炎、肝硬变和肝衰竭[10]。考虑到线粒体毒性的严重后果,越来越多的研究者推荐将线粒体毒性效应纳入新药毒理学的研究体系。
通常,线粒体结构异常、电子传递链紊乱以及MMP改变会同步发生,在单细胞水平对线粒体相关的多个参数同步检测有助于更好地了解它们之间的相互作用[11],而采用HCS技术研究线粒体实现了其多参数实时同步定量监测。除了其他通用的HCS分析将MMP作为研究DILI相关的主要机制,数个实验室重点研究线粒体功能障碍。如Tolosa等[10]设计了基于HCS的多参数早期化合物筛选方法用于评估潜在的线粒体肝毒性药物,采用多种荧光探针进行不同的组合实验,利用HCS系统获取细胞图像并进行定量分析,筛选引起线粒体损伤的药物,研究线粒体损伤诱因和凋亡诱因等。通过该方法阐述了一系列涉及他汀类药物肝毒性的细胞机制,证实他汀类药物可通过增加线粒体超氧化物、改变MMP及细胞质钙离子浓度等机制诱导线粒体毒性,这在以往出版的文献中少有报道。该方法对于特异性的靶向线粒体损伤检测有很高的敏感性。Kim等[12]采用HCS系统实时监测HepG2细胞成像,通过相应的荧光探针试剂盒检测细胞内钙离子浓度、线粒体渗透性转变、胱天蛋白酶3活性等细胞参数,发现奈法唑酮、托卡朋和曲格列酮通过线粒体损伤介导肝细胞毒性;而通过胱天蛋白酶8抑制测验表明,吡罗昔康是通过非线粒体途径造成肝细胞损伤。由此可见,采用HCS技术检测线粒体毒性有望成为体外药物测试和安全性评价的领先策略。
3.2 胆汁淤积
药物引起的胆汁淤积性肝损伤大致可分为急性和慢性2种,表现为肝内胆汁淤积和胆小管扩张,经常伴有胆栓,严重的可导致胆管消失综合征,并最终可能导致纤维化和肝硬变[13]。胆盐从肝细胞输出主要依赖于原发性主动外排转运蛋白的参与,如胆盐输出泵(bile salt export pump,BSEP)、多药耐药相关蛋白2(multidrug resistance-associated protein 2,MRP2)。BSEP基因突变与肝胆汁淤积症有关,药物往往通过抑制BSEP和MRP2导致胆汁淤积性肝损伤[14]。
因啮齿类动物与人的胆囊组成上的差异,导致其对胆汁淤积性肝损伤不明显。这使得体外药物致胆汁淤积评价实验变得更有价值[14-15]。目前常用的体外模型为转运蛋白过表达的囊泡系统或结合细胞成像技术的三维结构的肝细胞。采用夹层胶原“三明治”结构培养的肝细胞在体外可形成组织样结构的小管,形态上与体外肝切片非常相似,更接近体内的情况[15]。而借助HCS系统可实时定量分析胆盐转运至组织样小管的过程。
Xu等[16]在肝细胞成像分析技术的基础上开发了胆汁流量成像分析技术,采用胆盐类似物胆酰赖氨酰荧光素(cholyl-lysyl-fluorescein,CLF)作为荧光探针作用于三维结构的人原代肝细胞,通过HCS系统获取细胞图像后由相应的图像分析软件处理,可观察到肝细胞形成的胆管结构,并能通过胆汁流量成像评价胆管转运功能。随后,Germano等[17]选用“三明治”结构培养的肝细胞,与待测化合物孵化14 d模仿慢性药物治疗,HCS技术检测MRP2介导的胆管运输、中性脂肪和磷脂积累等功能性终点。结果 表明,相比于脂肪肝和磷脂沉积预测,此研究系统更适于药源性胆汁淤积症的研究。最近报道了一种细胞胆管成像检测法测定化合物对胆汁运输的整体的抑制作用[18],该方法采用CLF和羧甲基荧光素二乙酸酯(carboxy-methylfluorescein diacetate,CMFDA)分别作为BSEP和MRP2的底物,通过检测CLF或CMFDA代谢物在小管的荧光强度确定药物对转运蛋白的抑制程度。结果 发现,肝细胞CLF积累的IC50值与人BSEP囊泡实验的IC50值有很高的一致性。与此同时,研究者也对这2种荧光染料的特异性提出了质疑。这些研究表明,HCS技术是胆汁淤积肝损伤研究中有前景的药物筛选工具。
3.3 脂肪变性
参与脂肪变性的主要机制是直接或间接抑制长链脂肪酸的β氧化。目前使用的许多药物都能诱导脂肪变性,主要是肝细胞内甘油三酯过度积累。最近的研究表明,细胞暴露于能够诱导肝脂肪变性的药物,编码脂质代谢关键蛋白的转录因子和基因的表达谱也发生了改变[19]。某些药物引起的空泡脂肪变性,长时间暴露于药物后可使短期可逆和良性状态发展为更严重的病变(脂肪性肝炎、纤维化和肝硬变)。这些严重的不良反应成为临床试验中断或药物撤市的原因,以及几种药物被限制临床使用的原因(如非阿尿苷、哌克昔林和丙戊酸)[20]。
目前,只有少数体外实验被开发用于评价新药潜在的致肝脂肪变性的风险,其中采用HCS技术检测脂肪变性的几个实验取得了较好的结果 。Fujimura等[21]使用荧光脂肪酸模拟剂BODIPY558/ 568 C12分析几种药物对大鼠肝细胞内脂肪含量的影响。结果 显示,HCS细胞成像检测比荧光计检测荧光颗粒更为敏感、选择性更高。Donato等[22]利用HCS技术评估药物引起的脂肪肝毒性,药物处理过的HepG2细胞用荧光探针Hoechst33342,PI,TMRM,BODIPY493/503和2′,7′-二氯荧光黄双乙酸盐(2′,7′-dihydrodichlorofluorescein diacetate,DCFH-DA)等染色,评估细胞核型、细胞存活、MMP、细胞内脂质积累和活性氧生成等指标,能够100%精确识别诱导脂肪变性的阳性和阴性化合物;与采用流式细胞术评估药物引起的脂肪变性相比,该方法的通量更高,检测时间更快。Pradip等[23]采用诱导多能干细胞(induced pluripotent stem cell,iPSC)分化的肝细胞来源的肝细胞检测脂肪变性。结果 表明,与HepG2细胞相比,iPSC来源的肝细胞产生的HCS数据在不同孔、不同板和不同批次之间的敏感性和准确率更高。这一系列的细胞成像实验表明,HCS是一种简单、快速、敏感的用于脂肪变性诱导药物筛选的工具。
3.4 磷脂沉积
药物诱导的磷脂沉积是肝细胞及其他组织细胞脂质过度积累的另一种病变形式,它以磷脂在细胞溶酶体内积累,导致溶酶体肿大和形成多层状囊泡结构为特点。许多副反应与可引起磷脂沉积的药物有关,特别是同时含有亲水性阳离子侧链和疏水区域结构的药物。药物诱导的磷脂沉积往往是可逆的,它是细胞的一种确切的毒性表现还是适应性反应目前仍存在争议,但监管机构仍将其视为一种不利因素,并建议在早期的药物研发中筛选或评估药物引起磷脂沉积的风险[24-25]。
HCS系统目前已被应用于磷脂沉积中高通量检测。常用的选择性探针包括LipidTOX染料或荧光标记的磷脂类似物,如NDB-PE或ss-BODIPY C(12)-HPC[25],它们可选择性地定位于累积磷脂的溶酶体而不会定位于胞质中的脂肪滴[26]。Tilmant等[27]采用基因组学和荧光检测HepG2细胞2种体外方法筛选11种化合物诱导的磷脂沉积。结果 表明,在灵敏度和特异性上荧光检测方法优于基因组学方法。文献报道,HCS结合NBD-PE荧光标记物检测中国仓鼠卵巢细胞K1(CHO-K1)和人肝癌细胞HepG2细胞磷脂沉积,对56种化合物潜在的诱导磷脂沉积作用进行验证。结果 表明,该方法于体内实验和体外硅片模型数据相比有较高的灵敏度(CHO-K1:92.0%,HepG2:88.0%)和特异性(CHO-K1:87.1%,HepG2:80.6%)[28]。最近,一种定量高通量筛选平台被开发用于评估和分析大量药物引起的磷脂沉积[29],1536孔板培养HepG2细胞,lipid TOX Red和Hoechst33342染色,宽场成像HCS系统获取细胞图像并结合相应软件进行定量分析。结果 显示,对1280种化合物的初筛实验中有187种有效值>30%,即可能具有磷脂沉积作用,选取其中的109种进行验证,与初筛结果 的一致性达到100%。这些实验结果 表明,HCS技术可用于筛选和评价潜在的诱导磷脂沉积的化合物。
3.5 活性代谢物生成
众所周知,有些药物在体内经生物转化后会转变为具有毒性的活性代谢物,或因患者遗传因素使药物代谢异常而最终导致肝损伤[30]。此前已有多种药物由于活性代谢物引起的肝毒性而被撤市,如非尔氨酯、溴芬酸和曲格列酮等。建立能够反映临床体内代谢物介导的肝毒性的体外筛选系统是早期肝毒性评价的关键步骤。
以往大多数检测都是基于使用人肝癌细胞HepG2细胞[26],然而HepG2细胞是由肝癌细胞衍生而来,其遗传表型与人原代肝细胞已有很大差异,部分参与药物代谢的CYP表达水平远远低于人原代肝细胞,难以检出代谢活化的药物,尤其是涉及毒性机制的研究中不足以准确预测DILI[5]。近年来,一些研究者提出基于HCS方法探讨药物毒性的肝细胞模型,来实现外源化合物在肝细胞代谢的可视化,既能提高对具有代谢活性的药物的检出率,同时可评价活性代谢物的毒作用机制。作为体外肝毒性评价的金标准,人原代肝细胞具有人类特有的代谢酶和辅因子,保留了人体关键的肝功能,已被广泛用于HCS检测[30]。此外,人iPSC(humaniPSC,hiPSC)分化的肝细胞能够表达代谢相关的关键P450酶,并且来源丰富,尤其是来自健康志愿者和DILI患者的hiPSC分化的肝细胞,可以更好地预测人体DILI,并了解遗传倾向所起的作用,目前也已被应用于HCS预测肝毒性领域[31]。采用含有药物代谢酶相关基因的重组腺病毒为载体转染HepG2细胞[32],使其表达主要的P450代谢酶CYP1A2,CYP2D6,CYP2C9,CYP2C19以及CYP3A4。采用这种模型用HCS技术筛选能产生活性代谢物的药物,相比于HepG2细胞,已知具有代谢活化效应的待测化合物IC50值更低,而在非代谢活性药物中2种细胞模型得到的IC50值及其他参数值结果 相似。相比于HepG2细胞,HepaRG细胞可正常表达CYP酶。研究表明,通过反应性代谢物消耗GSH的DILI化合物,在HepaRG细胞比在HepG2细胞,GSH降低或ROS升高更明显;对2种细胞有不同程度的CYP酶表达比较,有助于阐明代谢对肝细胞毒性的作用[33]。
4 展望
经过十多年的发展,HCS功能日益强大,已成为制药行业的重要组成部分,但该技术尚有大量的技术难题有待研究和解决。目前,HCS仪器大多不具有比例成像分析的功能,随着多参数检测复杂性的增加,更高分辨率的显微镜和新的成像方式需要进一步发展。最近一项关于HCS的调查显示,每年发布的HCS实验数量虽持续稳步增长,但信息内容滞后,并未充分发挥HCS技术多维数据分析的优势,其主要原因在于图像分析方法的限制[34]。对于特定的HCS检测通常组合不同的方法来实现最佳分析,但往往由于对实验人员生物信息学知识储备的要求较高而无法实现。未来的发展方向是构建强大的数据分析系统,提高分析软件的数据挖掘技术和高维数据分析方法,并可以根据个人需求轻松定制,实现将每个细胞的海量信息转化为生物学上可解释的结果 。此外,寻找具有更高特异性和兼容性的指示剂和试剂也是HCS技术发展的重点。
为解决体外DILI预测结果 的准确性,更加整体和复杂的细胞模型被越来越多地开发和使用,如hiPSC分化的肝细胞、三维培养的肝细胞、与非实质细胞共培养的肝细胞以及在流体系统中培养的肝细胞等,这些新的细胞模型结合HCS技术预测肝毒性已有报道,也需要在HCS中得到进一步的研究,以解决更加复杂的机制问题。此外,鉴于DILI机制的复杂性以及体外预测与临床结果 的差异,任何技术都无法对所有的机制实现全面预测。尤其是涉及非细胞毒性相关的肝损伤,如胆管消失综合征、血窦阻塞综合征和免疫介导的DILI事件,目前还无法轻易借助于细胞基础的HCS技术预测。
随着检测技术、实验设计和分析方法的发展,可以预测可视化、多参数筛选方法将继续推进对细胞生命过程的系统化了解。期待未来HCS得到产业化的应用,从而成为药物开发的强大工具和平台。
[1]Laverty H,Benson C,Cartwright E,Cross M,Garland C,Hammond T,et al.How can we improve our understanding of cardiovascular safety liabilities to develop safer medicines?[J].Br J Pharmacol,2011,163(4):675-693.
[2]Chen M,Borlak J,Tong W.Predicting idiosyncratic drug-induced liver injury:some recent advances[J].Expert Rev Gastroenterol Hepatol,2014,8(7):721-723.
[3]Godoy P,Hewitt NJ,Albrecht U,Andersen ME,Ansari N,Bhattacharya S,et al.Recent advances in 2D and 3D in vitro systems using primary hepatocytes,alternative hepatocyte sources and nonparenchymal liver cells and their use in investigating mechanisms of hepatotoxicity,cell signaling and ADME[J].Arch Toxicol,2013,87(8):1315-1530.
[4]O′Brien PJ,Irwin W,Diaz D,Howard-Cofield E,Krejsa CM,Slaughter MR,et al.High concordance of drug-induced human hepatotoxicity with in vitro cytotoxicity measured in a novel cell-based model using high content screening[J].Arch Toxicol,2006,80(9):580-604.
[5]Tolosa L,Pinto S,Donato MT,Lahoz A,Castell JV,O′Connor JE,et al.Development of a multiparametric cell-based protocol to screen and classify the hepatotoxicity potential of drugs[J].Toxicol Sci,2012,127(1):187-198.
[6]Taylor DL.A personal perspective on high-content screening(HCS):from the beginning[J].J Biomol Screen,2010,15(7):720-725.
[7]Zanella F,Lorens JB,Link W.High content screening:seeing is believing[J].Trends Biotechnol,2010,28(5):237-245.
[8]Stuurman N,Swedlow JR.Software tools,datastructures,and interfaces for microscope imaging[J].Cold Spring Harb Protoc,2012,2012(1):50-61.
[9]Persson M,Løye AF,Mow T,Hornberg JJ.A high content screening assay to predict human druginduced liver injury during drug discovery[J].J Pharmacol Toxicol Methods,2013,68(3):302-313.
[10]Tolosa L,Carmona A,Castell JV,Gómez-Lechón MJ,Donato MT.High-content screening of druginduced mitochondrial impairment in hepatic cells:effects of statins[J].Arch Toxicol,2015,89(10):1847-2860.
[11]Iannetti EF,Willems PH,Pellegrini M,Beyrath J,Smeitink JA,Blanchet L,et al.Toward high-content screening of mitochondrial morphology and membrane potential in living cells[J].Int J Biochem Cell Biol,2015,63:66-70.
[12]Kim JA,Han E,Eun CJ,Tak YK,Song JM.Realtime concurrent monitoring of apoptosis,cytosolic calcium,and mitochondria permeability transition for hypermulticolor high-content screening of druginduced mitochondrial dysfunction-mediated hepatotoxicity[J].Toxicol Lett,2012,214(2):175-181.
[13]Bjornsson ES,Jonasson JG.Drug-induced cholestasis[J].Clin Liver Dis,2013,17(2):191-209.
[14]Persson M,Løye AF,Jacquet M,Mow NS,Thougaard AV,Mow T,et al.High-content analysis/ screening for predictive toxicology:application to hepatotoxicity and genotoxicity[J].Basic Clin Pharmacol Toxicol,2014,115(1):18-23.
[15]Noor F.A shift in paradigm towards human biologybased systems for cholestatic-liver diseases[J].J Physiol,2015,593(23):5043-5055.
[16]Xu JJ,Dunn MC,Smith AR,Tien ES.Assessment of hepatotoxicity potential of drug candidate molecules including kinase inhibitors by hepatocyte imaging assay technology and bile flux imaging assay technology[J].Methods Mol Biol,2012,795:83-107.
[17]Germano D,Uteng M,Pognan F,Chibout SD,Wolf A.Determination of liver specific toxicities in rat hepatocytes by high content imaging during 2-week multiple treatment[J].Toxicol In Vitro,2015,30(1 Pt A):79-94.
[18]Qiu L,Finley J,Taimi M,Aleo MD,Strock C,Gilbert J,et al.High-content imaging in human and rat hepatocytes using the fluorescent dyes CLF and CMFDA is not specific enough to assess BSEP/Bsep and/or MRP2/Mrp2 inhibition by cholestatic drugs[J].Appl In Vitro Toxicol,2015,1(3):198-212.
[19]Tolosa L,Gómez-Lechón MJ,Jiménez N,Hervás D,Jover R,Donato MT.Advantageous use of HepaRG cells for the screening and mechanistic study of drug-induced steatosis[J].Toxicol Appl Pharmacol,2016,302:1-9.
[20]Fromenty B,Pessayre D.Impaired mitochondrial function in microvesicular steatosis.Effects of drugs,ethanol,hormones and cytokines[J].J Hepatol,1997,26(Suppl 2):43-53.
[21]Fujimura H,Murakami N,Kurabe M,Toriumi W. In vitro assay for drug-induced hepatosteatosis using rat primary hepatocytes,a fluorescent lipid analog and gene expression analysis[J].J Appl Toxicol,2009,29(4):356-363.
[22]Donato MT,Tolosa L,Jiménez N,Castell JV,Gómez-Lechón MJ.High-content imaging technology for the evaluation of drug-induced steatosis using a multiparametric cell-based assay[J].J Biomol Screen,2012,17(3):394-400.
[23]Pradip A,Steel D,Jacobsson S,Holmgren G,Ingelman-Sundberg M5,Sartipy P,et al.High content analysis of human pluripotent stem cell derived hepatocytes reveals drug induced steatosis and phospholipidosis[J].Stem Cells Int,2016,2016:2475631.
[24]Ferslew BC,Brouwer KL.Identification of hepatic phospholipidosis inducers in sandwich-cultured rat hepatocytes,a physiologically relevant model,reveals altered basolateral uptake and biliary excretion of anionic probe substrates[J].Toxicol Sci,2014,139(1):99-107.
[25]Donato MT,Gómez-Lechón MJ.Drug-induced liver steatosis and phospholipidosis:cell-based assays for early screening of drug candidates[J].Curr Drug Metab,2012,13(8):1160-1173.
[26]Tolosa L,Gómez-Lechón MJ,Donato MT.Highcontent screening technology for studying druginduced hepatotoxicity in cell models[J].Arch Toxicol,2015,89(7):1007-1022.
[27]Tilmant K,Gerets HH,Dhalluin S,Hanon E,Depelchin O,Cossu-Leguille C,et al.Comparison of a genomic and a multiplex cell imaging approach for the detection of phospholipidosis[J].Toxicol In Vitro,2011,25(7):1414-1424.
[28]van de Water FM,Havinga J,Ravesloot WT,Horbach GJ,Schoonen WG.High content screening analysis of phospholipidosis:validation of a 96-well assay with CHO-K1 and HepG2 cells for the predictionof in vivo based phospholipidosis[J].Toxicol In Vitro,2011,25(8):1870-1882.
[29]Shahane SA,Huang R,Gerhold D,Baxa U,Austin CP,Xia M.Detection of phospholipidosis induction:a cell-based assay in high-throughput and high-content format[J].J Biomol Screen,2014,19(1):66-76.
[30]Atienzar FA,Blomme EA,Chen M,Hewitt P,Kenna JG,Labbe G,et al.Key challenges and opportunities associated with the use of in vtro models to detect human DILI:integrated risk assessment and mitigation plans[J].Biomed Res Int,2016,2016:9737920.
[31]Sirenko O,Hesley J,Rusyn I,Cromwell EF.Highcontent assays for hepatotoxicity using induced pluripotent stem cell-derived cells[J].Assay Drug Dev Technol,2014,12(1):43-54.
[32]Tolosa L,Gómez-Lechón MJ,Pérez-Cataldo G,Castell JV,Donato MT.HepG2 Cells simultaneously expressing five P450 enzymes for the screening of hepatotoxicity:identification of bioactivable drugs and the potential mechanism of toxicity involved[J].Arch Toxicol,2013,87(6):1115-1127.
[33]Saito J,Okamura A,Takeuchi K,Hanioka K,Okada A,Ohata T.High content analysis assay for prediction of human hepatotoxicity in HepaRG and HepG2 cells[J].Toxicol In Vitro,2016,33:63-70.
[34]Singh S,Carpenter AE,Genovesio A.Increasing the content of hgh-content screening:an overview[J].J Biomol Screen,2014,19(5):640-650.
High-content screening in studies of toxicology and its application in drug-induced hepatotoxicity
GE Shuai,TANG Na-ping,FU Li-jie,MA Jing
(National Shanghai Center for New Drug Safety Evaluation and Research,China State Institute of Pharmaceutical Industry,Shanghai 201203,China)
Drug-induced liver injury(DILI)is one of the major causes of termination of drug development.The establishment of a high-throughput test system to predict potential clinical hepatotoxicity is a valuable approach in the pharmaceutical industry.The high-content imaging-based in vitro assays allow simultaneous detection of cellular multiple parameters in the system.The real-time monitoring of multiple signaling pathways can shed light on many mechanisms of cell injury,with high sensitivity and specificity. Many types of liver cell models have been applied to high-content screening(HCS)so far.This paper introduceds the HCS technology and reviews the data of hepatotoxicity obtained from HCS technology in recent years.At the same time,we discuss the application of this technology in exploring the mechanism of hepatotoxicity and the potential of HCS technology in studying DILI and mechanisms.
high-content screening;hepatotoxicity;toxicology
The project supported by Special Grant from Advanced Programs of National Science and Technology Major Project of China(2015ZX09501004-002-006);and Advanced Programs of National Science and Technology Major Project of China(2015ZX09501-007-003)
MA Jing,Tel:(021)50801763,E-mail:jma@ncdser.com
R99
A
1000-3002-(2017)06-0689-07
10.3867/j.issn.1000-3002.2017.06.028
2017-01-13接受日期:2017-03-27)
(本文编辑:贺云霞)
国家科技部重大专项定向择优项目(2015ZX-09501004-002-006);国家科技部重大专项定向择优项目(2015ZX09501-007-003)
葛帅,女,硕士研究生,主要从事肝脏毒理学研究,Tel:13122365965,E-mail:geshuai2013@163.com;马璟,女,博士,研究员,博士生导师,主要从事毒理学研究。
马璟,Tel:(021)50801763,E-mail:jma@ncdser.com

