雄激素对雌激素引发去势雄性SD大鼠前列腺炎症及炎症因子的抑制作用
贾玉玲,崇立明,李雷,马爱翠,陈颖,周莉,孙祖越
(1.上海市计划生育科学研究所药理毒理学研究室,中国生育调节药物毒理学检测中心,上海200032;2.国家人口和计划生育委员会计划生育药具重点实验室,上海200032)
雄激素对雌激素引发去势雄性SD大鼠前列腺炎症及炎症因子的抑制作用
贾玉玲1,2,崇立明1,2,李雷1,2,马爱翠1,2,陈颖1,2,周莉1,2,孙祖越1,2
(1.上海市计划生育科学研究所药理毒理学研究室,中国生育调节药物毒理学检测中心,上海200032;2.国家人口和计划生育委员会计划生育药具重点实验室,上海200032)
目的 给予不同比例苯甲酸雌二醇(E2)和丙酸睾酮(T)诱导SD大鼠前列腺炎,探讨炎症因子肿瘤坏死因子α(TNF-α)、环氧合酶2(COX-2)和巨噬细胞炎症蛋白1α(MIP-1α)表达的变化。方法SD大鼠无菌条件下去势后,颈背部分别sc给予E20.25 mg·kg-1+T 0.25,0.5和1.0 mg·kg-1,连续给药30 d。取血离心取血清,采用ELISA检测E2,T和双氢睾酮(DHT)激素水平。HE染色观察前列腺组织病理变化,免疫组化检测前列腺中TNF-α,COX-2和MIP-1α的表达。结果 ELISA检测结果 显示,与假手术组比较,E20.25 mg·kg-1组血清E2水平明显升高〔(80±7)ng·L-1,P<0.01〕;E20.25 mg·kg-1组和E2+T 0.25 mg·kg-1组血清T水平显著下降〔111±6和(111±5)nmol·L-1,P<0.05〕。与去势对照组相比,E20.25 mg·kg-1组血清E2明显升高〔(80±7)ng·L-1,P<0.01〕,其他各指标未见统计学差异。光学显微镜观察发现,假手术组和去势对照组前列腺组织结构完整、腺腔和间充质无炎症细胞浸润;E20.25 mg·kg-1组前列腺腺腔内有少量炎症细胞浸润,间充质未见炎症细胞浸润;E2+T 3个剂量组间充质内有少量炎症细胞浸润。假手术组前列腺上皮细胞及前列腺基质细胞胞浆内TNF-α,COX-2和MIP-1α均为阴性表达或极少量表达,去势对照组和E20.25 mg·kg-1组TNF-α,COX-2和MIP-1α均为强阳性表达,E2+T 3个剂量组TNF-α,COX-2和MIP-1α呈弱阳性表达。结论雄激素具有抑制雌激素引起的去势SD大鼠前列腺炎及炎症因子TNF-α,COX-2和MIP-1α表达的作用。
前列腺炎;雌激素;雄激素
DOl:10.3867/j.issn.1000-3002.2017.06.011
前列腺炎是临床泌尿系统常见疾病,慢性前列腺炎/慢性骨盆疼痛综合征(chronic prostatitis/ chronic pelvic pain syndrome,CP/CPPS)出现的症状可能与机体多种功能变化的相互作用相关,包括心理因素改变、免疫功能降低和神经内分泌功能失调,其确切的发病机制尚不明确。研究制备良好的动物模型是阐明前列腺炎发病机制和开发新药的有效方法。目前,所用的动物模型主要有免疫诱导[1]、激素诱导[2]、化学制剂诱导[3]、生物制剂诱导、尿液逆流诱导和自发性炎症模型等。而激素诱导主要以雌激素或植物激素诱导为主。关于雌激素与前列腺炎关系的研究报道较多,但雄激素究竟如何在CP/CPPS发病中发挥作用仍不是很清楚。在大鼠模型建立过程中发现,去势或雄激素水平下降能够引起前列腺炎[4];给予略高于生理剂量的睾酮(testosterone,T)能降低雌二醇(estradiol,E2)诱导的炎症发生率并且能减轻炎症程度[5-6]。有报道,环境污染和工业化学物质可能会通过改变性腺中性激素水平影响前列腺的生长发育[7-9]。同时与年龄相关的雄激素与雌激素比值的下降被认为是CP发展的重要因素。随着年龄增长,当雄激素水平下降、雌激素水平维持不变或升高时,激素平衡被打破,从而诱导前列腺炎症[10-12]。本研究基于上述理论,采用雌激素诱发去势雄性SD大鼠前列腺炎,探索雄激素对前列腺炎症及炎症因子表达的影响。
1 材料与方法
1.1 动物
48只清洁级雄性Sprague-Dawley(SD)大鼠,体质量310~380 g,由上海西普尔-必凯实验动物有限公司提供(SCXK[沪]2008-0016)。SD大鼠在上海市计划生育科学研究所(中国生育调节药物毒理学检测中心)清洁级动物房内饲养(SYXK[沪]2008-0027)。室温20~26℃,相对湿度40%~70%,光照12 h,黑暗12 h;塑料笼大小为400 mm× 350 mm×200 mm,每笼4只,自由饮水和摄食。
1.2 主要试剂
苯甲酸E2(苏州诺德派森医药科技有限公司);丙酸T注射液(上海通用药业股份有公司);一抗:兔抗大鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、兔抗大鼠环氧合酶2(cyclooxygenase-2,COX-2)和兔抗大鼠巨噬细胞炎症蛋白1α(macrophage inflammatory protein-1α,MIP-1α)(武汉博士德生物工程有限公司);兔超敏二步法检测试剂盒(北京中杉金桥生物技术有限公司);雌二醇、睾酮和双氢睾酮(dihydrotestosterone,DHT)检测试剂盒(上海沪峰化工有限公司)。
48只SD大鼠适应性饲养1周,按体质量随机分为6组,每组8只。分为假手术组、去势对照组和4个不同雌雄激素比例组,即E20.25 mg·kg-1分别与T 0,0.25,0.5和1.0 mg·kg-1剂量配伍;除假手术组未去势外,其他各组均去势。3%戊巴比妥钠麻醉,无菌条件下取腹正中切口,直达腹腔,轻轻拉动睾丸脂肪,暴露睾丸和附睾,自输精管处结扎,完整地切除双侧睾丸和附睾,依次缝合肌肉和皮肤,放回鼠笼,自由饮食;恢复观察5 d,在颈背部进行皮下注射。去势对照组注射橄榄油,每天sc给予1次,给药30 d。每周测定大鼠体质量,根据体质量变化调整给药剂量。
3%戊巴比妥钠麻醉后采集自凝血制备血清,对前列腺进行观察、取材并称重,10%甲醛固定,组织经脱水处理后,石蜡包埋,4~6 μm连续切片,HE染色,中性树胶封片。
1.4 ELlSA法检测血清E2,T和DHT的含量
设置空白孔、标准孔、待测样品孔。标准品准确加样50 μL,待测样品孔中先加样品稀释液40 μL,然后再加待测血清10 μL。置37℃温育30 min。弃液体,洗板机洗涤5次。每孔加入酶标试剂50 μL,空白孔除外。置37℃温育30 min。弃液体,洗板机洗涤5次。每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻振荡混匀,37℃避光显色10 min。每孔加终止液50 μL,终止反应。用酶标仪进行测定,450 nm波长下,依序测量各孔的吸光度(A450nm值)。绘制标准曲线,根据各样本A450nm在标准曲线上查得相应的浓度。
1.5 免疫组化法检测前列腺组织中TNF-α,COX-2和MlP-1α的表达
石蜡切片常规脱蜡至水。滴加3%H2O2,室温下5~10 min灭活内源性酶。蒸馏水洗3次。将切片浸入枸橼酸盐缓冲液0.01 mol·L-1(pH 6.0)进行热修复。冷却到室温后PBS(pH 7.2~7.6)洗涤2次。滴加5%BSA封闭液,室温20 min,甩去多余液体。分别滴加一抗兔抗大鼠TNF-α,COX-2和MIP-1α(1∶150),4℃过夜。滴加辣根过氧化物酶标记的羊抗兔IgG多抗,室温下30 min。PBS(pH 7.2~7.6)洗2 min,3次。滴加试剂SABC,室温20 min。PBS(pH 7.2~7.6)洗5 min,4次。室温滴加DAB显色,当出现浅棕色时用蒸馏水冲洗终止显色。苏木素复染,分化,脱水、透明后用中性树胶封片。
采用Image-Pro Plus 6.0软件的图像分析系统检测分析各组切片,所有切片均在40×10视野下随机选取5个视野,分别测量积分吸光度(integrated absorbance,IA),计算平均IA,表示TNF-α,COX-2和MIP-1α蛋白相对表达水平。根据免疫组织化学的显色不同将TNF-α,COX-2和MIP-1α的染色表达分为阴性、弱阳性和强阳性。
课程的考核方式突出能力本位。侧重于学习态度、作业完成情况、综合应用所学课程知识的能力,注重学生综合职业素质的培养。表1“汽车装饰与美容”课程教学评价体系展示的是学生整体考核的权重分布情况。
1.6 统计学分析
2 结果
2.1 雄激素对雌激素引发去势雄性前列腺炎大鼠体质量及一般状况的影响
适应性饲养期间,SD大鼠一般状况良好,外观体征、行为活动均未见明显异常。摄食、饮水和大小便均正常;手术后,各组大鼠一般状况良好,外观体征、行为活动均未见明显异常;手术局部未见明显红肿和溃破;摄食、饮水和大小便均正常。
假手术组和去势对照组大鼠体质量随时间延长逐渐升高,而给予激素各组大鼠的体质量随时间延长逐渐降低,在第22~第29天体质量变化不大,趋于稳定(图1)。
2.2 雄激素对雌激素引发去势雄性前列腺炎大鼠血清中E2,T和DHT含量的影响
表1结果 显示,与假手术组比较,去势对照组血清E2,T和DHT水平均无显著差异;E20.25 mg·kg-1组E2水平明显升高(P<0.01),E20.25 mg·kg-1和E2+T 0.25 mg·kg-1组T水平显著下降(P<0.05)。与去势对照组相比,E20.25 mg·kg-1组E2水平明显升高(P<0.01),其余指标各组间无显著变化。
2.3 雄激素对雌激素引发去势雄性大鼠前列腺炎症变化的影响
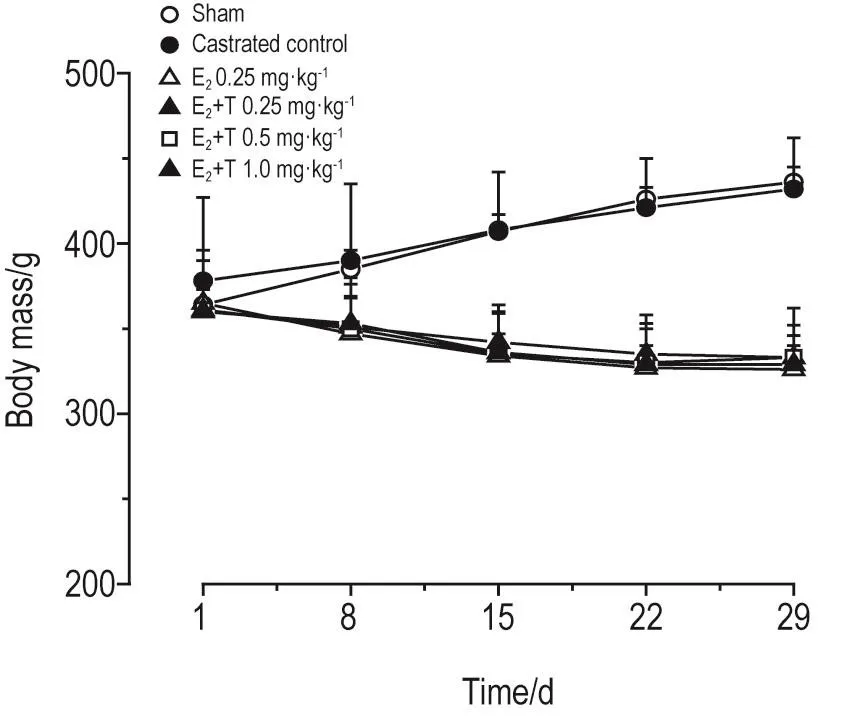
Fig.1 Effect of testosterone(T)on body mass of castrated male rats with prostatitis initiated by estrogen(E2).Rats were injected subcutaneously with E20.25 mg·kg-1or E20.25 mg·kg-1+T 0.25,0.50 and 1.0 mg·kg-1,respectively for 30 d.x±s,n=8.
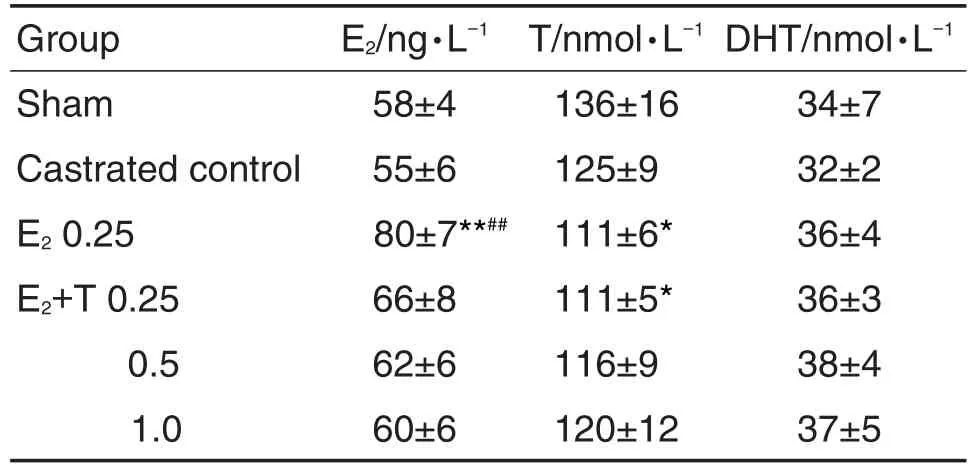
Tab.1 Effect of T on serum E2,T and dihydrotestosterone(DHT)concentration of castrated male rats with prostatitis initiated by E2
光学显微镜下观察发现(图2),各剂量组前列腺组织未见明显差异。假手术组和去势对照组前列腺组织结构完整、腺腔和间充质无炎症细胞浸润,无充血和水肿;E2组(5/8只)前列腺分别有不同程度的萎缩,腺腔内有少量炎症细胞浸润,间充质未见炎症细胞浸润;E2+T 0.25 mg·kg-1(4/8只)、E2+T 0.5 mg·kg-1(2/8只)和E2+T 1.0 mg·kg-1(2/8只)组间充质内有少量炎症细胞浸润,腺腔未见炎症细胞浸润,且出现少数上皮轻度扁平化,腺腔大小随着雄激素的增加而增大。
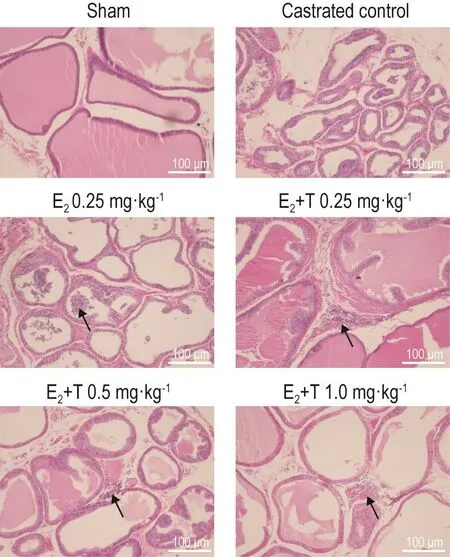
Fig.2 Effect of T on prostate tissue of castrated male rats with prostatitis initiated by E2(HE staining).See Fig.1 for the treatment.Arrows show severe atrophy and inflammatory cells.
2.4 雄激素对雌激素引发去势雄性前列腺炎大鼠前列腺组织中TNF-α ,COX-2和MlP-1α 表达的影响
表2结果 显示,与假手术组相比,去势对照组和E20.25 mg·kg-1组TNF-α,COX-2和MIP-1α表达量明显增高(P<0.01和P<0.05),E2+T 1.0 mg·kg-1组TNF-α和COX-2表达量有所下降(P<0.05),其他各剂量组TNF-α,COX-2和MIP-1α表达没有显著性差异。与去势对照组相比,E20.25 mg·kg-1组TNF-α表达量明显增高(P<0.01),E2+T各剂量组TNF-α,COX-2和MIP-1α表达明显降低(P<0.01)。
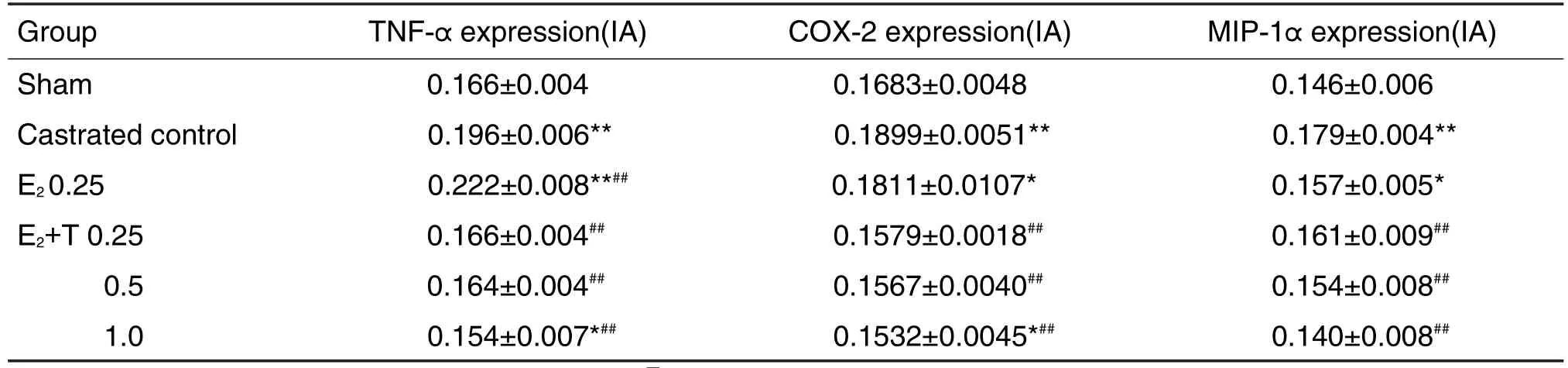
Tab.2 Effect of T combination E2on expression of tumor necrosis factor-α (TNF-α ),cyclooxygenase-2(COX-2)and macrophage inflammatory protein-1α (MlP-1α )in prostate tissue of castrated male rats with prostatitis initiated by E2
图3显示,假手术组TNF-α,COX-2和MIP-1α均为阴性或极少量表达,去势对照组和E20.25组TNF-α、COX-2和MIP-1α均为强阳性表达,所有E2+T组前列腺上皮细胞及前列腺基质细胞胞浆内TNF-α,COX-2和MIP-1α呈弱阳性表达。
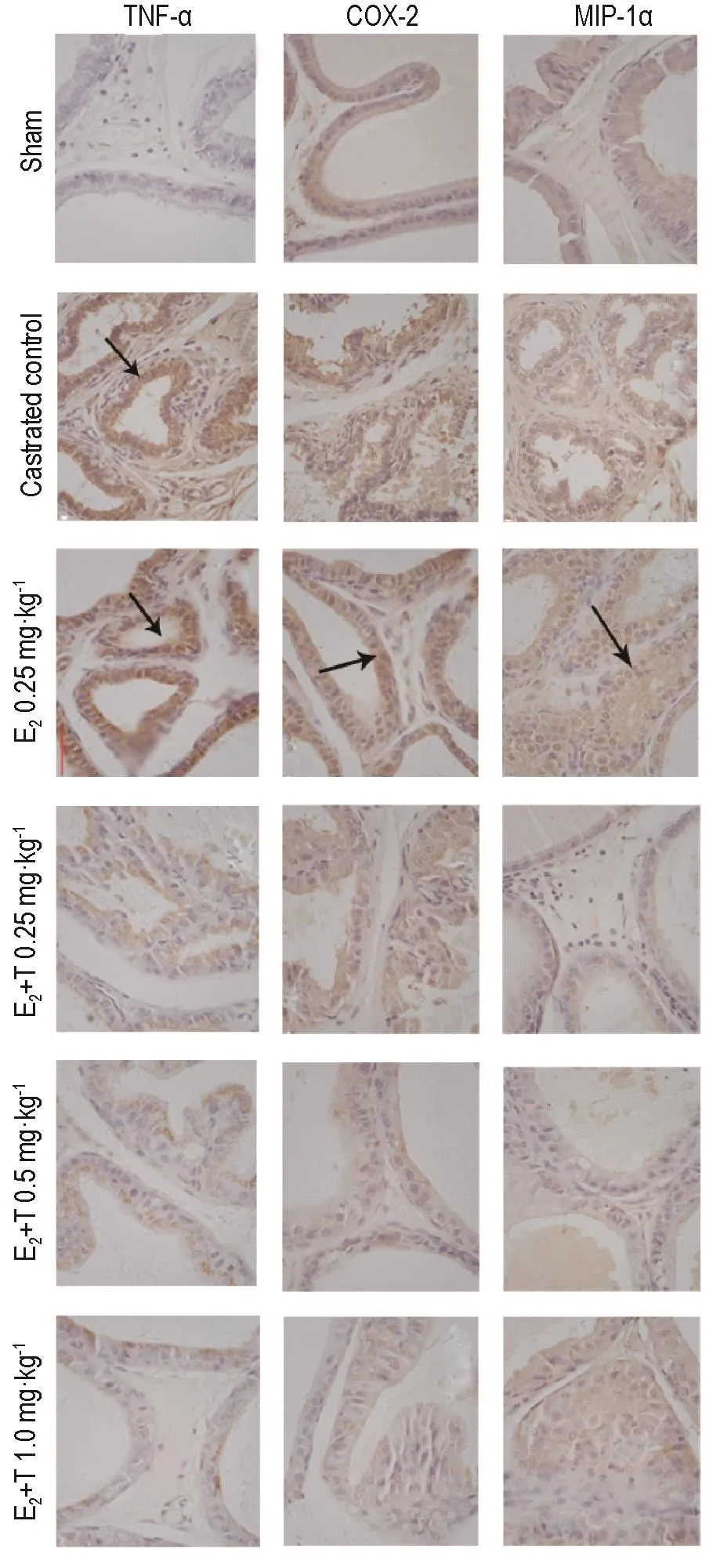
Fig.3 Effect of T on expression of TNF-α,COX-2 and MlP-1αin prostate tissue of castrated male rats with prostatitis initiated by E2(immunostaining×400).See Fig.1 for the treatment.Arrows show positive expression.
3 讨论
本研究发现,单独E2可以诱导SD大鼠前列腺腺腔炎细胞浸润,与T配伍组均可见间充质或血管周炎症,未见腺腔内有炎细胞。高剂量的T会促进前列腺的生长并抑制前列腺炎症。Yatkin等[13]在探索雌雄激素比例对大鼠前列腺炎症和上皮细胞的影响时也发现,在正常或高于正常水平的T和DHT会刺激精囊腺生长,并且雄激素具有抑制前列腺炎症的作用。在E2升高的情况下,上皮细胞对E2的反应可能取决于雄激素对附属性腺刺激的强度。
给予激素后,各组大鼠的体质量出现明显的下降趋势,去势后给予雌雄激素比例过高,可能抑制了雄激素促生长作用,进而导致动物体质量降低。而与前列腺炎的关系尚待进一步研究。
本研究发现,E20.25 mg·kg-1组E2水平明显升高,说明雌激素的作用引起大鼠体内激素失衡。E20.25 mg·kg-1组和E2+T 0.25 mg·kg-1组T水平显著下降。由于给予去势手术后,T来源被阻断,而外源给予的T尚未达到体内正常水平。E20.25 mg·kg-1组E2明显高于去势对照组,是外源雌激素作用的结果 。
本研究发现,去势对照组和E20.25 mg·kg-1组中检测到前列腺上皮、间充质细胞胞浆内有大量棕褐色TNF-α,COX-2和MIP-1α表达的颗粒,呈强阳性表达。Sugimoto等[14]也发现,sc给予17β-E2的雄性Wistar大鼠前列腺TNF-α升高,前列腺和尿液中的炎症趋化因子MIP-1α升高。在E2+T组中,随着T剂量的增加,TNF-α,COX-2和MIP-1α表达量大大减少,仅可见少量弱棕黄色细颗粒,呈弱阳性表达。在给予雄激素后,大鼠血液中的雄激素水平有恢复但仍未达到去势组的水平,而前列腺组织中的炎症因子水平较去势对照组却显著下降。这一现象可解释为在给予雄激素后,在E2+T 0.5和1.0 mg·kg-1两组中大鼠血液中的雄激素水平与假手术组和去势对照组相比没有统计学差异,可认为属于正常水平波动。前列腺组织中的炎症因子水平较去势对照组却显著下降,是因为给予雄激素后炎症得到缓解。性激素与前列腺炎的关系可解释为T抗炎作用的弱化,E2促炎影响加强[15]。体内雌激素水平增高、雄激素水平降低的改变可能与大鼠CP/CPPS的发病过程相关联。这种因性激素水平发生变化诱发的CP/CPPS在通过额外给予雄激素后发现了炎症明显的好转,其作用机制在本研究中虽无法进行确切阐述,但可见其可能具有抑制TNF-α,COX-2和MIP-1α表达的作用,这为临床治疗CP/ CPPS提供了一种新的策略。
[1]Zhou L,Wang Y,Luo YW,Wang R,Meng X,Jia YL,et al.Correlation effect change of internal environmental in prostate antigen protein induced SD rat protatitis[J].Chin J Pharmacol Ther(中国临床药理学与治疗学),2014,19(9):995-1000.
[2]Zhou L,Luo YW,Wang Y,Wang R,Liu XY,Gui B,et al.Correlation of estrogen-induced SD rat models of prostatitis with changes of internal environment[J].Chin J Comp Med(中国比较医学杂志),2014,24(2):33-37.
[3]Zhou L,Luo YW,Wang Y,Wang R,Jia YL,Chen Y,et al.The research on inflammation marker of prostatitis induced by carrageenan in rats[J]. Lab Anim Comp Med(实验动物与比较医学杂志),2014,34(4):266-271.
[4]Kim DS,Lee EJ,Cho KS,Yoon SJ,Lee YH,Hong SJ.Preventive effects of oligomerized polyphenol on estradiol-induced prostatitis in rats[J]. Yonsei Med J,2009,50(3):391-398.
[5]Vykhovanets EV,Resnick MI,MacLennan GT,Gupta S.Experimental rodent models of prostatitis:limitations and potential[J].Prostate Cancer Prostatic Dis,2007,10(1):15-29.
[6]Jia YL,Liu X,Yan JY,Chong LM,Li L,Ma AC,et al.The alteration of inflammatory markers and apoptosis on chronic prostatitis induced by estrogen and androgen[J].Int Urol Nephrol,2015,47(1):39-46.
[7]Kelce WR,Wilson EM.Environmental antiandrogens:developmental effects,molecular mechanisms,and clinical implications[J].J Mol Med(Berl),1997,75(3):198-207.
[8]Foster PM,McIntyre BS.Endocrine active agents:implications of adverse and non-adverse changes[J].Toxicol Pathol,2002,30(1):59-65.
[9]Foster PM.Disruption of reproductive development in male rat offspring following in utero exposure to phthalate esters[J].Int J Androl,2006,29(1):140-147.
[10]Yatkin E,Bernoulli J,Lammintausta R,Santti R. Fispemifene[Z-2-{2-[4-(4-chloro-1,2-diphenylbut-1-enyl)-phenoxy]ethoxy}-ethanol],a novel selective estrogen receptor modulator,attenuates glandular inflammation in an animal model of chronic nonbacterial prostatitis[J].J Pharmacol Exp Ther,2008,327(1):58-67.
[11]Bernoulli J,Yatkin E,Konkol Y,Talvitie EM,Santti R,Streng T.Prostatic inflammation and obstructive voiding in the adult Noble rat:impact of the testosterone to estradiol ratio in serum[J]. Prostate,2008,68(12):1296-1306.
[12]Mosli HA,Al-Abd AM,El-Shaer MA,Khedr A,Gazzaz FS,Abdel-Naim AB.Local inflammation influences estrogen metabolism in prostatic tissue[J].BJU Int,2012,110(2):274-282.
[13]Yatkin E,Bernoulli J,Talvitie EM,Santti R. Inflammation and epithelial alterations in rat prostate:impact of the androgen to estrogen ratio[J].Int J Androl,2009,32(4):399-410.
[14]Sugimoto M,Oka M,Tsunemori H,Yamashita M,Kakehi Y.Effect of a phytotherapeutic agent,Eviprostat®,on prostatic and urinary cytokines/ chemokines in a rat model of nonbacterial prostatitis[J].Prostate,2011,71(4):438-444.
[15]Straub RH.The complex role of estrogens in inflammation[J].Endocr Rev,2007,28(5):521-574.
lnhibitory effect of testosterone on prostatitis and inflammatory factors of castrated male SD rats initiated by estrogen
JIA Yu-ling1,2,CHONG Li-ming1,2,LI Lei1,2,MA Ai-cui1,2,CHEN Ying1,2,ZHOU Li1,2,SUN Zu-yue1,2
(1.Shanghai Institute of Planned Parenthood Research&National Evaluation Centre for Toxicology of Fertility Regulating Drugs,Shanghai 200032,China;2.National Population and Family Planning Key Laboratory of Contraceptives,Shanghai 200032,China)
OBJECTlVETo study the changes in inflammatory factors caused by prostatitis.METHODSSD rats were castrated under sterile conditions.E20.25 mg·kg-1+T 0.25,0.5 and 1.0 mg·kg-1were givensc for 30 d,respectively.Serum samples were taken and levels of E2,T and dihydrotestosterone(DHT) were detected by ELISA.Pathological changes of prostate tissue were observed by HE staining.The expressions of tumor necrosis factor-alpha(TNF-α),cyclooxygenase-2(COX-2)and macrophage inflammatory protein 1alpha(MIP-1α)in prostate were detected by immunohistochemistry.RESULTSELISA detection showed that E2levels were significantly increased〔(80±7)ng·L-1,P<0.01〕in E20.25 mg·kg-1group and that T levels were significantly decreased〔111±6 vs(111±5)nmol·L-1,P<0.05〕in E20.25 mg·kg-1and E2+T 0.25 mg·kg-1groups compared with the sham-operated group.E2was significantly increased〔(80±7)ng·L-1,P<0.01〕in E20.25 mg·kg-1groups compared with the castrated control.The sham and castrated control showed normal glandular epithelium without leukocyte infiltration. In E20.25 mg·kg-1group,extensive infiltration of inflammatory cells was found in the glandular lumens, suggesting the occurrence of chronic prostatitis.In each E2+T groups,fewer inflammatory cells were noted in the stroma around glands.The expressions of TNF-α,COX-2 and MIP-1α in sham group were negative or low,while those of castrated control and E20.25 mg·kg-1groups were high,especially in E20.25 mg·kg-1group.The expressions of TNF-α,COX-2 and MIP-1α in each E2+T group were significantly decreased.CONCLUSlONTestosterone can inhibit prostatitis and the expression of inflammatory factors,such as TNF-α,COX-2 and MIP-1α,in castrated SD rats initiated by estrogen.
prostatitis;estrogen;testosterone
The project supported by Shanghai Research and Development Platform(15DZ2290400);and Shanghai"Innovative Action Plan"Experimental Animal Study(14140901302)
ZHOU Li,E-mail:zhoulijss@163.com;SUN Zu-yue,E-mail:sunzy64@163.com
R977.1+2
A
1000-3002-(2017)06-0568-06
2016-11-22接受日期:2017-03-29)
(本文编辑:乔虹)
上海市研发平台专项(15DZ2290400);上海市“科技创新行动计划”实验动物研究项目(14140901302)
贾玉玲,女,硕士,研究实习员,主要从事前列腺炎药理毒理学研究和新药临床前安全性评价。
周莉,E-mail:zhoulijss@163.com;孙祖越,E-mail:sunzy64@163.com

