PTP1B和Sam68在结直肠癌中的表达及其意义
余红璐,任亚君,熊枝繁
(华中科技大学同济医学院附属梨园医院消化内科,武汉 430077;*通讯作者,E-mail:xiongzhifan@126.com)
PTP1B和Sam68在结直肠癌中的表达及其意义
余红璐,任亚君,熊枝繁*
(华中科技大学同济医学院附属梨园医院消化内科,武汉 430077;*通讯作者,E-mail:xiongzhifan@126.com)
目的 观察蛋白酪氨酸磷酸酶1B(PTP1B)及Sam68(Src-associated substrated during mitosis of 68KD)在结直肠癌的发生发展中的表达及其相关性,探究其与结直肠癌临床病理特征的关系。 方法 采用免疫组织化学(SABC)法检测53例结直癌组织及20例癌旁正常组织中PTP1B、Sam68的表达情况,并结合临床病理学资料进行统计分析;采用Western blotting方法检测12例结直肠癌组织及对应癌旁正常组织中的PTP1B及Sam68蛋白表达情况。 结果 免疫组化结果显示PTP1B、Sam68在结直肠癌组织的阳性表达率明显高于正常大肠组织,差异均有统计学意义(均P<0.001)。PTP1B、Sam68的表达均与分化程度、TNM分期及淋巴结转移相关(P<0.05);相关性分析显示,PTP1B与Sam68表达呈正相关(r=0.463,P<0.001)。Western blotting检测结果显示结直肠癌组织中PTP1B和Sam68的蛋白表达量明显高于癌旁正常组织(P<0.05)。 结论 PTP1B、Sam68可能与大肠癌的发生、浸润及转移有关,两者共同促进大肠癌的发生、发展、侵袭及转移。
结直肠癌; 蛋白酪氨酸磷酸酶1B; Sam68; 免疫组织化学; Western blotting
结直肠癌(colorectal cancer,CRC)是世界范围内最常见的恶性肿瘤之一,严重威胁着人类的生命和健康。近年来随着人们生活水平的提高和饮食结构的改变,结直肠癌的发病率在全球范围内呈逐年增加的趋势。PTPlB是一种典型的非跨膜性蛋白酪氨酸磷酸酶,在糖代谢和脂代谢信号通路中起重要作用,被认为是抗2型糖尿病和肥胖的潜在靶点。糖尿病相关的研究显示,PTP1B可通过胰岛素信号通路中的丝氨酸/苏氨酸激酶途径抑制胰岛素受体及其底物丝氨酸残基的磷酸化从而导致胰岛素受体下调引发糖尿病[1]。在脂代谢方面,PTP1B过表达可通过诱导VLDL过多生成而影响脂蛋白分泌,从而引起脂代谢紊乱而致糖尿病[2]。越来越多的研究表明PTPlB与肿瘤具有相关性[3]。现有文献[4]表明,其对肿瘤的作用具有双向性,即可以促进肿瘤的发生和发展,也可以抑制肿瘤的发生和发展,这主要取决于其相应的作用底物及所处的细胞环境,PTPlB可作用于p-Catenin、 p130Cas、Jak2和Met等分子发挥抑癌基因作用,作用于Src、 p62dok、cortactindras、Crk Ⅱ等分子则发挥癌基因的作用。Chen等[5]已证实在结直肠癌中PTP1B主要发挥癌基因的作用。Sam68蛋白(Src-associated substrated during mitosis of 68KD)是RNA激活蛋白家族成员之一,研究表明Sam68蛋白能促进肿瘤细胞增殖[6]。Sam68可作为一种信号转导和RNA激活蛋白参与细胞周期的调控,它通过影响细胞增殖和凋亡与细胞恶性转化高度相关[7]。Liao等[8]已证实在结直肠癌中存在Sam68的过度表达,其过表达促进了结直肠癌的发生与发展。
目前,国内外关于PTP1B致癌机制的研究尚未明了,其与Sam68之间关系尚不清楚。我们应用免疫组化及Western blotting方法检测PTP1B及Sam68在大肠癌组织中的表达,并分析两者之间的相关性,探讨其与大肠癌发生、发展及侵袭转移的关系。
1 资料与方法
1.1 一般资料
选取华中科技大学同济医学院附属梨园医院、协和医院2005-2014年病理科存档石蜡包埋组织33例及2014-09~2015-05手术切除的大肠癌组织20例,同时取距离肿瘤>10 cm正常组织20例作为对照,新鲜组织标本取材后一份用4%多聚甲醛固定,一份立即置于-80 ℃冰箱中冻存。所有病例术前未行任何抗肿瘤治疗,均无糖尿病、糖耐量异常病史,术后均经病理证实。大肠癌53例,男33例,女20例;年龄31-75岁,平均年龄54.0岁;其中结肠癌26例,直肠癌27例;高中分化癌36例,低分化癌17例;TNM分期中Ⅰ期+Ⅱ期35例,Ⅲ期+Ⅳ期18例;有淋巴结转移的有18例,无淋巴结转移的有35例。
1.2 主要试剂
鼠抗人多克隆PTP1B抗体及兔抗人单克隆Sam68抗体购自abcam公司,免疫组化用PTP1B抗体及Sam68抗体 均按1 ∶500稀释,Western blotting所用PTP1B抗体及Sam68抗体 按1 ∶1 000稀释。所有二抗购自美国Pierce公司,三抗购自Sigma公司。ECL发光液、BCA蛋白浓度测定试剂盒及DAB试剂盒均购自Thermo Scientific公司。
1.3 试验方法
1.3.1 免疫组化(SABC)法检测PTP1B及Sam68的表达 所有53例标本均由4%多聚甲醛固定,常规脱水,透明,石蜡包埋,4 μm连续石蜡切片,烤片,脱蜡,入水,破膜,抗原位于胞质则用pH6.0柠檬酸液中微波热修复,抗原位于胞核则用pH9.0 EDTA液中微波修复;PBS清洗;加 3%H2O2于37 ℃温箱中避光反应 30 min,PBS清洗;;加4%BSA于37 ℃温箱反应30 min,甩液,加一抗,4 ℃孵育过夜后室温复温2 h,PBS清洗;加二抗,37 ℃温箱孵育1 h,PBS清洗;加SABC液37 ℃孵育1 h,PBS清洗;DAB显色,苏木素复染,脱水,透明,封片。 以PBS代替一抗为阴性对照,以购买试剂时所附阳性图片为阳性对照。
1.3.2 免疫组化结果判定 每例切片随机抽取5个高倍镜视野,肿瘤细胞阳性率分值为:<10%,0分;10%-25%,1分; 26%-50%,2分;51%-75%,3分;>75%,4 分;染色强度评分为:无色,0分;淡黄色,1分;棕黄色,2分;棕褐色,3分。 两者得分相乘,≤2分为阴性;≥3分为阳性。
1.3.3 Western blotting法检测PTP1B及Sam68的表达 将-80 ℃冰箱中冻存的组织标本取出称重,每100 mg加入500 μl蛋白裂解液,置匀浆器中反复研磨,使组织充分匀浆化,冰上充分裂解30 min,12 000 r/min离心收集上清,用BCA法测上清蛋白浓度。将蛋白于10%聚丙烯酰胺凝胶电泳分离,电转膜1.5 h,5%脱脂牛奶封闭2 h后,分别加入PTP1B鼠抗人多克隆抗体(1 ∶1 000),Sam68兔抗人单克隆抗体(1 ∶1 000)及GAPDH小鼠抗人单克隆抗体(1 ∶2 000),4 ℃孵育过夜,TBST漂洗,分别加辣根酶标记山羊抗兔及山羊抗小鼠二抗(1 ∶2 000),37 ℃摇床孵育2 h,TBST漂洗,加入ECL发光试剂暗室曝光,所得条带利用IPP软件分析,共检测分析12例。
1.4 统计学处理
采用SPSS20.0软件进行统计分析,其中相关性分析采用Spearman等级相关分析,用百分率表示计数资料,运用χ2检验分析PTP1B及Sam68的表达与临床病理参数的关系,PTP1B及Sam6蛋白在癌组织与正常组织中的相对表达量比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 免疫组织化学法检测PTP1B、Sam68蛋白在大肠癌和正常组织中的表达
PTP1B主要表达在细胞的胞质和/或胞核,为棕黄色颗粒(见图1)。PTP1B在正常组织、大肠癌组织中表达的阳性率分别为10.0%(2/20)和69.8%(37/53),差异有统计学意义(P<0.001)。Sam68主要表达在细胞的胞核,为棕黄色颗粒(见图2);Sam68在正常组织、大肠癌组织中表达的阳性率分别为15.0%(3/20)、69.8%(37/53),差异有统计学意义(P<0.001)。
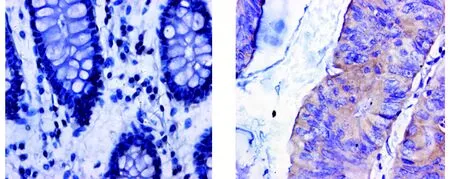
A.正常大肠组织 B.大肠癌组织图1 免疫组化检测PTP1B在大肠癌组织及正常大肠组织中的表达 (×400)Figure 1 Expression of PTP1B in colorectal cancer tissues and normal colorectal tissues (×400)
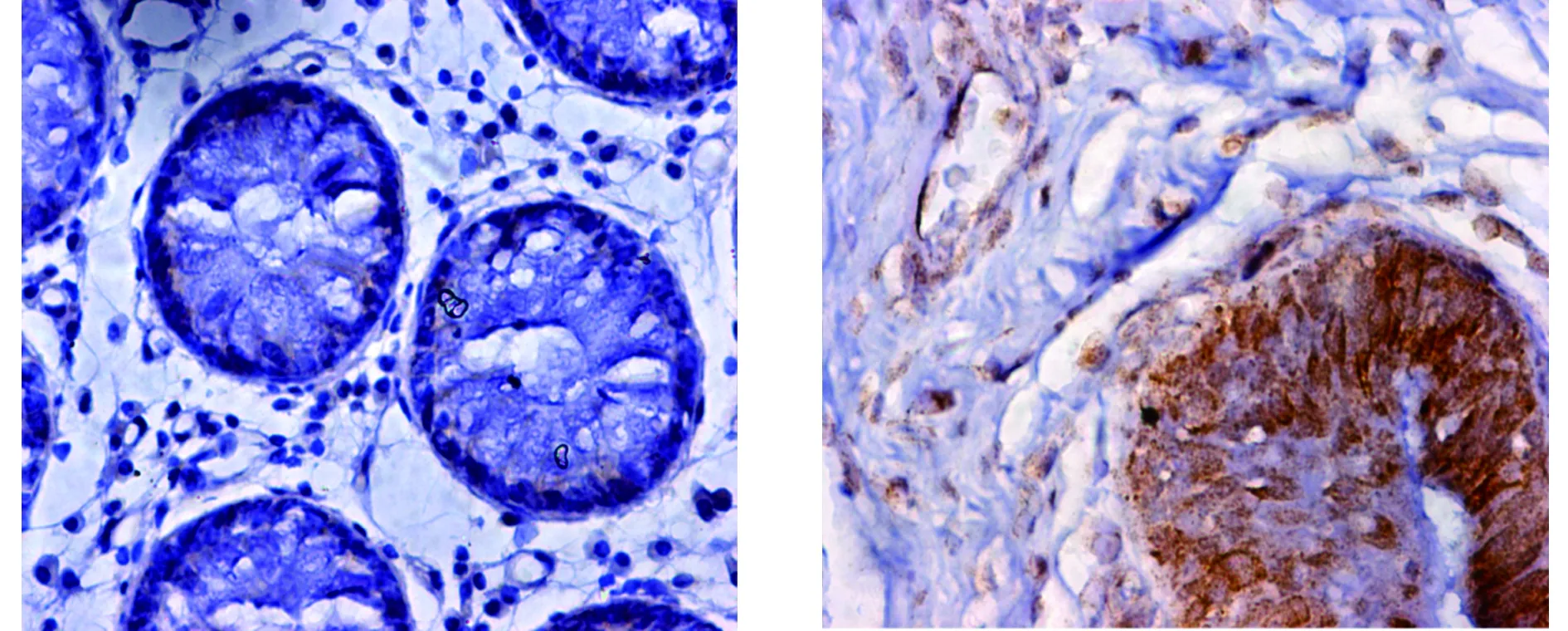
A.正常大肠组织 B.大肠癌组织图2 免疫组化检测Sam68在大肠癌组织及正常大肠组织中的表达 (×400)Figure 2 Expression of Sam68 in colorectal cancer tissues and normal colorectal tissues (×400)
2.2 PTP1B、Sam68在大肠癌中的表达与大肠癌临床病理特征的关系
PTP1B、Sam68的表达在不同性别、年龄、部位,差异无统计学意义(P>0.05);而在不同分化程度、TNM分期、是否有淋巴结转移间差异有统计学意义(P<0.05,见表1)。
2.3 PTP1B、Sam68在大肠癌组织中表达的相关性
经Spearman等级相关性分析,两者在大肠癌组织中的表达呈正相关(r=0.463,P<0.001,见表2)。
2.4 Western blotting法检测结直肠癌组织中PTP1B、Sam68蛋白表达水平
结果显示,PTP1B在大肠癌组织中的表达水平(0.503 3±0.182 3)明显高于癌旁正常组织(0.221 4±0.067 3),两组相比差异有统计学意义(t=4.362,P<0.05,见图3);Sam68在大肠癌组织中的表达水平(0.387 9±0.190 8)也明显高于对应的癌旁正常组织(0.161 8±0.089 9),两组相比差异有统计学意义(t=4.191,P<0.05,见图4)。
表1 PTP1B及Sam68在大肠癌中的表达及与大肠癌临床病理特征之间的相关性 例(%)
Table 1 Expression of PTP1B and Sam68 in colorectal cancer patients with different clinicopathological features cases(%)
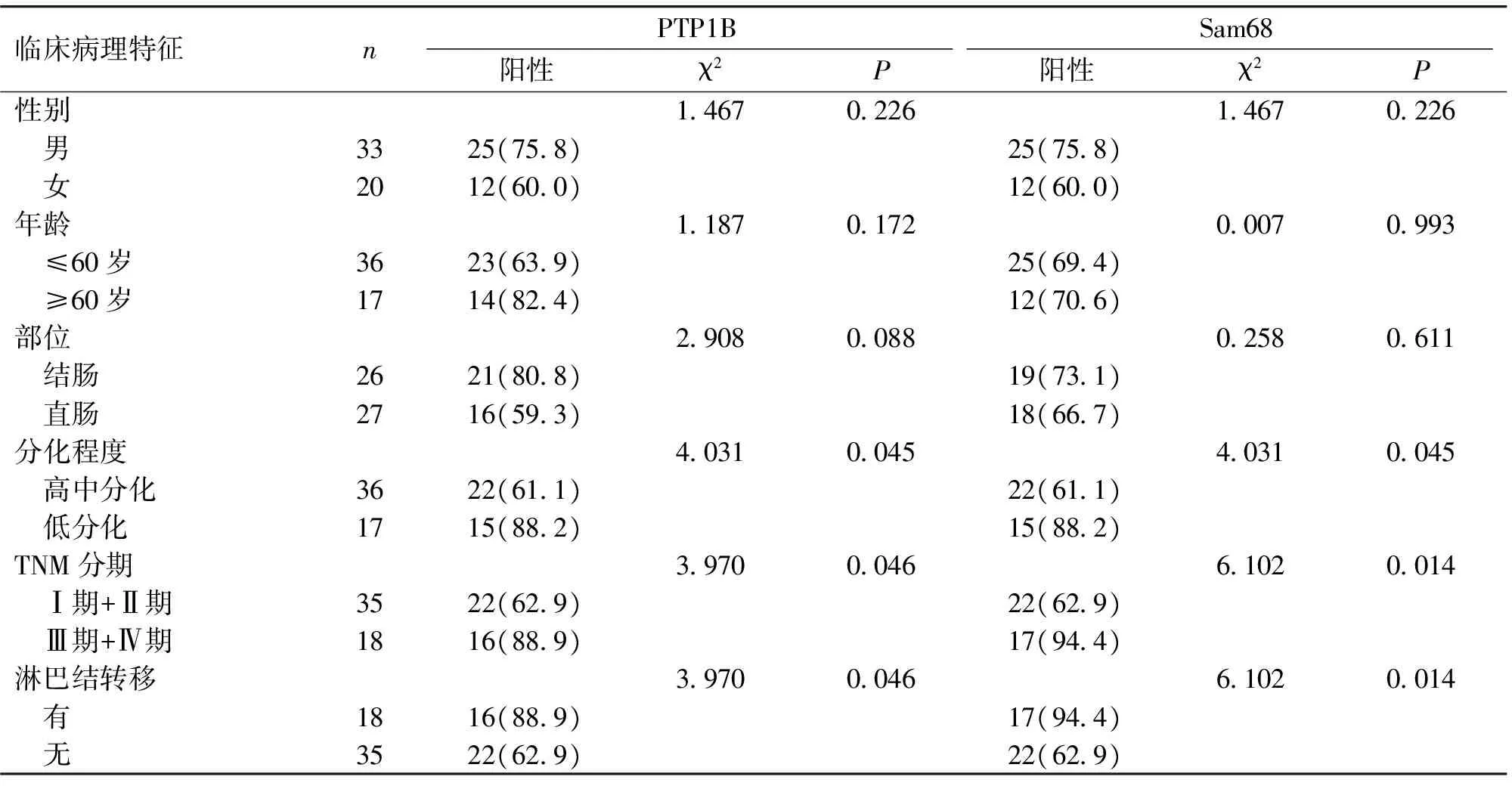
临床病理特征 nPTP1BSam68阳性χ2P阳性χ2P性别1467022614670226 男3325(758)25(758) 女2012(600)12(600)年龄1187017200070993 ≤60岁3623(639)25(694) ≥60岁1714(824)12(706)部位2908008802580611 结肠2621(808)19(731) 直肠2716(593)18(667)分化程度4031004540310045 高中分化3622(611)22(611) 低分化1715(882)15(882)TNM分期3970004661020014 Ⅰ期+Ⅱ期3522(629)22(629) Ⅲ期+Ⅳ期1816(889)17(944)淋巴结转移3970004661020014 有1816(889)17(944) 无3522(629)22(629)
表2 PTP1B、Sam68在大肠癌组织中表达的相关性
Table 2 Correlation between the expression of PTP1B and Sam68 in colorectal tissues
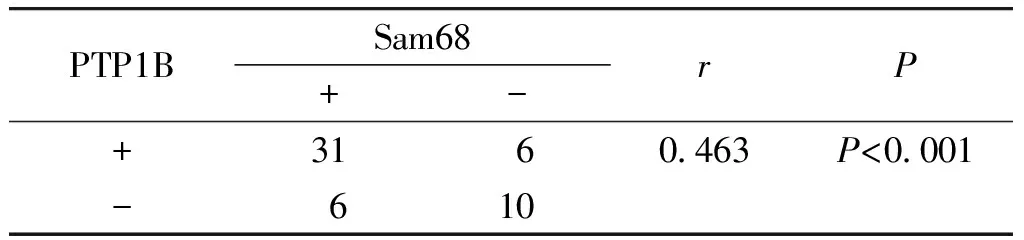
PTP1BSam68+-rP+3160463P<0001-610
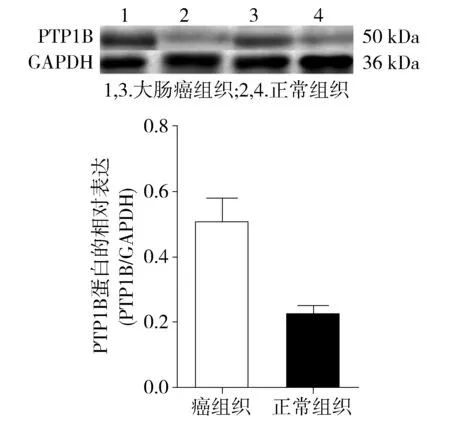
图3 Western blotting检测PTP1B蛋白在结直肠癌及癌旁正常组织中的表达Figure 3 Expression of PTP1B protein in colorectal cancer tissues and matched adjacent non-tumor tissues by Western blotting
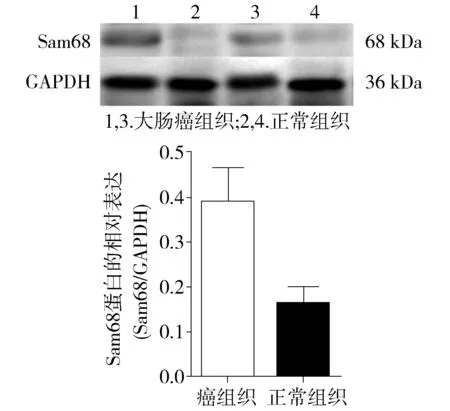
图4 Western blotting法检测Sam68蛋白在结直肠癌及癌旁正常组织中的表达Figure 4 Expresion of Sam68 protein in colorectal cancer tissues and matched adjacent non-tumor tissues by Western blotting
3 讨论
在中国结直肠癌是十大恶性肿瘤之一,随着我国现代化程度和生活水平的提高,人们的饮食结构及生活方式发生了较大变化,致使结直肠癌的发病率逐年增加,发病率居第3位,死亡率居第5位。研究[9]表明,如果结直肠癌能在早期被发现,约90%的病人可以通过外科手术治愈,但由于绝大多数患者发病早期无明显症状,经常是在进展期才被诊断,所以严重影响了结直肠癌的治疗和预后,因此,加强寻找与结直肠癌的发生、发展及预后相关的分子标志物对其诊断、临床分期、个体化治疗方案制定及预后评估具有重要临床意义。
酪氨酸磷酸化是信号传导级联反应中的重要调节步骤,参与调控细胞的增殖、生存、分化、迁移和凋亡等过程[10]。酪氨酸磷酸化由蛋白酪氨酸激酶(protein tyrosine kinases,PTKs)和蛋白酪氨酸磷酸酶(protein tyrosine phosphatases,PTPs)协同调控,当PTP表达或活性调控失常时,可导致信号通路紊乱,从而促进多种疾病的发生,包括肿瘤、糖尿病和炎症等。 蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B,PTP1B)是PTPs超家族成员之一,最初是作为一个分子量为37 kDa的催化结构域从人胎盘组织中所提取,PTP1B基因定位于人20号染色体q13,在许多癌症中发现该区域存在癌基因和基因增殖。PTP1B是一种典型的非跨膜性蛋白酪氨酸磷酸酶,在代谢信号通路中起重要作用,被认为是抗 2型糖尿病和肥胖的潜在靶点。越来越多的研究[3]表明PTP1B与肿瘤具有相关性,其在肿瘤的发生中具有促进作用。例如,PTP1B在胃癌细胞中过表达,抑制PTP1B的表达在体内外可明显抑制胃癌细胞的生长,PTP1B在胃癌组织中的过表达与肿瘤转移和TNM分期密切相关[3]。此外,PTP1B还在多种肿瘤中存在过表达,如上皮来源的肿瘤、乳腺癌[11]和前列腺癌[12]。然而也有研究表明PTPlB是个肿瘤抑制因子,与癌旁正常黏膜相比,PTP1B mRNA在食管癌中的表达明显下降[4]。因此PTP1B在肿瘤的发生中的作用仍存争议,需要进一步探讨。近来,ZhuS等[13]的研究证实在结肠癌细胞中,PTP1B的过度表达与c-Src中529位点残基的磷酸化抑制能力降低有关,导致了软琼脂中菌落的快速形成以及免疫缺陷小鼠中肿瘤生长的加速,从而加速结肠癌细胞的生长。本研究发现,结直肠癌组织中PTP1B的蛋白表达水平及阳性率均高于癌旁正常组织,差异有统计学意义(P<0.05),在蛋白水平证明了PTP1B是影响肿瘤发生的重要因素,此结果与国内外报道一致,可以说明PTP1B确实是恶性侵袭性肿瘤的一个敏感性指标;同时发现PTP1B在大肠癌组织中的表达与性别、年龄、部位无关,而与分化程度、TNM分期、有无淋巴结转移有关,说明PTP1B与结直肠癌患者癌症进展密切相关,随肿瘤进展程度越高,其阳性表达率越高,这与Chen等[5]的研究一致。提示PTP1B高表达可能是结直肠癌发生发展过程中的一个普遍性事件,高表达的PTP1B可能成为结直肠癌侵袭程度的一个判断指标,其可能机制是PTP1B的过度表达激活了Akt、Erk1/2、FAK和Src从而促进了肿瘤的发生、发展[3]。
Sam68是sTAR蛋白家族的代表成员之一,也称为RNA结合蛋白,分子量约为68 kDa,在有丝分裂过程中是酪氨酸蛋白激酶Src的底物。Sam68能与多种信号传导蛋白结合,包括Grb2、Nck、rasGAP、蛋白酪氨酸激酶Src和ItK。Paronetto等[14]报道,在人的前列腺癌组织中Sam68被磷酸化,而癌旁组织和良性增生组织都无Sam68的磷酸化。Sam68被Src激酶磷酸化后与RNA的结合力降低,可引起调控细胞周期的基因在转录后表达异常,导致肿瘤的发生。近年来,多项研究发现Sam68在人类恶性肿瘤中表达上调,主要包括了宫颈癌[15]、非小细胞肺癌[16]、结肠癌[8],并发现sam68与肿瘤细胞增殖及进展密切相关。本研究发现,结直肠癌组织中Sam68的蛋白表达水平及阳性率均高于癌旁正常组织,差异有统计学意义(P<0.05),说明Sam68的高表达促进了肿瘤的发生,且结合临床病理资料分析发现其在大肠癌组织中的高表达与性别、年龄、部位无关,而与分化程度、TNM分期及有无淋巴结转移有关,说明Sam68与结直肠癌患者癌症进展密切相关,随肿瘤进展程度越高,其阳性表达率越高,这与Liao等[8]的研究结果一致。以上结论表明,Sam68很可能具有癌基因的特性,在大肠癌的发生中起重要作用,但其具体机制尚不明确,有待进一步探究。
相关性分析发现,PTP1B与Sam68蛋白在大肠癌组织中表达呈正相关,且随着TNM分期、淋巴结转移的增加,两者的表达均升高,提示两者共同促进大肠癌的发生、发展、侵袭及转移。之前有研究[4]表明PTP1B作用于Scr发挥癌基因的作用,而在有丝分裂中Sam68是Scr的作用底物,Sam68被Src激酶磷酸化后与RNA的结合力降低,可引起调控细胞周期的基因在转录后表达异常,导致肿瘤的发生。因此通过实验结果,我们可推测出通过Scr为桥梁也许PTP1B与Sam68之间可能具有协同作用。两者联合检测对大肠癌的诊断有一定意义,同时我们推测联合应用两者的抑制剂可能为大肠癌的治疗提供又一新的方向。但两者在肿瘤发生进展中相互作用的具体机制目前尚不完全明了,下一步需进一步增加样本量进行研究探讨。
[1] Au CS,Wagner A,Chong T,etal.Insulin regulates hepatic apolipoprotein B production independent of the mass or activity of Akt1/PKBalpha[J].Metabolism,2004,53(2):228-235.
[2] Qiu W,Avramoglu RK,Dube N,etal.Hepatic PTP-1B expression regulates the assembly and secretion of apolipoprotein B-containing lipoproteins:evidence from protein tyrosine phosphatase-1B overexpression,knockout,andRNAi studies[J].Diabetes,2004,53(12):3057-66.
[3] Wang J,Liu B,Chen X,etal.PTPlB expression contributes to gastric cancer progression[J].Med Oncol,2012,29(2):948-956.
[4] Lessard L,Stuible M,Tremblay ML,etal.The two faces of PTP1B in cancer[J].Biochim Biophys Acta,2010,1804(3):613-619.
[5] ChenQT,LiY,Li Z,etal.Overexpression of PTP1B in human colorectal cancer and its association with tumor progression and prognosis[J].J Mol Hist,2014,45(2):153-159.
[6] Paola F,Davide P,Anna DM,etal.SAM68:Signal transduction and RNA metabolism in human cancer[J].Biomed Res Int,2015,2015:528954.
[7] Bielli P,Busa R,Paronetto MP,etal.The RNA-binding protein Sam68 is a multifunctional player in human cancer[J].Endocr Relat Cancer,2011,18(4):91-102.
[8] Liao WT,Liu JL,Wang ZG,etal.High expression level and nuclear localization of Sam68 are associated with progression and poor prognosis in colorectal cancer[J].BMC Gastroenterol,2013,13(9):126-136.
[9] Moreaux J,Catala M.Carcinoma of the colon:long-term survival and prognosis after surgical treatment in a series of 798 patients[J].World J Surg,1987,1l(6):804-809.
[10] Motiwala T,Jacob ST.Role of protein tyrosine phosphatases in cancer[J].Prog Nucleic Acid Res Mol Biol,2006,8(1):297-329.
[11] Arias-Romero LE,Saha S,Villamar-Cruz O,etal.Activation of Src by protein tyrosine phosphatase 1B is required for ErbB2 transformation of human breast epithelial cells[J].Cancer Res,2009,69(11):4582-4588.
[12] Wu C,Zhang L,Bourne PA,etal.Protein tyrosine phosphatase PTP1B is involved in neuroendocrine differentiation of prostate cancer[J].Prostate,2006,66(2):1125-1135.
[13] Zhu S,Bjorge JD,Fujita DJ.PTP1B contributes to the oncogenioproperties of colon cancer cells through Src activation[J].Cancer Res,2007,67(21):10129-10137.
[14] Paronetto MP,Farini D,Sammarco I,etal.Expression of a truncated form of the c-Kit tyrosine kinase receptor and activation of Src kinase in human prostatic cancer[J].Am J Pathol,2004,164(4):1243-1251.
[15] Li Z,Yu C P,Zhong Y,etal.Sam68 expression and cytoplasmic localization is correlated with lymphonode metastasis as well as prognosis in patients with early-stage cervical cancer[J].Ann Oncol,2012,23(2):638-646.
[16] Zhang Z,Xu Y,Sun N,etal.High Sam68 expression predicts poor prognosis innon-smallcelllungcancer[J].Clin Transl Oncol,2014,16(10):886-891.
Expression of PTP1B and Sam68 in colorectal cancer and its significance
YU Honglu,REN Yajun,XIONG Zhifan*
(DepartmentofDigestion,LiyuanHospitalAffiliatedtoTongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430077,China;*Correspondingauthor,E-mail:xiongzhifan@126.com)
ObjectiveTo investigate the expression of PTP1B and Sam68 in human colorectal cancer tissues,and its relationships with clinicopathological parameters.MethodsImmunohistochemistry was used to detect the expression of PTP1B and Sam68 in 53 cases of colorectal cancer tissues and 20 cases of normal tissues.The expression of PTP1B and Sam68 was compared between patients with different clinicopathological features of colorectal cancer.The expression of PTP1B and Sam68 in 12 cases of colorectal cancer tissues and matched adjacent non-tumorous tissues was detected by Western blotting.ResultsThe results of immunohistochemistry demonstrated that the positive expression rates of PTP1B and Sam68 protein in 53 cases of colorectal cancer were significantly higher than those of normol tissues(P<0.001).The expression of PTP1B and Sam68 in colorectal cancer was significantly different in patients with different differentiation,TNM stage and lymph node matastasis(P<0.05).The expression of PTP1B and Sam68 was positively correlated(r=0.463,P<0.001).Western blotting results showed that the expression of PTP1B and Sam68 protein in colorectal cancer was significantly higher than that of matched adjacent non-tumor tissues.ConclusionThe expression of PTP1B and Sam68 protein may be related to the development,metastasis and invasion of human colorectal cancer,and they may synergistically promote the development of colorectal carcinoma.
colorectal cancer; PTP1B; Sam68; immunohistochemistry; Western blotting
余红璐,女,1990-05生,在读硕士,E-mail:yuhonglu664@163.com
2017-02-17
R735.3
A
1007-6611(2017)06-0596-06
10.13753/j.issn.1007-6611.2017.06.019

