人细胞角蛋白1基因的克隆、原核表达及纯化
王 博, 侯卫坤, 周 艳, 蔡永松, 王林玉, 张 英, 韩 燕, 孟列素*
(1西安交通大学第一附属医院转化医学中心,西安 710061; 2西安交通大学医学部基础医学院生物化学与分子生物学系; 3陕西省肿瘤精准医学重点实验室; 4西安交通大学医学部附属红会医院关节病医院骨坏死与关节重建病区; 5西安交通大学第一附属医院皮肤科; 6西安交通大学第一附属医院消化内科; *通讯作者,E-mail:mengliesu@mail.xjtu.edu.cn)
人细胞角蛋白1基因的克隆、原核表达及纯化
王 博1,2,3, 侯卫坤4, 周 艳5, 蔡永松2, 王林玉1,3, 张 英6, 韩 燕2, 孟列素2*
(1西安交通大学第一附属医院转化医学中心,西安 710061;2西安交通大学医学部基础医学院生物化学与分子生物学系;3陕西省肿瘤精准医学重点实验室;4西安交通大学医学部附属红会医院关节病医院骨坏死与关节重建病区;5西安交通大学第一附属医院皮肤科;6西安交通大学第一附属医院消化内科;*通讯作者,E-mail:mengliesu@mail.xjtu.edu.cn)
目的 克隆人细胞角蛋白1(cytokeratin 1,CK1),原核表达系统表达融合蛋白并进行纯化和鉴定。 方法 从人角质形成细胞系中提取RNA,以RT-PCR反转录cDNA,用特异性引物PCR扩增人CK1编码区全长基因(NM_006121.3),内切酶EcoRⅠ和Hind Ⅲ双酶切PCR产物和pET-28a载体,T4 DNA连接酶将人CK1编码区全长基因克隆到pET-28a载体上,IPTG诱导融合蛋白his-CK1的表达。融合蛋白经Ni2+亲和层析纯化,SDS-PAGE和Western blot鉴定。 结果 测序鉴定表明构建表达载体中人CK1序列正确;融合蛋白his-CK1的相对分子量为70 kD,并在大肠杆菌中高效表达;融合蛋白以包涵体形式,在变性条件下纯化融合蛋白his-CK1,其纯度大于90%;纯化的融合蛋白his-CK1可与商品化CK1抗体以及His抗体特异性结合。 结论 成功构建了原核表达质粒pET-28a-CK1,并成功诱导表达及纯化融合蛋白his-CK1。
细胞角蛋白1; 基因克隆; 融合蛋白; 原核表达系统
细胞角蛋白(cytokeratin,CK)属于中间丝家族,是20世纪20年代由Franke等[1]在内皮细胞中首次发现。目前已知的细胞角蛋白家族由30个基因编码,其中20个编码上皮细胞相关基因,其余10个特异性编码丝胞(trichocytes)基因[2]。CK主要分为两型,Ⅰ型酸性细胞角蛋白,包括CK9、CK10、CK12、CK13、CK14、CK16、CK17、CK18、CK19和CK20,以及CK1、CK2、CK3、CK4、CK5、CK6、CK7和CK8,Ⅱ型碱性或是中性细胞角蛋白,两型细胞角蛋白分子的二聚体形成细胞角蛋白链[3]。细胞角蛋白的种类和数目因细胞类型、细胞生长状况和分化程度的不同而异,故CK表达具有组织器官的特异性,其中CK7特异性表达在泌尿生殖道的导管上皮细胞中,CK20常表达在胃肠道,CK19可作为非小细胞肺癌的血清学标志[4-6]。CK1主要是成人皮肤基底层以上部分的重要组成部分,该基因的突变可导致表皮松解性角化过度型鱼鳞病等一系列皮肤疾病。所以,CK1的克隆与表达是深入研究CK1基因以及其蛋白结构的基础,为进一步认识相关皮肤疾病提供较好前期帮助。
本研究从人角质形成细胞中提取RNA,以反转录的cDNA为模板特异性扩增人细胞角蛋白1的序列,并将该片段插入原核表达载体pET-28a,最终探讨和优化了his-CK1融合蛋白的制备流程,为CK1的高效表达和纯化提供思路,可进一步深入揭示上皮细胞中细胞角蛋白的功能,为其相关疾病的分子机制研究奠定基础。
1 材料和方法
1.1 质粒、菌株和细胞系
原核表达质粒pET-28a(+)购自德国Novagen公司,该载体在其5′端含有His标签,并在本实验室西安交通大学医学部基础医学院生物化学与分子生物学系保存。融合蛋白N端带有6个His组成的标签,能够较好地运用镍柱进行纯化;宿主菌E.coliBL21( DE3)购自天根生化科技(北京)有限公司;人角质形成细胞株(HaCaT细胞)由西安交通大学第一附属医院转化医学中心保存,用含10% FBS高糖DMEM培养基,置于37 ℃、5% CO2培养箱中无菌培养。
1.2 主要试剂和工具酶
DNA凝胶回收试剂盒和质粒小量提取试剂盒购自天根生化科技(北京)有限公司;高糖DMEM培养基购自美国Hyclone公司;胎牛血清购自美国Gibco公司;TRIzol购自美国Invitrogen公司;cDNA反转录试剂盒RevertAidTMfirst strand cDNA synthesis kit购自美国Thermo Fisher公司;IPTG购自美国Amresco公司;Benzonase核酸酶购自德国Merck公司;亲和层析柱(HisTrap)购自美国GE公司;兔抗人Cytokeratin 1多克隆抗体购自英国Abcam公司;HRP 标记羊抗兔IgG抗体购自北京博奥森生物技术有限公司;ECL试剂盒购自美国Pierce公司;相关引物由生工生物工程(上海)股份有限公司合成;高保真PCR酶TransStart FastPfu DNA Polymerase购自北京全式金生物技术有限公司;限制性内切酶EcoRⅠ和Hind Ⅲ、T4 DNA连接酶均购自宝生物工程(大连)有限公司。
1.3 目的基因CK1的PCR扩增
使用TRIzol试剂按照说明书要求提取HaCaT细胞总RNA,定量后取5 μg 总RNA,按照RevertAidTMfirst strand cDNA synthesis kit说明书反转录成cDNA。以该cDNA为模板,PCR扩增CK1基因编码区序列全长。根据GenBank中Keratin 1(NM_006121.3)mRNA序列的CDs区域,用Oligo 7软件设计克隆基因编码区全长的特异性引物,并分别在上下游引物上引入EcoRⅠ和Hind Ⅲ酶切位点(下划线标出)。上游引物:5′-CCGGAATTCATGAGTCGACAGTTTAGTTCCAG-3′;下游引物:5′-CCCAAGCTTTTATCTGGTTACTCCGGAATAAGTG-3′,产物长度1 953 bp。PCR反应体系:模板cDNA 1 μl,上游和下游引物(10 μmol/L)各1 μl,5×FastPfu Buffer 10 μl,2.5 mmol/L dNTPs 4 μl,FastPfu DNA Polymerase 1 μl,ddH2O补至50 μl;PCR反应条件:95 ℃ 3 min;95 ℃ 20 s,58 ℃ 20 s,72 ℃ 1 min,40个循环;72 ℃ 5 min。PCR产物经1%琼脂糖凝胶电泳鉴定分析。
1.4 原核表达载体pET-28a-CK1的构建
将PCR产物用DNA凝胶回收试剂盒纯化,用限制性内切酶EcoRⅠ和Hind Ⅲ双酶切纯化的PCR产物以及原核表达载体pET-28a(+)质粒。将酶切产物经0.8%琼脂糖凝胶电泳分析,使用DNA凝胶回收试剂盒纯化双酶切的PCR和载体产物。按照目的基因与载体物质的量3∶1的比例用T4 DNA连接酶将CK1基因连接在原核表达载体pET-28a上。连接产物转化E.coliBL21( DE3)感受态细菌,同时以对照质粒和无菌蒸馏水作为对照进行转化,涂布在含有卡那霉素(Kan)的LB平板上,37 ℃倒置培养14-16 h。挑取单克隆菌落,接种在含Kan的LB培养液中,37 ℃振荡培养过夜。使用质粒小量提取试剂盒提取筛选出的单克隆菌液中质粒DNA,经限制性内切酶EcoRⅠ和Hind Ⅲ双酶切验证阳性克隆。同时菌液作为模板进行菌液PCR鉴定,将鉴定的双酶切产物和菌液PCR产物经0.8%琼脂糖凝胶电泳,阳性克隆送生工生物工程(上海)股份有限公司进行测序鉴定。测序结果在线BLAST进行基因序列比对分析,比对序列与CK1序列完全相同的质粒命名为pET-28a-CK1。
1.5 融合蛋白his-CK1的诱导表达
将pET-28a-CK1对应的菌液按照1∶100转接含Kan的LB培养液中,37 ℃振荡培养至细菌达到对数生长期,即A600约为0.6时,将菌液分为5管加入ITPG进行诱导表达,使IPTG的终浓度分别为0.2,0.4,0.6,0.8,1.0 mmol/L,37 ℃振荡培养3 h。取1 ml菌液,4 ℃ 5 000×g离心5 min,弃上清,加入50 μl 10 mmol/L Tris-HCl(pH 8.0)重悬沉淀,10%SDS-PAGE电泳以及考马斯亮蓝染色鉴定并选择合理的诱导剂浓度;同上条件选取合适的IPTG浓度分别在IPTG诱导前、诱导后1,2,3,4,5,6 h取1 ml菌液,4 ℃ 5 000×g离心5 min,弃上清,加入50 μl 10 mmol/L Tris-HCl(pH 8.0)重悬沉淀,10% SDS-PAGE电泳以及考马斯亮蓝染色鉴定融合蛋白his-CK1是否表达,并选择合理的诱导时间。
1.6 融合蛋白his-CK1的纯化
将菌pET-28a-CK1 37 ℃振荡培养过夜,按照1∶100转接含Kan的LB培养液中,37 ℃振荡培养至A600约为0.6时,加入IPTG至终浓度为0.4 mmol/L,37℃振荡培养3 h,诱导融合蛋白his-CK1表达。将所有菌液4 ℃ 5 000×g离心5 min,弃上清,加入3倍体积的细胞裂解液[(100 mmol/L NaCl,1 mmol/L EDTA,50 mmol/L Tris-HCl(pH 8.0)]重悬菌体沉淀。冰上加入PMSF和溶菌酶混匀30 min,再加入Benzonase核酸酶振荡混匀,室温放置直至裂解液不再粘稠。4℃ 12 500×g离心15 min后弃上清,沉淀即为包涵体;包涵体用4 mol/L尿素细胞裂解缓冲液重悬,4 ℃放置2 h并间断性涡旋促进溶解。4 ℃ 12 500×g离心15 min,弃上清,剩余包涵体用8 mol/L尿素结合缓冲液溶解,通过0.22 μm滤器过滤后上样安装在液相色谱系统(SHIMASDZU)的亲和层析柱(HisTrap),流速为1 ml/min,检测波长为280 nm。上样完后依次用35 mmol/L、50 mmol/L和100 mmol/L咪唑洗脱缓冲液作为流动相分步收集洗脱的目的蛋白his-CK1。将纯化后的蛋白用10% SDS-PAGE电泳以及银染鉴定融合蛋白his-CK1的纯化程度。
1.7 纯化his-CK1蛋白的鉴定
将纯化的融合蛋白his-CK1进行10%SDS-PAGE电泳后,电转移至NC膜上,5%脱脂牛奶室温封闭2 h,加入一抗兔抗人Cytokeratin 1多克隆抗体(1∶2 000),4℃孵育过夜。TBST洗膜3次,每次10 min,加入二抗HRP标记羊抗兔Ig G抗体(1∶10 000),室温孵育2 h,TBST洗膜2次,每次10 min,TBS洗膜10 min,ECL化学发光并照相。
2 结果
2.1 人CK1基因的克隆
HaCaT细胞提取总RNA,经RT-PCR转录成cDNA,以cDNA为模板PCR特异性扩增人CK1基因的编码区。PCR反应产物经1%琼脂糖凝胶电泳,见一条约2 000 bp的条带,与目的基因的理论大小相一致(见图1)。
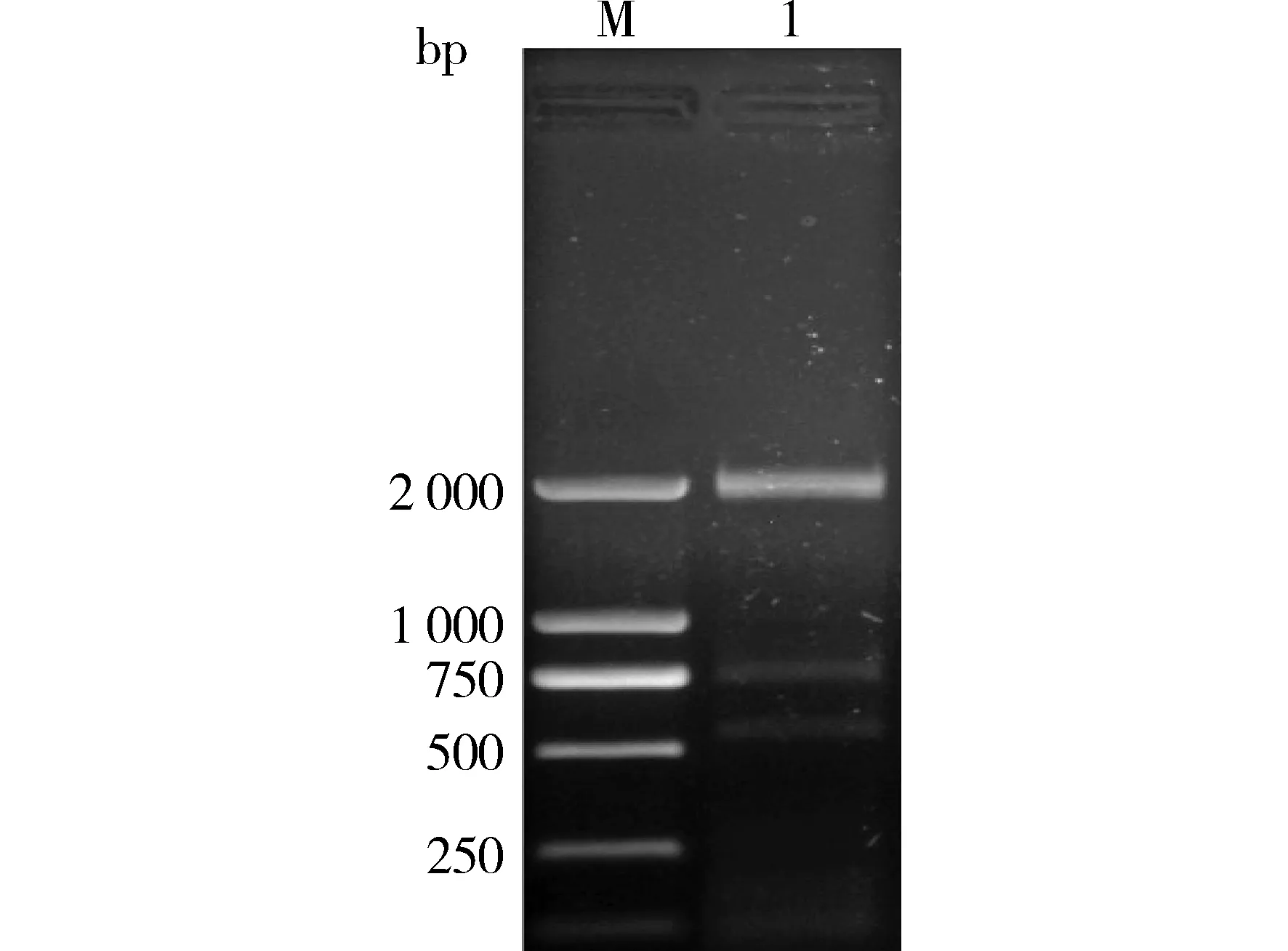
M.DL2000 marker;1.人CK1基因的PCR扩增产物图1 人CK1基因的PCR扩增 Figure 1 PCR amplification of human CK1 fragment
2.2 原核表达载体pET-28a-CK1质粒的构建及鉴定
将上述PCR扩增产物和质粒pET-28a进行双酶切,连接,转化BL21(DE3)感受态细菌,涂布于含Kan的LB平板上,37 ℃倒置培养过夜,挑取单克隆菌落进行鉴定。使用上述PCR克隆引物对菌液进行PCR鉴定,PCR反应产物经0.8%琼脂糖凝胶电泳,见一条与目的基因的理论大小相一致的条带(见图2A)。再提取新构建的质粒,对重组质粒pET-28a-CK1进行EcoR Ⅰ和Hind Ⅲ双酶切鉴定,0.8%琼脂糖凝胶电泳结果显示,约2 000 bp处的条带为目的基因CK1,约5 300 bp处的条带为载体pET-28a(见图2B)。将构建成功的质粒pET-28a-CK1送公司测序,测序结果在NCBI中BLAST显示克隆序列与人CK1的编码区序列(NM_006121.3)完全一致,即本研究已成功构建原核表达载体pET-28a-CK1。
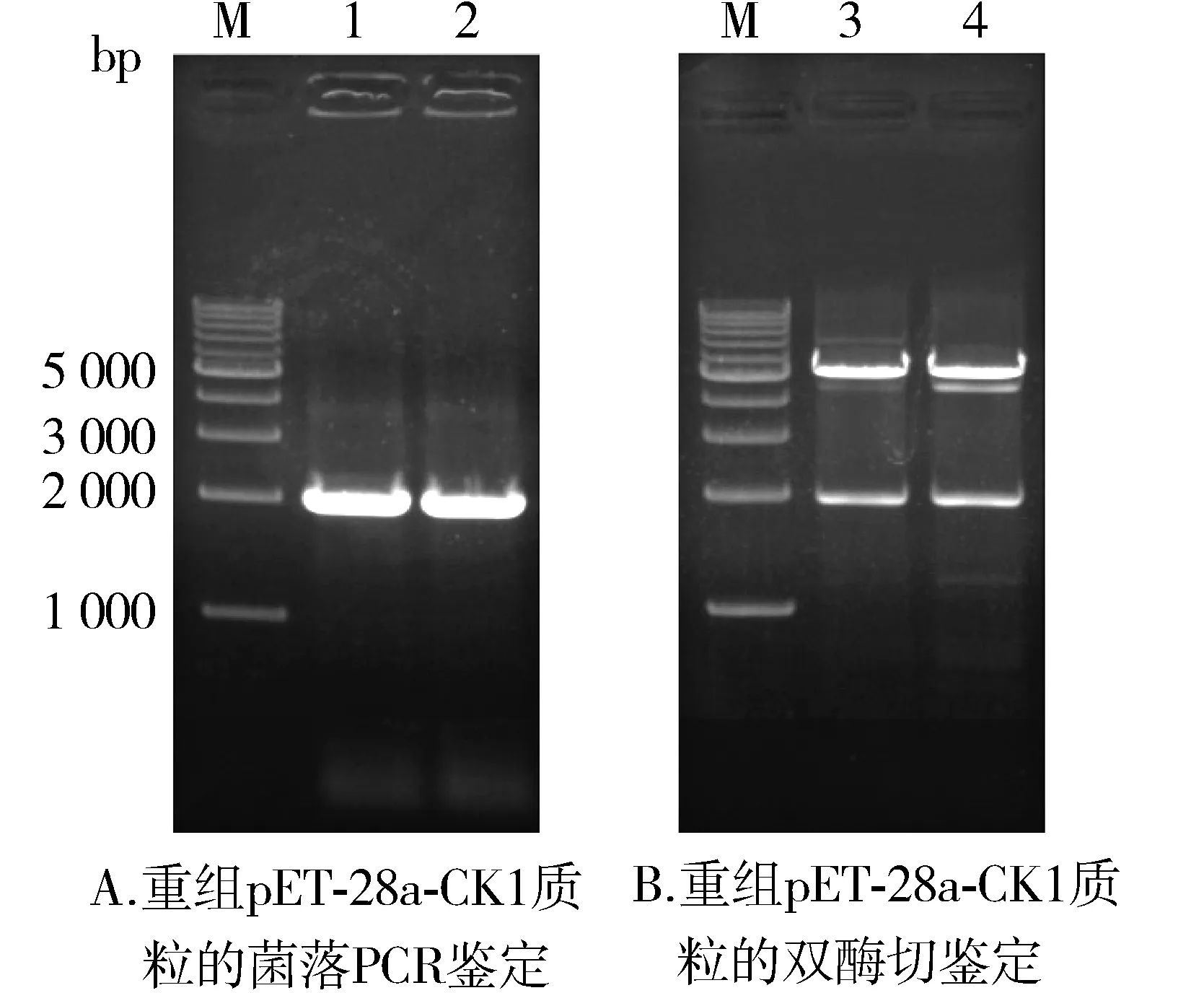
M.1 kb marker;1,2.构建的pET-28a-CK1载体单克隆菌落PCR产物;3,4.重组质粒pET-28a-CK1双酶切鉴定结果 图2 重组pET-28a-CK1质粒的菌落PCR和双酶切鉴定Figure 2 Identification of recombinant plasmid pET-28a-CK1 by colony PCR and restriction enzyme digestion
2.3 不同浓度IPTG对融合蛋白his-CK1表达量的影响
使用不用浓度的IPTG(0.2,0.4,0.6,0.8,1 mmol/L),37 ℃振荡培养3 h,诱导融合蛋白his-CK1的表达发现,在诱导剂的浓度为0.4 mmol/L即可较好地诱导表达融合蛋白(见图3)。
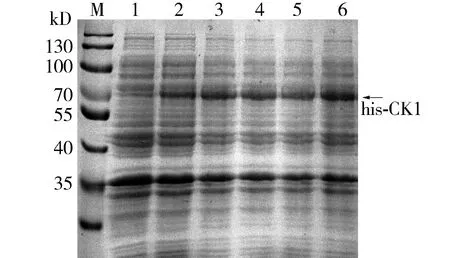
M.蛋白质marker;1.未加入IPTG;2-6.加 入0.2,0.4,0.6,0.8,1 mmol/L IPTG图3 不同IPTG浓度诱导融合蛋白his-CK1表达的SDS-PAGE分析Figure 3 SDS-PAGE analysis of fusion protein his-CK1 after induced by different concentrations of IPTG
2.4 IPTG诱导融合蛋白his-CK1表达时间的确定
选择上述0.4 mmol/L IPTG诱导剂在37 ℃条件下振荡培养,分别诱导1,2,3,4,5,6 h,融合蛋白his-CK1的表达量在刚开始诱导1 h内大量表达,随后随时间的延长略有所增加,在诱导3 h后融合蛋白的表达量基本趋于稳定(见图4)。
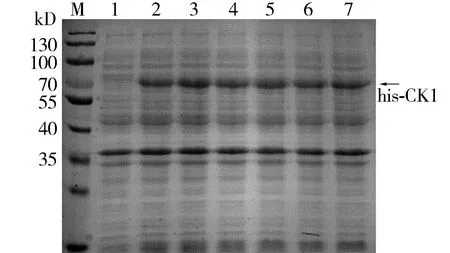
M.蛋白质marker;1.加入IPTG前;2-7.加入IPTG诱导1,2,3,4,5,6 h 图4 不同IPTG诱导时间诱导融合蛋白his-CK1表达的SDS-PAGE分析Figure 4 SDS-PAGE analysis of fusion protein his-CK1 after induced by IPTG for different time
2.5 融合蛋白his-CK1的纯化
由于融合蛋白his-CK1主要以包涵体形式存在,故his-CK1的纯化在变性的条件下进行。将包涵体用8 mol/L尿素结合缓冲液溶解,经Ni2+亲和层析柱富集,再依次用35 mmol/L、50 mmol/L和100 mmol/L咪唑洗脱缓冲液洗脱并分步收集融合蛋白his-CK1。分步收集的洗脱蛋白通过SDS-PAGE凝胶电泳和银染分析,结果显示50 mmol/L 咪唑洗脱缓冲液可以获得纯度和量最优的纯化蛋白,且大小约为70 kDa,与融合蛋白的理论分子量相一致(见图5)。
2.6 纯化his-CK1蛋白的鉴定
将50 mmol/L咪唑洗脱缓冲液洗脱的融合蛋白和未加IPTG诱导的总蛋白,通过CK1和his抗体经Western blot分析鉴定结果证实,融合蛋白his-CK1的表达和纯化(见图6)。
3 讨论
中间丝(intermediate filaments, IFs)广泛分布在真核细胞中,直径10 nm左右,介于肌动蛋白丝与肌球蛋白丝之间,其与肌动蛋白丝、微管都是细胞骨架的主要组成部分[7]。中间丝在细胞中分布主要围绕细胞核,并延伸至细胞质膜与其相连结,是最为稳定的细胞骨架成分[8]。它们为细胞提供机械组织稳定性的同时,还参与细胞的囊泡运输、细胞器定位、细胞周期调控、细胞分化和细胞活力等过程[9-11]。哺乳动物上皮细胞的细胞质中中间丝是由细胞角蛋白组成。
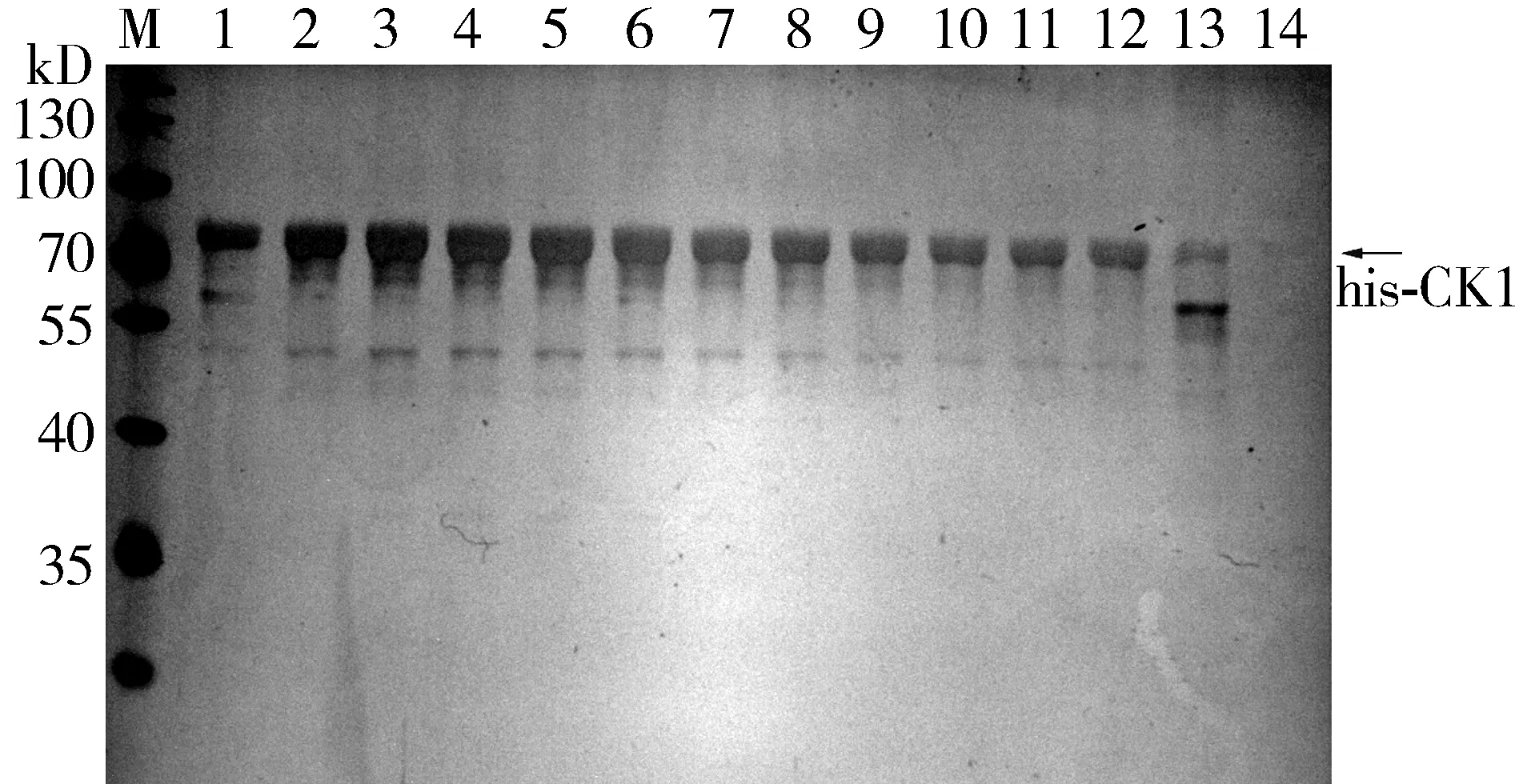
M.蛋白质marker;1.加入35 mmol/L咪唑洗脱缓冲液;2-8.加入50 mmol/L咪唑洗脱缓冲液;9-12.加入100 mmol/L咪唑洗脱缓冲液;13-14.加入层析柱洗脱缓冲液图5 不同浓度咪唑纯化融合蛋白his-CK1的银染分析Figure 5 Fusion protein his-CK1 after treated with different concentrations of imidazole by silver stain analysis
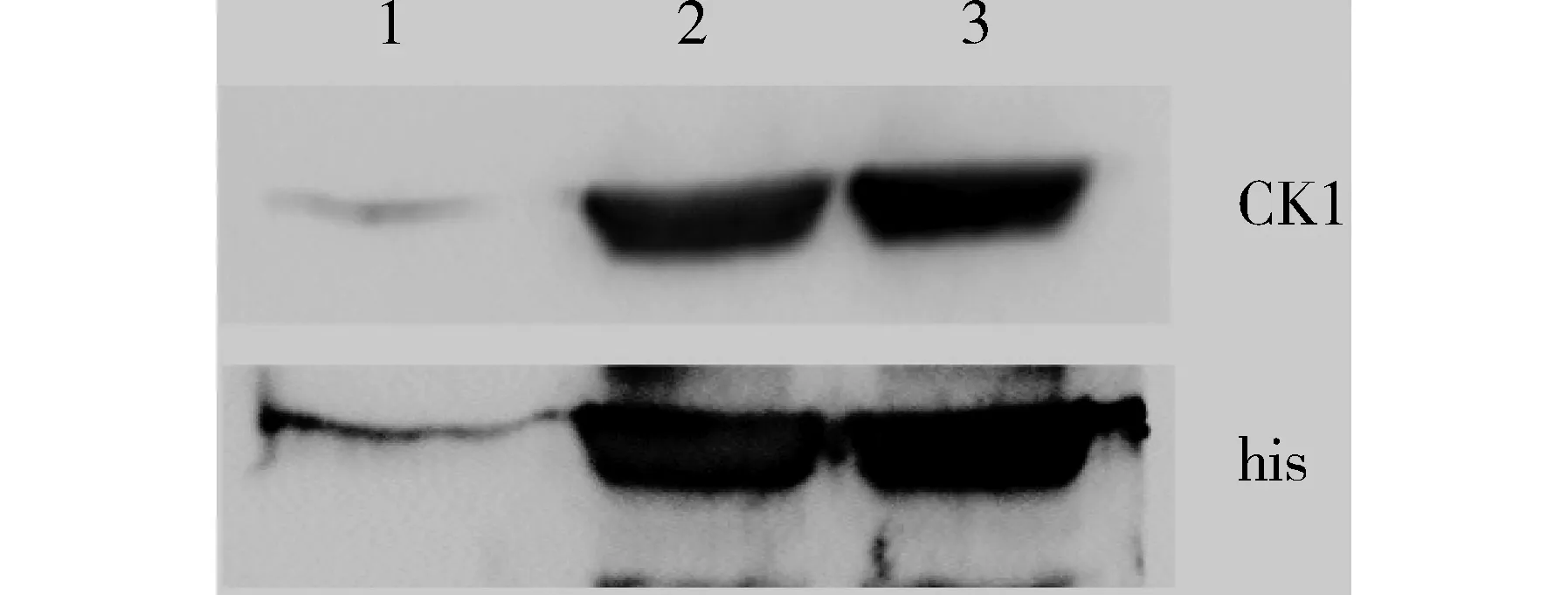
1.未加IPTG诱导的总蛋白;2,3.加入50 mmol/L咪唑洗脱缓冲液洗脱的融合蛋白图6 融合蛋白his-CK1的Western blot分析Figure 6 Western blot analysis of fusion protein his-CK1
细胞角蛋白的二级保守结构是所有中间丝所共有,其分子量大约为44-66 kD。由于细胞角蛋白具有较高的稳定性和耐化学型,是因为其在空间结构上具有一个高度保守的核心功能域,中间大约300-330个氨基酸残基组成的α螺旋杆状结构域以及N末端和C末端可变长度的非螺旋结构域[12]。N末端非螺旋结构域由V1和H1两个亚基组成,C末端非螺旋结构域由V2和H2亚基组成,而核心α螺旋杆状结构域由保守的L1、L12和L2连接序列将四个螺旋亚基1A、1B、2A和2B连接组成[13]。根据细胞角蛋白等电点的不同,将其分为Ⅰ型和Ⅱ型,通过Ⅰ型和Ⅱ型细胞角蛋白分子的等量连接形成丝状结构的角蛋白[14]。故细胞角蛋白亚基可形成特异性的中间丝,中间丝的网络又参与了大量的细胞功能过程,而且CK1又是Ⅱ型细胞角蛋白中最典型分子,因此CK1可以作为研究角蛋白结构和功能的重要分子。
大量的细胞实验和转基因动物研究表明,细胞角蛋白中间丝是保护上皮细胞抵抗不同机械和非机械压力的重要必要条件[15-17]。细胞角蛋白可以将细胞核与细胞质膜在空间上联系起来,从而在细胞核和细胞质膜之间传递信号[18]。而且多种人类疾病已证实细胞角蛋白的功能在维持上皮组织完整性中起到重要作用[19]。人类细胞角蛋白CK1通常与CK10配对,主要表达于基底层以上的各层中,并作为正常细胞终末分化的标志之一,同时角质形成细胞病变为主的皮肤病中都存在细胞角蛋白的异常表达[20]。CK1或者CK10基因的突变可导致角蛋白原发性鱼鳞病(keratinopathic ichthyoses),N末端或者C末端结构域错义突变的杂合子可导致常染色体显性表皮松解性鱼鳞病(epidermolytic ichthyosis,EI)[21]。这些研究表明,CK1的表达与细胞的分化以及部分皮肤疾病的发生和发展密不可分,但其具体机制尚需进一步研究。
本研究通过从HaCaT细胞系的mRNA中特异性扩增人CK1编码区全长基因并克隆到pET-28a载体上,转入BL21感受态细胞后,选择终浓度0.4 mmol/L IPTG以及诱导时间3 h诱导融合蛋白his-CK1的表达。融合蛋白经Ni2+亲和层析纯化后鉴定并检测纯度高于90%,说明本研究成功构建了原核表达质粒pET-28a-CK1,并建立融合蛋白his-CK1的诱导和纯化方法。CK1的克隆与表达将有助于加深对CK1表达异常疾病的认识,同时也为深入研究上皮细胞中细胞角蛋白的功能和其相关疾病的具体分子机制奠定了基础。
[1] Franke WW,Schmid E,Osborn M,etal.Intermediate-sized filaments of human-endothelial cells[J].J Cell Biol,1979,81(3):570-580.
[2] Jave-Suarez LF,Langbein L,Winter H,etal.Androgen regulation of the human hair follicle:The type 1 hair keratin hHa7 is a direct target gene in trichocytes[J].J Invest Dermatol,2004,122(3):555-564.
[3] McLean WH,Moore CB.Keratin disorders:from gene to therapy[J].Hum Mol Genet,2011,20(R2):R189-197.
[4] Shi XY,Bhagwandeen B,Leong AS.CDX2 and villin are useful markers of intestinal metaplasia in the diagnosis of Barrett esophagus[J].Am J Clin Pathol,2008,129(4):571-577.
[5] Altree-Tacha D,Tyrrell J,Haas T.CDH17 is a more sensitive marker for gastric adenocarcinoma than CK20 and CDX2[J].Arch Pathol Lab Med,2016:Epub ahead of print.
[6] Yan L,Yao Y,Wang LH,etal.Detection of CK19,LUNX,and KS1/4 mRNA expression in the peripheral blood for diagnosis of micrometastases in patients with non-small cell lung cancer and their clinical implications[J].Genet Mol Res,2015,14(4):15090-15095.
[7] Geisler F,Leube RE.Epithelial intermediate filaments:guardians against microbial infection?[J].Cells,2016,5(3):E29
[8] Kim S,Coulombe PA.Intermediate filament scaffolds fulfill mechanical,organizational,and signaling functions in the cytoplasm[J].Genes Dev,2007,21(13):1581-1597.
[9] Toivola DM,Strnad P,Habtezion A,etal.Intermediate filaments take the heat as stress proteins[J].Trends Cell Biol,2010,20(2):79-91.
[10] Margiotta A,Bucci C.Role of intermediate filaments in vesicular traffic[J].Cells,2016,5(2):E20.
[11] Magin TM,Vijayaraj P,Leube RE.Structural and regulatory functions of keratins[J].Exp Cell Res,2007,313(10):2021-2032.
[12] Pastuszak M,Groszewski K,Pastuszak M,etal.Cytokeratins in gastroenterology.Systematic review[J].Prz Gastroenterol,2015,10(2):61-70.
[13] Moll R,Divo M,Langbein L.The human keratins:biology and pathology[J].Histochem Cell Biol,2008,129(6):705-733.
[14] Coch RA,Leube RE.Intermediate filaments and polarization in the intestinal epithelium[J].Cells,2016,5(3):E32.
[15] Homberg M,Magin TM.Beyond expectations:novel insights into epidermal keratin function and regulation[J].Int Rev Cell Mol Biol,2014,311:265-306.
[16] Mendez MG,Restle D,Janmey PA.Vimentin enhances cell elastic behavior and protects against compressive stress[J].Biophys J,2014,107(2):314-323.
[17] Seltmann K,Fritsch AW,Kaes JA,etal.Keratins significantly contribute to cell stiffness and impact invasive behavior[J].Proc Natl Acad Sci U S A,2013,110(46):18507-18512.
[18] Homberg M,Ramms L,Schwarz N,etal.Distinct impact of two keratin mutations causing epidermolysis bullosa simplex on keratinocyte adhesion and stiffness[J].J Invest Dermatol,2015,135(10):2437-2445.
[19] Omary MB,Coulombe PA,McLean WH.Intermediate filament proteins and their associated diseases[J].N Eng J Med,2004,351(20):2087-2100.
[20] Owens DW,Lane EB.Keratin mutations and intestinal pathology[J].J Pathol,2004,204(4):377-385.
[21] Hotz A,Oji V,Bourrat E,etal.Expanding the clinical and genetic spectrum of KRT1,KRT2 and KRT10 mutations in keratinopathic ichthyosis[J].Acta Derm Venereol,2016,96(4):473-478.
Cloning, prokaryotic expression and purification of human cytokeratin 1
WANG Bo1,2,3, HOU Weikun4, ZHOU Yan5, CAI Yongsong2, WANG Linyu1,3,ZHANG Ying6, HAN Yan2, MENG Liesu2*
(1CenterforTranslationalMedicine,FirstAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710061,China;2DepartmentofBiochemistryandMolecularBiology,SchoolofBasicMedicalSciences,Xi’anJiaotongUniversityHealthScienceCenter;3KeyLaboratoryforTumorPrecisionMedicineofShaanxiProvince;4OsteonecrosisandJointReconstructionWard,JointSurgery,Xi’anHonghuiHospital,Xi’anJiaotongUniversityHealthScienceCenter;5DepartmentofDermatology,FirstAffiliatedHospitalofXi’anJiaotongUniversity;6DepartmentofGastroenterology,FirstAffiliatedHospitalofXi’anJiaotongUniversity;*Correspondingauthor,E-mail:mengliesu@mail.xjtu.edu.cn)
ObjectiveTo clone and fusion human cytokeratin 1 in prokaryotic expression system, and purify and identify the fusion protein.MethodsThe cDNA fragment of human cytokeratin 1(NM_006121.3) was amplified from keratinocyte total RNA with specific primers. The PCR products and vector pET-28a were digested with restriction endonucleaseEcoRⅠ andHind Ⅲ. The digested PCR products were cloned into vector pET-28a with T4 DNA ligase, and then the fusion protein of his-CK1 was induced by isopropy-β-D-thiogalactoside(IPTG).The expressed fusion protein of his-CK1 was purified by nickel ion affinity chromatography,and identified by SDS-PAGE and Western blot.ResultsThe sequencing proved that the recombinant vector of CK1 was correct. The molecular mass of his-CK1 fusion protein was 70 kD, and it was highly expressed inE.coli. The fusion protein was insoluble in inclusion body, and this his-CK1 was highly purified(purity>90%) under denaturing conditions. The his-CK1 showed specific binding to the commercialization antibodies of CK1 and His.ConclusionThe recombinant vector of pET-28a-CK1 has been successfully constructed, and the fusion protein of his-CK1 has been successfully expressed and purified.
cytokeratin 1; gene cloning; fusion protein; prokaryotic expression system
国家自然科学基金资助项目(81273211);国家自然科学基金青年科学基金资助项目(81201373);陕西省社会发展科技攻关项目(2016SF-238);西安交通大学第一附属医院青年科学创新基金资助项目(2016QN-13)
王博,男,1987-12生,硕士,实习研究员,E-mail:realwbo@163.com
2016-11-30
Q785
A
1007-6611(2017)02-0114-06
10.13753/j.issn.1007-6611.2017.02.005

