进展性前列腺癌中mPGES-1及雄激素受体的表达及其意义
仲 冰, 马千云
(1南京医科大学附属淮安第一医院泌尿外科,淮安 223300; 2南京医科大学附属淮安第一医院消化内科; *通讯作者,E-mail:694689609@qq.com)
进展性前列腺癌中mPGES-1及雄激素受体的表达及其意义
仲 冰1, 马千云2*
(1南京医科大学附属淮安第一医院泌尿外科,淮安 223300;2南京医科大学附属淮安第一医院消化内科;*通讯作者,E-mail:694689609@qq.com)
目的 研究微粒体前列腺素E合成酶-1(mPGES-1)在进展性前列腺癌中的表达特征及其与雄激素的相关性,探讨mPGES-1高表达在进展前列腺癌中可能的临床意义。 方法 采用免疫组织化学法检测50例前列腺癌组织标本中mPGES-1和雄激素受体(androgen receptor, AR)蛋白表达水平;进行DU-145细胞培养,分别采用不同浓度(0,0.1,1 nmol/L)Testosterone对DU-145细胞进行干预,Western blot技术检测雄激素干预后的DU-145细胞中mPGES-1蛋白表达水平。 结果 50例前列腺癌标本中,mPGES-1阳性表达36例,阴性表达14例,阳性表达率为72%,AR阳性表达50例。mPGES-1和AR在前列腺癌中的表达与TNM分期、Gleason评分及骨转移相关(P<0.05),与血清PSA值无关(P>0.05),mPGES-1与AR在前列腺癌组织中表达无相关性(r=0.105,P=0.466);经不同浓度(0,0.1,1 nmol/L)Testosterone干预24 h后,DU-145细胞中的mPGES-1蛋白表达量显著上调(P<0.05)。 结论 雄激素对mPGES-1表达可能具有上调作用,mPGES-1及AR的表达强度与前列腺癌的分期及骨转移有关。mPGES-1的高表达提示前列腺预后差及可能存在骨转移。
前列腺癌; 膜结合型前列腺素E2合酶-1; 雄激素
前列腺癌(prostate cancer,Pca)是常见男性恶性肿瘤,在欧美地区的发病率仅次于肺癌,在我国其发病率和死亡率亦呈逐年升高,严重危害了男性健康。临床上20%的前列腺癌患者为临床进展性前列腺癌,侵袭转移能力强,很快进入晚期阶段,晚期患者多伴有排尿梗阻症状、骨转移。临床研究发现,骨骼是前列腺癌发生远处转移较常见的器官,但在早期前列腺癌常无明显的临床症状,确诊时常已进展为中、晚期,失去了最佳治疗时机。且目前诊断为晚期前列腺癌的患者,临床通常采取雄激素剥夺疗法,然而很多学者对此内分泌去势治疗提出质疑,认为此法会加速前列腺癌的进展,因此需要进一步探索前列腺癌发生、发展机制,寻找有效的靶点。体内、外研究表明,多种肿瘤细胞中前列腺素类物质尤其是前列腺素E2(prostaglandin E2)合成增加,而PGE2具有促进肿瘤细胞增殖、迁移,以及抑制肿瘤细胞凋亡和宿主免疫功能的能力[1]。前列腺素E2合酶(prostaglandin E2 synthase,PGES)是PGE2生物合成过程中位于COX-2下游的一种末端限速酶,可催化COX-2的产物PGH2转化成PGE2,它有三种类型,即胞质型前列腺素E2合酶(cytosolic PGE2 synthase,cPGES)、膜结合型前列腺素E2合酶1,2(microsomal prostaglandin E synthase1,2,mPGES1,2)。其中mPGES-1为一种诱导酶,在肿瘤发生、发展中发挥重要作用,被证实在多种不同类型的肿瘤中均呈现高表达,可对肿瘤细胞的增殖、迁移、凋亡等发挥重要的调控作用[2]。其在前列腺癌中的研究亦逐渐引起了人们的关注,本研究拟收集不同时期的前列腺癌患者的临床资料及病理资料,采用免疫组化方法研究mPGES-1及AR在前列腺癌组织中的表达特征及相互关系,并进行DU-145细胞培养,采用不同浓度睾酮(testosterone)干预DU-145,Western blot技术检测干预后mPGES-1蛋白表达水平,观察雄激素对mPGES-1的影响。
1 资料和方法
1.1 一般资料
收集南京医科大学附属淮安第一医院2010-01~2014-12间住院治疗的50例前列腺癌组织标本,年龄54-88岁,平均72.7岁。
病理组织来源经直肠前列腺穿刺活检术14例、经尿道前列腺电切术24例、前列腺癌根治术12例,病理均为前列腺癌,术前均未行放化疗及内分泌治疗,结合经直肠超声检查、CT、核磁共振和同位素全身骨显像扫描确定临床分期,其中,TNM分期(ACJJ,2002)Ⅰ、Ⅱ期18例,Ⅲ、Ⅳ期32例;骨转移25例,未骨转移25例;术后病理Gleason评分≤7分17例,Gleason评分>7分33例;血清PSA>20 ng/ml 32例,PSA≤20 ng/ml 18例。根据血PSA、Gleason评分和临床分期将前列腺癌分为低中、高危二类,以指导临床治疗和判断预后。中低危:PSA≤20 ng/ml,Gleason评分≤7,临床分期T2b;高危:血清PSA>20 ng/ml,Gleason评分>7,临床分期≥T2C。
组织标本经包埋后,切片,HE染色,由两位病理科医师阅片诊断。细胞株:DU-145人雄激素非依赖性前列腺癌细胞。
1.2 主要试剂
兔抗-雄激素抗体(丹麦Dako公司)、兔抗-mPGES-1抗体(Cayman公司,产品号:160140,)、Testosterone(Sigma公司,产品号:T1500,MW:288.42,CAS号: 58-22-0)、兔抗-β-actin:内参(Bioworld公司, 产品号: AP0060)
1.3 免疫组织化学检测mPGES-1及AR的表达
常规玻片脱蜡;水化;抗原修复:加入800-1 500 ml柠檬酸钠缓冲液(pH6.0±0.1)于压力锅中,电炉加热至沸腾。脱蜡水化后的组织切片放入已沸腾的缓冲液中加热至喷气,从喷气开始记时,1.5 min后压力锅离开热源,自然冷却至室温;阻断:每张切片加1滴过氧化氢阻断溶液,室温下孵育10 min;封闭:每张切片加1滴正常非免疫羊血清,室温下孵育10 min,甩去血清,每张切片加l滴一抗,在37 ℃恒温箱内孵育2 h,每张切片加l滴二抗,室温下孵育10 min,每张切片加1滴链霉菌抗生物素-过氧化物酶溶液,室温下孵育10 min;DAB溶液染色5 min;苏木素复染;脱水:75%,85%,95%,100%酒精脱水各3 min;透明:二甲苯透明2次,每次3 min;中性树胶封片。
1.4 Western blot检测mPGES-1的表达
蛋白提取:取对数期生长的DU-145细胞,调整细胞密度为7×104/ml,分三组:无血清培养组(serum-free medium,SF)、0.1 nmol/L组、1 nmol/L组。培养24 h后,收集细胞,将蛋白样品与上样缓冲液混合,100 ℃加热5 min,离心5 min,取上清加样后进行蛋白电泳;免疫印迹,电泳:10%SDS-PAGE电泳,电泳条件为初始电压40 mV(30 min),待样品进入分离胶后,电压增至80 mV,直至电泳结束。转膜:用硝酸纤维素膜进行转膜,按恒流200 mA通电,电转移30 min;封闭:膜与封闭液孵育,孵2 h;免疫杂交:Blot缓冲液洗膜10 min×3次,加mPGES-1一抗,摇床摇荡孵育1 h(4 ℃,过夜)。弃液体,Blot缓冲液洗膜10 min×3次,加二抗,室温下摇荡孵育2 h;ECL发光及显影:弃液体,Blot缓冲液洗膜10 min×3次,加发光底物ECL,显色3 min,于暗房内压片,显影。
1.5 结果判定
使用LOGENE-1医用高清晰图像处理系统软件进行分析mPGES-1定位在细胞核,凡细胞核中出现明显的棕黄色颗粒者为阳性细胞。在每个标本上、下、左、右、中各随机选取一个400倍视野,观察、计算阳性细胞数,计算总细胞数不少于1 000个。倒置显微镜下计数不少于1 000个细胞中mPGES-1比例,采用双评分半定量积分法进行评分(见表1):A表示靶细胞阳性表达率,B表示靶细胞表达强度,每个视野的染色得分为靶细胞阳性表达率A与表达强度B得分的和,即为积分光密度(integral optical density,IOD)。将两种评价结果数值相加,综合结果判定:-(0或1分),+(2分),++(3分或4分)和+++(5分)。AR的实验方法同上。采用凝胶图像处理系统对胶片图像进行灰度扫描,分析目标带的净光密度值。
表1 双评分半定量积分法评分标准
Table 1 Score criterion of semi-quantitative analysis

评分靶细胞阳性表达率(A)靶细胞表达强度(B)0分<10%无阳性信号,靶细胞无着色1分10%-40%阳性信号较弱,靶细胞染色呈黄色2分40%-70%阳性信号中等,靶细胞染色呈棕黄褐色,粗颗粒状3分>70% -
1.6 统计学分析
2 结果
2.1 mPGES-1在不同前列腺组织中的表达
mPGES-1阳性表现为细胞质黄褐色染色,50例前列腺癌标本中,阳性表达36例,阴性表达14例,阳性表达率为72.0%。AR阳性表现为细胞质棕黄色染色,阳性表达50例。mPGES-1及AR在骨转移患者前列腺癌组织及未骨转移患者前列腺癌组织中的IOD值有统计学差异(P<0.05,见表2);mPGES-1及AR IOD值在前列腺癌不同临床TNM分期、Gleason评分间存在统计学差异(P<0.05),mPGES-1及AR IOD值在PSA>20 ng/ml和PSA≤20 ng/ml两组间无统计学差异(P>0.05,见表3),mPGES-1与AR在前列腺癌组织中无相关性(r=0.105,P=0.466)。
表2 mPGES-1和AR的表达和前列腺癌骨转移的关系 (n=25)
Table 2 Relationship between the expression of mPGES-1 and AR and bone metastases in prostate cancer (n=25)

组别mPGES⁃1IODARIODtP骨转移组3.4118±1.91154.9412±1.24853.3490.002未骨转移组1.7368±2.07743.7895±1.54843.961<0.001 t2.9672.895 P0.0050.006
表3 mPGES-1和AR的表达与前列腺癌临床指标的关系
Table 3 Relationship between the expression of mPGES-1 and AR and clinicopathological features of prostate cancer
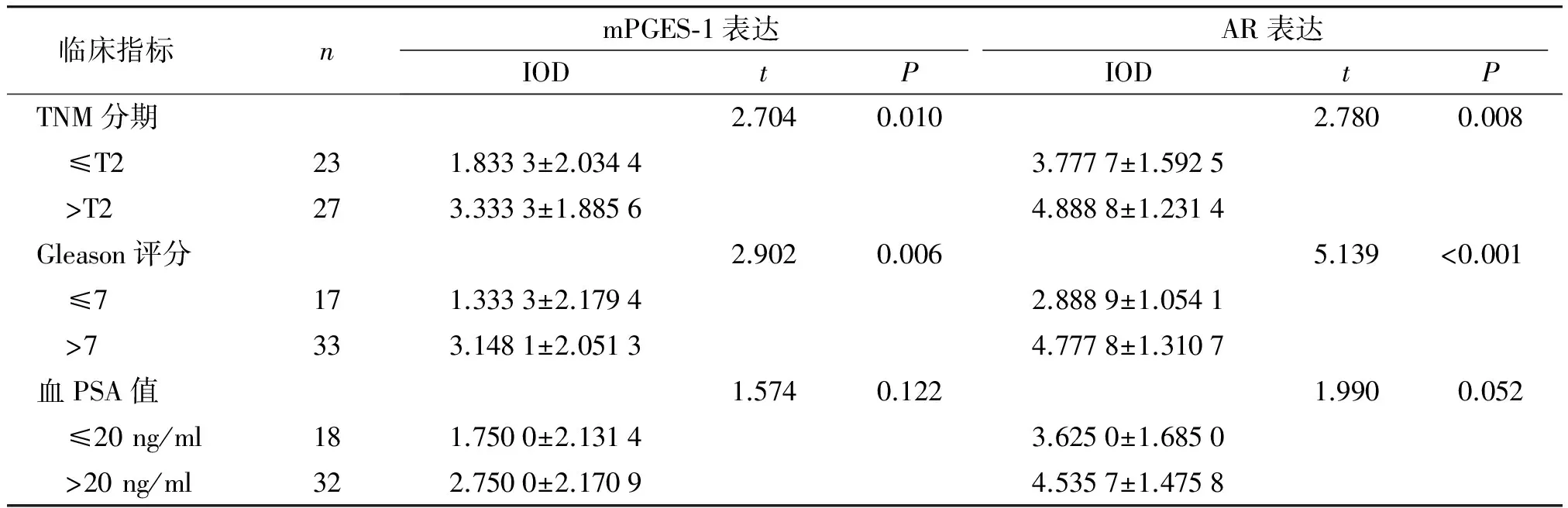
临床指标 nmPGES⁃1表达AR表达IODtPIODtPTNM分期2.7040.0102.7800.008 ≤T2231.8333±2.03443.7777±1.5925 >T2273.3333±1.88564.8888±1.2314Gleason评分2.9020.0065.139<0.001 ≤7171.3333±2.17942.8889±1.0541 >7333.1481±2.05134.7778±1.3107血PSA值1.5740.1221.9900.052 ≤20ng/ml181.7500±2.13143.6250±1.6850 >20ng/ml322.7500±2.17094.5357±1.4758
2.2 经不同浓度睾酮干预后DU-145细胞中mPGES-1的表达
DU-145细胞经不同浓度(0,0.1,1 nmol/L)Testosterone干预24 h后,Western blot检测mPGES-1蛋白结果见图2A。Western blot灰度统计分析:与对照组相比,加入testosterone干预后mPGES-1蛋白表达量升高,有统计学差异(P<0.05),与0.1 nmol/L组相比,1 nmol/L组mPGES-1蛋白表达量升高,有统计学差异(P<0.05,见图2B)。
3 讨论

图1 mPGES-1和AR的在前列腺癌中的表达 (×200)Figure 1 Expression of mPGES-1 and AR in prostate cancer tissues (×200)
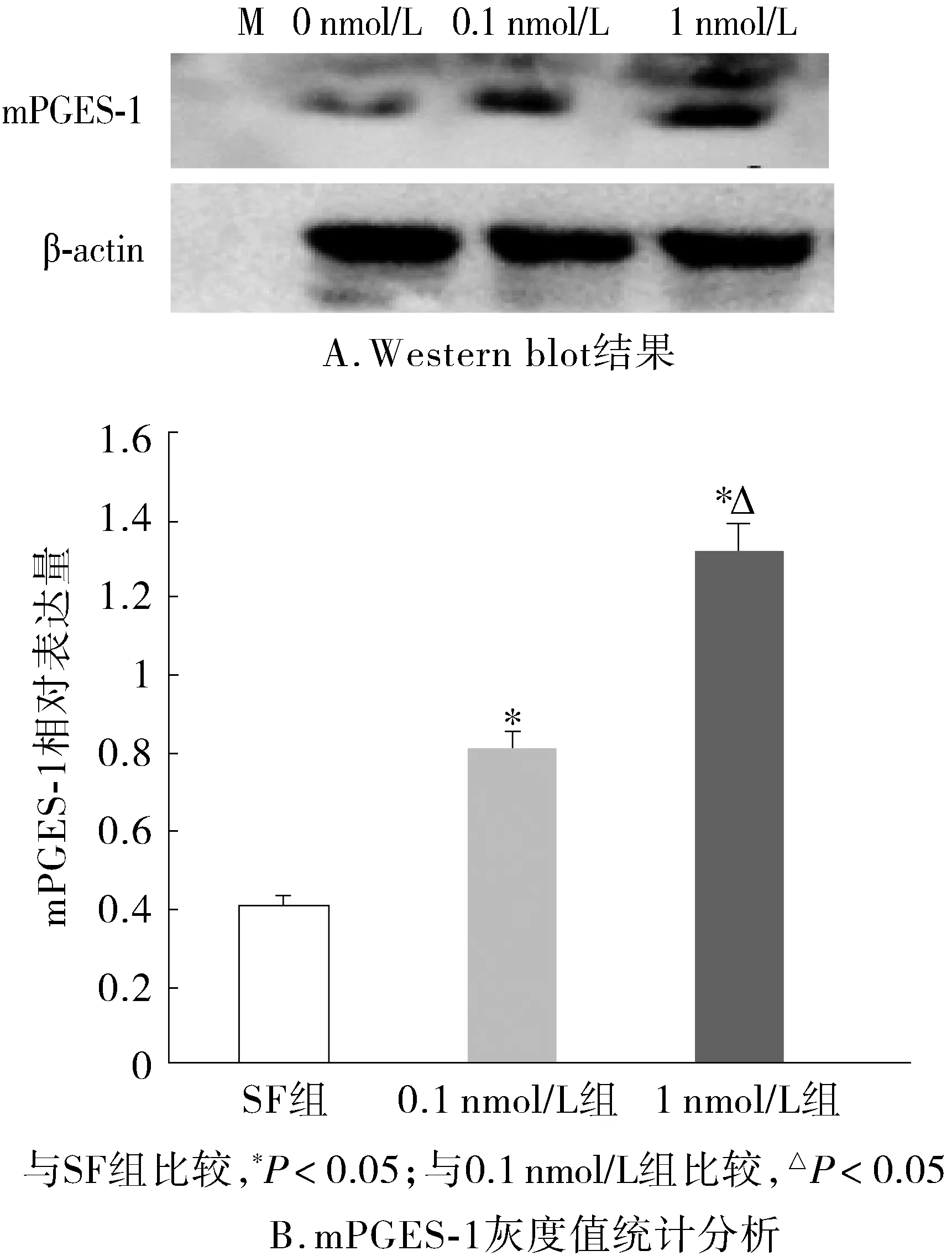
图2 Western blot检测DU-145细胞中mPGES-1蛋白的表达量Figure 2 Western blot analysis for microsomal prostaglandin E synthase-1 in DU-145 cells
前列腺癌是男性常见的恶性肿瘤之一,其发病率居全球男性癌症发病率的第3位,死亡率第6位。根据资料显示,前列腺癌发病率和死亡率存在明显的地区差异,美国、北欧、西欧和澳洲是前列腺癌的高发地区,而亚洲和北非是相对低发地区。但前列腺癌低发地区从20世纪70年代起发病率也有大幅度上升的趋势。与发达国家相比,中国仍是前列腺癌低发国家,但随着人口老龄化及生活条件的改善,近年来前列腺癌的发病率呈明显的上升趋势。
mPGES-1为作为诱导酶,受多种刺激因子的调节,目前对mPGES-1的表达调节还未形成系统的认识,炎性反应和促有丝分裂等刺激因子可激活mPGES-1,在炎性反应和肿瘤模型中mPGES-1的表达上调。mPGES-1不仅参与机体的炎症反应,导致发热、疼痛,而且与癌症的发生发展中起发挥重要作用。研究表明,mPGES1在肝癌、肺癌、结肠癌、胃癌肿瘤中均高表达[3-6],与癌细胞的增殖、迁移、侵袭力密切相关,mPGES-1高表达与胃癌的淋巴结状态及肿瘤复发有明显相关性[5]。Lu等[7]发现,mPGES1在胆管癌组织中呈高表达,可促进癌细胞的增殖,增强其侵袭力,采用RNA干扰技术下调mPGES-1表达,可抑制肿瘤的生长;Kawata等[8]发现,mPGES-1在头颈部鳞状细胞癌扩散中发挥重要作用;Kamei等[9]使用siRNA技术沉默Lewis肺癌细胞mPGES-1基因后,细胞增殖能力降低,细胞外基质黏附力增加;钱铭等[10]发现,阻断mPGES-1可促进前列腺癌细胞的凋亡。Takahashi等[11]及Finetti等[12]研究提示mPGES-1在前列腺癌转移中发挥重要作用,mPGES-1抑制剂可能有助于预防前列腺癌转移。
mPGES-1在前列腺癌组织中同样存在过表达现象。许多癌症的临床研究中发现,mPGES-1在一些肿瘤的中表达与淋巴结转移有关。mPGES-1的高表达与肿瘤的预后及临床病理学因素相关。本试验采用免疫组织化学法检测mPGES-1在前列腺癌的表达特征,结果显示:mPGES-1蛋白在前列腺癌中过表达,在骨转移前列腺癌组织中mPGES-1蛋白的表达高于未骨转移前列腺癌组织,骨转移组的mPGES-1阳性率明显高于未骨转移组,提示mPGES-1在前列腺癌骨转移中发挥作用,另mPGES-1阳性表达率在前列腺癌不同临床TNM分期、Gleason评分间的差异存在统计学意义,但与血PSA值无关,随着前列腺癌的进展,mPGES-1的表达进一步增加。与血PSA无相关性的结论与Xu等[13]的研究结果不一致,考虑可能因本组例数较少,且血PSA的选择指标标准不同,这还有待大样本更深入的研究探讨。
雄激素受体(androgen receptor,AR)在前列腺癌的发生、发展和转移过程中起着重要作用。本试验结果显示,AR在前列腺癌中过表达,前列腺癌患者前列腺组织AR表达随Gleason评分的增高及临床分期的进展而增强,与PSA值无明显相关性,在骨转移患者前列腺癌组织中AR的表达高于未骨转移前列腺癌组织AR的表达,这与富翔鹏等[14]、姜涛等[15]的研究结果基本一致,他们认为临床分期D期前列腺癌组织AR阳性表达程度显著增强,低分化前列腺癌(Gleason评分>7)AR阳性表达程度显著增强。也有研究表明[16],早期前列腺癌组织的AR阳性表达高于晚期,高、中分化癌的AR阳性表达高于低分化癌,AR的表达与肿瘤的分期、分级成负相关。AR在前列腺癌中表达及其与前列腺癌分期、分级的关系众说纷纭,研究结果不一致。
上述研究均表明,雄激素及mPGES-1之间可能存在某种联系,本课题进行DU-145细胞中的研究提示雄激素可以上调mPGES-1的表达,受限制于研究时间等因素,本实验仍存在很多不足,如没有对通路检测,这有待进一步研究。本研究通过对前列腺癌组织的免疫组化研究,提示mPGES-1及AR在前列腺癌的发生、发展中具有重要作用,mPGES-1可作为判断前列腺癌分化程度,分级和预后的重要指标,在DU-145细胞中的研究提示雄激素可以上调mPGES-1,从而造成前列腺癌的进展,选择性抑制mPGES-1表达可能为治疗进展性前列腺癌的一个新靶点。
[1] Greenhough A,Smartt HJ,Moore AE,etal.The COX-2/PGE2 pathway:key roles in the hallmarks of cancer and adaptation to the tumour microenvironment[J].Carcinogenesis,2009,30(3):377-386.
[2] Nakanishi M,Gokhale V,Meuillet EJ,etal.mPGES-1 as a target for cancer suppression:a comprehensive invited review “phospholipase A2 and lipid mediators”[J].Biochimie,2010,92(6):660-664.
[3] Zang S,Ni M,Lian Y,etal.Expression of microsomal prostaglandin E2 synthase-1 and its role in human hepatocellular carcinoma[J].Hum Pathol,2013,44(8):1681-1687.
[4] Xue X,Shah YM.Hypoxia-inducible factor-2α is essential in activating the COX2/mPGES-1/PGE2 signaling axis in colon cancer[J].Carcinogenesis,2013,34(1):163-169.
[5] Gudis K,Tatsuguchi A,Wada K,etal.Clinical significance of prostaglandin E synthase expression in gastric cancer tissue[J].Hum Pathol,2007,38(12):1826-1835.
[6] 帅萍,肖秋香.肺癌组织中胞浆型磷脂酶A2和前列腺素E2合酶-1的表达及其临床病例参数的关系[J].中国老年学杂志,2016,36(5):2415-2416.
[7] Lu D,Han C,Wu T.Microsomal prostaglandin E synthase-1 inhibits PTEN and promotes experimental cholangiocarcinogenesis and tumor progression[J].Gastroenterology,2011,140(7):2084-2094.
[8] Kawata R,Hyo S,Araki M,etal.Expression of cyclooxygenase-2 and microsomal prostagalandin E synthase-1 in head and neck squamous cell carcinoma[J].Auris Nasus Larynx,2010,37(4):482-487.
[9] Kamei D,Murakami M,Sasaki Y,etal.Microsomal prostaglandin E synthase-1 in both cancer cells and hosts contributes to tumour growth,invasion and metastasis[J].Biochem J,2009,425(2):361-371.
[10] 钱铭,许露伟,许衍超,等.mPGES-1对激素非依赖性前列腺癌细胞Beclin-1表达的影响及其意义[J].中华实验外科杂志,2011,28(12):2040-2042.
[11] Takahashi R,Amano H,Satoh T,etal.Roles of microsomal prostaglandin E synthase-1 in lung metastasis formation in prostate cancer RM9 cells[J].Biomed Pharmacother,2014,68(1):71-77.
[12] Finetti F,Terzuoli E,Giachetti A,etal.mPGES-1 in prostate cancer controls stemness and amplifies epidermal growth factor receptor-driven oncogenicity[J].Endocr Relat Cancer,2015,22(4):665-678.
[13] Xu LW,Qian M,Jia RP,etal.Expression and significance of microsomal prostaglandin synthase-1(mPGES-1) and beclin-1 in the development of prostate cancer[J].Asian Pac J Cancer Prev,2012,13(4):1639-1644.
[14] 富翔鹏,曹余光.前列腺癌患者前列腺与睾丸组织中AR表达相关性[J].中国医学工程,2012,19(6):29-32.
[15] 姜涛,李先承,宋希双.雄激素受体在前列腺癌中表达和意义的探讨[J].中国男科学杂志,2005,9(6):29-32.
[16] 唐显力,邓远忠,刘朝东,等.Ebp1、雄激素受体在前列腺癌中表达及相关性研究.重庆医科大学学报,2012,37(11):953-956.
Expression of mPGES-1 and AR in progressive prostate cancer and its significance
ZHONG Bing1,MA Qianyun2*
(1DepartmentofUrinarySurgery,Huai’anFirstPeople’sHospital,NanjingMedicalUniversity,Huai’an223300,China;2DepartmentofGastroenterology,Huai’anFirstPeople’sHospital,NanjingMedicalUniversity;*Correspondingauthor,E-mail: 694689609@qq.com)
ObjectiveTo investigate the expression and its significance of microsomal prostaglandin E synthase-1(mPGES-1) and androgen receptor(AR) in progressive prostate cancer and their correlations.MethodsThe expression of mPGES-1 and AR was detected in 50 cases of prostate cancer tissues by immunohistochemistry.DU-145 cells were treated with various concentrations(0,0.1,1 nmol/L) of testosterone.The effect of testosterone on the expression of mPGES-1 in DU-145 cells was studied using Western blot.ResultsThe mPGES-1 was found positive in 36 of 50 cases(72.0%) in prostate cancer tissues, and AR was found positive in 50 cases(100.0%) of prostate cancer tissues. The expression of mPGES-1 and AR in prostate cancer tissues was associated with the TNM stages, Gleason grade and bone metastases(P<0.05), but not correlated with total prostate specific antigen(PSA)(P>0.05). There was no significant correlation between mPGES-1 and AR expression in prostate cancer tissues(r=0.105,P=0.466). After treatment with different concentrations(0,0.1,1 nmol/L) of testosterone for 24 h, the expression of mPGES-1 was up-regulated(P<0.05).ConclusionTestosterone could up-regulate the expression of mPGES-1. The over-expression of mPGES-1 and AR is associated with the tumor stages and bone metastases in prostate cancer, and the high expression of mPGES-1 may predict the poor prognosis of prostate cancer and bone metastases.
prostate cancer; microsomal prostaglandin E synthase-1; androgen receptor
仲冰,男,1988-01生,在读博士,住院医师,E-mail:15152569186@163.com
2016-11-09
R737.25
A
1007-6611(2017)02-0124-05
10.13753/j.issn.1007-6611.2017.02.007

