新疆地区汉族、维吾尔族帕金森病患者中血清免疫球蛋白、补体水平的临床研究
王鹏飞, 蒋 森, 杨新玲, 高 华, 罗 琴
(1新疆医科大学第一附属医院神经内科,乌鲁木齐 830011;2新疆医科大学第一附属医院;3新疆医科大学第五附属医院神经内科;4新疆医科大学附属肿瘤医院干部病房;*通讯作者,E-mail: poplar862@sohu.com)
新疆地区汉族、维吾尔族帕金森病患者中血清免疫球蛋白、补体水平的临床研究
王鹏飞1, 蒋 森1, 杨新玲2*, 高 华3, 罗 琴4
(1新疆医科大学第一附属医院神经内科,乌鲁木齐 830011;2新疆医科大学第一附属医院;3新疆医科大学第五附属医院神经内科;4新疆医科大学附属肿瘤医院干部病房;*通讯作者,E-mail: poplar862@sohu.com)
目的 探讨新疆汉族、维吾尔族帕金森病(PD)患者血清中免疫球蛋白(IgG、IgA、IgM)及补体(C3、C4)水平是否具有差异。 方法 选择104例原发性帕金森病患者(PD组),其中汉族64例,维吾尔族40例;选择135例健康体检者为对照组,其中汉族84例,维吾尔族51例。采用特种蛋白分析仪检测血清中免疫球蛋白(IgG、IgA、IgM)及补体(C3、C4)的水平,分析汉族、维吾尔族PD患者的血清免疫球蛋白(IgG、IgA、IgM)、补体水平(C3、C4)是否存在差异及其与PD的关系。 结果 PD组IgG值高于对照组(P<0.05)。维吾尔族PD组IgA值高于维吾尔族对照组(P<0.05)。汉族PD组与汉族对照组IgG、IgA、IgM、C3、C4值差异均无统计学意义(P>0.05),汉族PD与维族PD组各指标差异也无统计学意义(P>0.05)。将与总体PD相关的5个因素(IgG、IgA、IgM、C3、C4)进行Logistic回归分析提示,血清IgG每增加1个单位,PD的发生风险增加1.675倍(P=0.007,OR=1.675)。进一步将与汉族PD相关的5个因素(IgG、IgA、IgM、C3、C4)进行Logistic回归分析提示,血清IgG每增加1个单位,汉族PD的发生风险增加2.096倍(P=0.029,OR=2.096);但血清IgG水平与维族PD无关。 结论 PD患者IgG值高于正常人;维吾尔族PD患者IgA值高于正常维吾尔族人;IgG可能是汉族PD的危险因素。
帕金森病; IgG; gA; IgM; C3; C4
帕金森病(Parkinson’s disease,PD),是一种在老年人中常见的神经系统变性疾病,主要临床表现为静止性震颤、肌强直、运动迟缓、姿势步态异常等。目前病因及发病机制尚不明确。现有研究表明,PD发生发展与免疫炎症机制密切相关[1-4],PD患者的免疫球蛋白(IgG、IgA、IgM)及补体(C3、C4)水平可能与PD有相关性[5-9]。本研究对2015-09~2016-06新疆医科大学第一附属医院神经内科门诊及其住院病区收治的PD患者筛选出104例。研究新疆汉族、维吾尔族PD患者血清免疫球蛋白(IgG、IgA、IgM)及补体(C3、C4)水平是否具有差异及其与PD发病的关联,探索新疆地区不同民族间PD发病相关的免疫学机制。
1 对象与方法
1.1 对象
选择2015-09~2016-06就诊于新疆医科大学第一附属医院神经内科就诊的汉族及维吾尔族PD患者(由我院PD专家小组依据中华医学会神经病学分会运动障碍及帕金森病学组制订的中国帕金森病的诊断标准确诊)104例(PD组),同时选择体检中心进行体检的135例性别、年龄和族别相匹配的健康体检者(对照组)。均符合中华医学会神经病学分会运动障碍与PD学组制订的PD诊断标准,并行头颅MRI或CT检查,排除继发性帕金森综合征和伴发帕金森病表现的其他神经变性疾病。
PD组排除标准:①不符合诊断或纳入标准者。②排除近期发热和血常规示白细胞计数异常的近期感染者。③排除患有免疫系统疾病的患者。④排除长期慢性感染者。⑤排除近1个月内使用抗生素和(或)应用非甾体类抗炎药及免疫抑制剂者。⑥排除近期外伤及手术的患者;排除肝肾功能异常者及严重心脏疾病者。⑦排除恶性肿瘤患者。
1.2 方法
1.2.1 血清免疫球蛋白(IgG、IgA、IgM)及补体(C3、C4)检测 使用BD真空促凝采血管,清晨空腹抽取静脉血3 ml,1 h内,4 ℃、3 000 r/min,离心10 min,取血清。使用德国罗氏诊断有限公司的全自动生化免疫分析仪检测血清中IgG、IgA、IgM、C3、C4浓度水平,机器型号:cobas 8000。正常标准浓度:IgG(8.0-16.0 g/L)、IgA(0.7-3.3 g/L)、IgM(0.5-2.2 g/L)、C3(0.8-1.6 g/L)、C4(0.1-0.4g/L)。
1.2.2 实验分组 入选对象分为PD组与对照组, PD组与对照组按族别分为汉族PD组、维族PD组、汉族对照组、维族对照组,分别进行PD组与对照组间及不同种族间的比较。
1.3 统计学处理
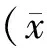
2 结果
2.1 一般资料比较
PD组和对照组比较PD患者104例,汉族64例,维吾尔族40例,男性53例,女性51例,平均年龄(67.6±8.3)岁;健康体检者135例,汉族84例,维吾尔族51例,男性73例,女性62例,平均年龄(64.1±9.7)岁。年龄、性别、民族构成差异均无统计学意义(P>0.05,见表1)。
表1 一般资料比较
Table 1 Characteristics of all subjects
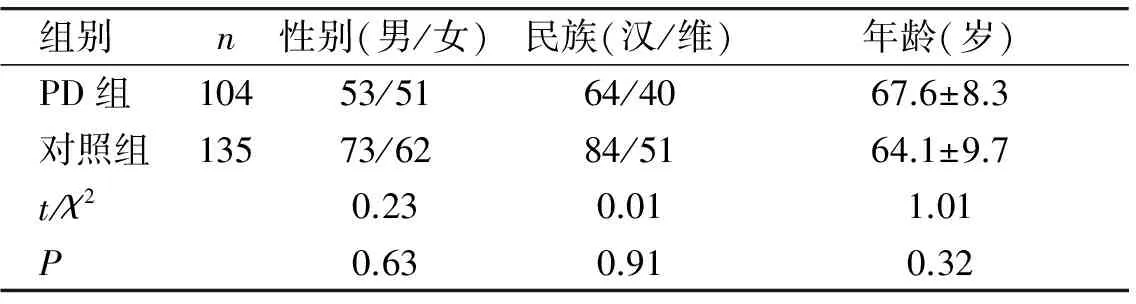
组别 n性别(男/女)民族(汉/维)年龄(岁)PD组10453/5164/4067.6±8.3对照组13573/6284/5164.1±9.7t/χ20.230.011.01P0.630.910.32
2.2 PD组与对照组各项免疫球蛋白及C3、C4比较
PD组IgG值高于对照组,差异具有统计学意义(t=2.18,P=0.03),PD组与对照组IgA、IgM、C3、C4值比较差异均无统计学意义(P>0.05,见表2)。
2.3 四组血清IgG、IgA、IgM、C3、C4的比较
汉族PD组与汉族对照组IgG、IgA、IgM、C3、C4值差异无统计学意义(P>0.05,见表3)。维吾尔族PD组IgA值高于对照组,差异具有统计学意义(t=2.56,P=0.02,见表3)。汉族PD组与维吾尔族PD组IgG、IgA、IgM、C3、C4值差异无统计学意义(P>0.05,见表3)。


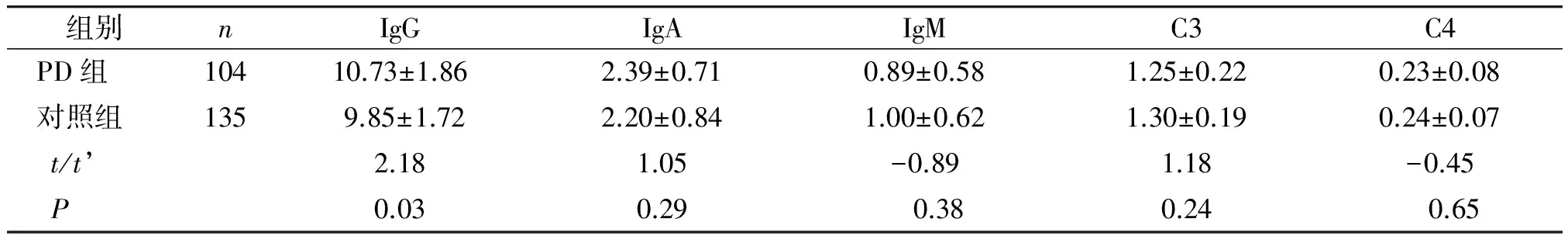
组别nIgGIgAIgMC3C4PD组10410.73±1.862.39±0.710.89±0.581.25±0.220.23±0.08对照组1359.85±1.722.20±0.841.00±0.621.30±0.190.24±0.07t/t’2.181.05-0.891.18-0.45P0.030.29 0.380.24 0.65


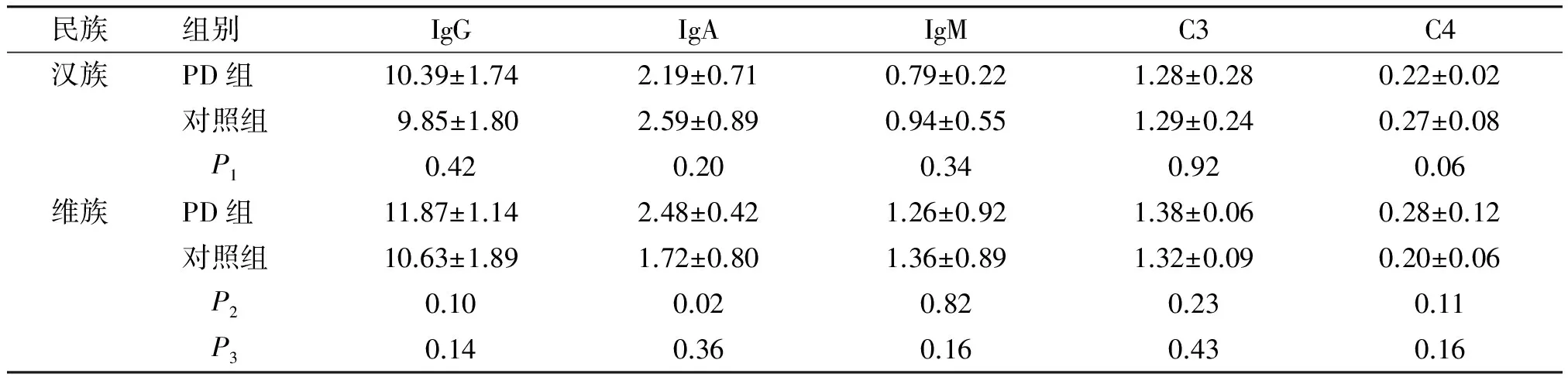
民族组别IgGIgAIgMC3C4汉族PD组10.39±1.742.19±0.710.79±0.221.28±0.280.22±0.02对照组9.85±1.802.59±0.890.94±0.551.29±0.240.27±0.08 P10.420.200.340.920.06维族PD组11.87±1.142.48±0.421.26±0.921.38±0.060.28±0.12对照组10.63±1.891.72±0.801.36±0.891.32±0.090.20±0.06 P20.100.020.820.230.11 P30.140.360.160.430.16
P1为汉族PD与对照比较,P2为维族PD与对照比较,P3为汉族PD与维族PD比较
2.4 影响总体PD的多因素Logistic回归分析结果
将5个因素(IgG、IgA、IgM、C3、C4)与总体PD进行Logistic回归分析,结果显示:血清IgG差异有统计学意义(P=0.007,OR=1.675,95%CI 1.154-2.431),提示血清IgG每增加1个单位(g/L),PD的发生风险增加1.675倍,而IgA、IgM、C3、C4与 PD均无关联(见表4)。
2.5 影响汉族PD的多因素Logistic回归分析结果
将与汉族PD相关的5个因素(IgG、IgA、IgM、C3、C4)进行Logistic回归分析,结果显示:血清IgG差异有统计学意义(P=0.029,OR=2.096,95%CI 1.081-4.065),提示血清IgG每增加1个单位(g/L),汉族PD的发生风险增加2.096倍,而IgA、IgM、C3、C4与汉族PD均无关联(见表5)。
表4 影响总体PD的多因素Logistic回归分析结果
Table 4 Multivariate Logistic regression analysis on the influence of PD
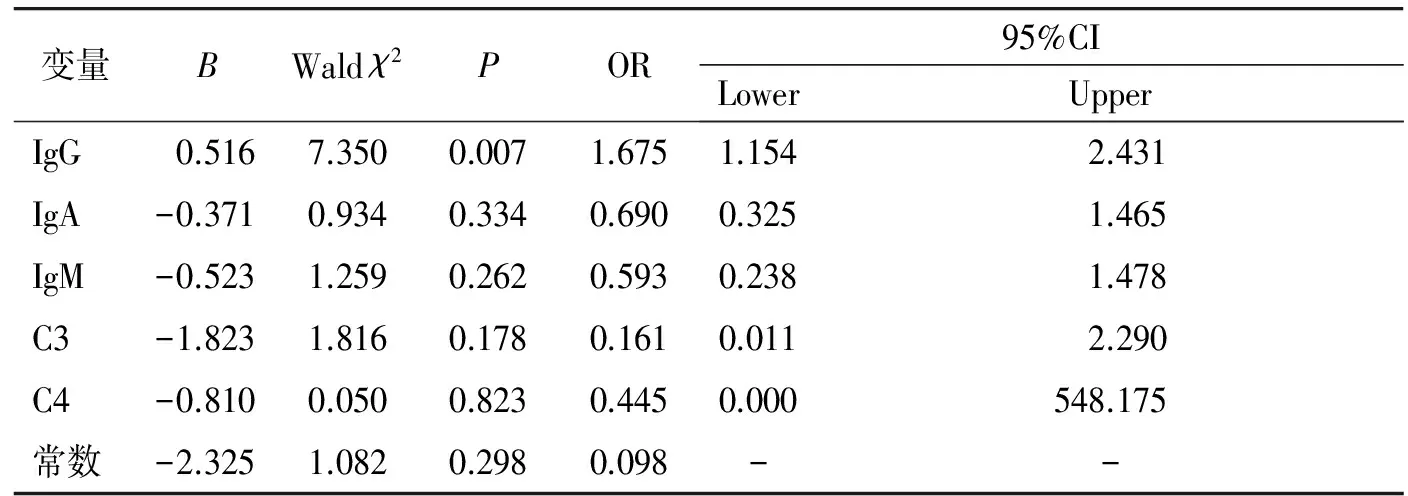
变量BWaldχ2POR95%CILowerUpperIgG0.5167.3500.0071.6751.154 2.431IgA-0.3710.9340.3340.6900.3251.465IgM-0.5231.2590.2620.5930.2381.478C3-1.8231.8160.1780.1610.0112.290C4-0.8100.0500.8230.4450.000548.175常数-2.3251.0820.2980.098--
2.6 影响维吾尔族PD的多因素Logistic回归分析结果
将与维吾尔族PD相关的5个因素(IgG、IgA、IgM、C3、C4)进行Logistic回归分析,结果显示:IgG、IgA、IgM、C3、C4与维吾尔族PD均无关联(P>0.05,见表6)。
表5 影响汉族PD的多因素Logistic回归分析结果
Table 5 Multivariate Logistic regression analysis on the influence of PD in Han

变量BWaldχ2POR95%CILowerUpperIgG0.7404.7940.0292.0961.0814.065IgA1.4993.5040.0610.2230.0471.073IgM0.8770.1450.7032.4030.026218.907C3-1.9570.3350.5630.1410.000106.870C422.0242.6910.1013.671E9 0.0149.831E20 常数5.1200.8410.359167.310--
表6 影响维族PD的多因素Logistic回归分析结果
Table 6 Multivariate Logistic regression analysis on the influence of PD in Uygur
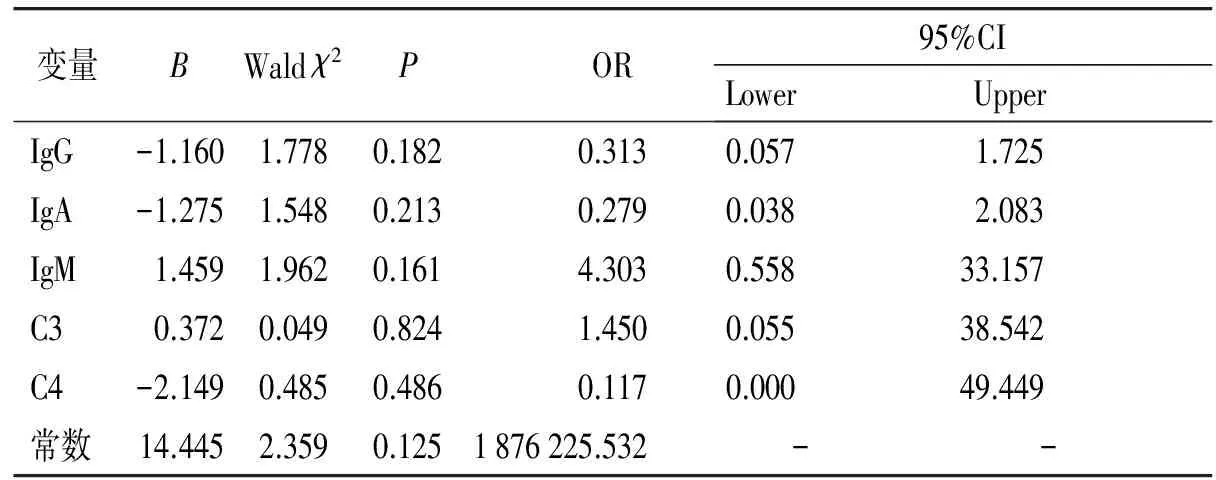
变量BWaldχ2P OR95%CILowerUpperIgG-1.1601.7780.182 0.3130.0571.725IgA-1.2751.5480.2130.2790.0382.083IgM1.4591.9620.1614.3030.55833.157C30.3720.0490.8241.4500.05538.542C4-2.1490.4850.4860.1170.00049.449常数14.4452.3590.1251876225.532 - -
3 讨论
PD是神经内科仅次于阿尔茨海默病(Alzheimer disease,AD)的第二大常见神经退行性疾病,随着人口老龄化,患病率与发病率在全球范围内呈现出明显增长趋势。目前为止,PD的病因尚未明确,现有的抗PD治疗还无法逆转或改变PD的病程进展。因此,明确PD病因及发病机制以期协助临床治疗已成为PD研究的核心问题,关于PD的病因及发病机制国内外有多种学说[10],近些年来,免疫炎症机制参与PD的发病成为研究的热点之一[11-12]。
Papuc等[13]研究发现,PD患者血清IgG水平高于正常人群,提示IgG可能参与PD的发生和发展。本研究发现新疆地区PD患者血清IgG水平高于正常人群,差异具有统计学意义(t=2.18,P=0.03),与上述研究结果类似。汪锡金等[14]的研究发现PD IgG依赖补体且通过补体激活的方式,使原代中脑神经元-胶质细胞培养体系的黑质酪氨酸羟化酶(TH)阳性神经元数量减少,突起减少和缩短,说明PD IgG依赖补体且通过补体激活的方式引起多巴胺(DA)能神经元相对特异性损伤,并且还发现只有PD IgG能引起DA能神经元相对特异性损伤,正常人IgG即使在补体存在的情况下,也不会对黑质TH阳性神经元产生影响,提示了PD IgG参与PD发病的可能机制。另外,他的研究还观察到PD IgG的剂量越增加,对DA能神经元的毒性作用越大。本研究通过Logistic回归分析发现血清IgG差异有统计学意义(P=0.007,OR=1.675,95%CI 1.154-2.431),提示血清IgG每增加1个单位(1 g/L),PD的发生风险增加1.675倍,血清IgG可能是PD的危险因素,但是IgA、IgM、C3、C4、性别与PD均无关联(虽然在汉族、维族Logistic回归分析中分别可见OR值分别为2.403、4.303,均>1,但差异无统计学意义)。目前PD诊断仍以临床表现作为主要诊断依据[15],缺少特异性较高的血清标记物[16,17],希望本研究结果能为此提供依据。
本研究发现维吾尔族PD组IgA值高于对照组,差异具有统计学意义(t=2.56,P=0.02),与Hoffman等[18]的研究发现关岛PD患者血清IgA值高于正常人结果相似,但是何汲等[19]研究发现PD患者血清IgA低于正常人。Hoffman等[20]的另一项研究发现,在关岛人群中血清IgA水平随着年龄而增长,血清IgG水平不变。血清IgA、IgM水平易受多种因素影响,日常运动水平、情绪变化以及免疫系统疾病都可造成IgA、IgM水平的不稳定性[21,22]。PD患者中可能存在非单纯的运动症状,也可能导致IgA、IgM水平的波动,另一方面年龄、地域环境,或初始入选标准等因素也可能导致各种研究结果的不一致性。
因此我们猜测,本实验结果与以上结果存在差异,可能与病程、所用治疗药物等有关,同时样本量较小,仅为横断面研究,应扩大样本量,长期随访,做进一步研究。
[1] Armando V,Antonio G,Giovanni F,etal.Parkinson’s disease:autoimmunity and neuroinflammation[J].Autoimmun Rev,2016,15(12):314-318.
[2] Graber JJ,Dhib-Jalbut S.Protective autoimmunity in the nervous system[J].Pharmacol Therapeut,2009,121(2):147-159.
[3] 高靓,张玉虎,王丽娟.帕金森病与神经免疫炎症研究的新进展[J].临床神经病学杂志,2014,30(3):234-236.
[4] Orr CF,Rowe DB,Mizuno Y,etal.A possible role for humoral immunity in the pathogenesis of Parkinson’s disease[J].J Child Neurol,2005,128(11):2665-2674.
[5] Poletaev AB,Morozov SG,Gnedenko BB,etal.Serum anti-S100b,anti-GFAP and anti-NGF autoantibodies of IgG class in healthy persons and patients with mental and neurological disorders[J].Autoimmunity,2000,32(1):33-38.
[6] Main BS,Zhang M,Brody KM,etal.Type-1 interferons contribute to the neuroinflammatory response and disease progression of the MPTP mouse model of Parkinson’s disease[J].Neurobiol Aging,2016,64(9):1590-1604.
[7] Zhang J,Niu N,Wang M,etal.Neuron-derived IgG protects dopaminergic neurons from insult by 6-OHDA and activates microglia through the FcγR I and TLR4 pathways[J].Int J Biochem Cell B,2013,45(8):1911-1920.
[8] Wang ES,Yao HB,Chen YH,etal.Proteomic analysis of the cerebrospinal fluid of Parkinson’s disease patients pre-and post-deep brain stimulation[J].Cell Physiol Biochem,2013,31(4-5):625-637.
[9] Dufek M,Hamanova M,Lokaj J,etal.Serum inflammatory biomarkers in Parkinson’s disease[J].Parkinsonism Relat D,2009,15(4):318-320.
[10] 汪锡金,张煜,陈生弟.帕金森病发病机制与治疗研究十年进展[J].中国现代神经疾病杂志,2010,10(1):36-42.
[11] Fakhoury M.Role of immunity and inflammation in the pathophysiology of neurodegenerative diseases[J].Neurodegener Dis,2015,15(2):63-69.
[12] Rodrigues MC,Sanberg PR,Cruz LE,etal.The innate and adaptive immunological aspects in neurodegenerative diseases[J].J Neuroimmunol,2014,269(1-2):1-8.
[13] Papuc E,Kurys-Denis E,Krupski W,etal.Humoral response against small heat shock proteins in Parkinson’s disease[J].PLoS one,2015,10(1):54-58.
[14] 汪锡金,陈生弟,刘卫国,等.帕金森病IgG诱导多巴胺能神经元损伤机制的初步研究[J].中华神经科杂志,2004,37(4):335-339.
[15] 中华医学会神经病学分会帕金森病及运动障碍学组,中国医师协会神经内科医师分会帕金森病及运动障碍专业委员会.中国帕金森病的诊断标准(2016版)[J].中华神经科杂志,2016,49(4):268-271.
[16] Williams-Gray CH,Wijeyekoon R,Yarnall AJ,etal.Serum immune markers and disease progression in an incident Parkinson’s disease cohort(ICICLE-PD)[J].Mov Disord,2016,31(7):995-1003.
[17] Kempster PA.Biomarkers for the progression of Parkinson disease[J].Neurology,2016,86(15):1406-1411.
[18] Hoffman PM,Robbins DS,Oldstone MB,etal.Humoral immunity in Guamanians with amyotrophic lateral sclerosis and parkinsonism-dementia[J].Ann Neurol,1981,10(2):193-196.
[19] 何汲,杜翠英,栾清明,等.帕金森氏病患者CSF和血清IgA、IgG含量变化的临床意义[J].山东医药,1993,33(11):17-18.
[20] Hoffman PM,Robbins DS,Gibbs CJ,etal.Immune function among normal Guamanians of different age[J].Int J Gerontol,1983,38(4):414-419.
[21] 邢良美,李洁.运动对血清免疫球蛋白IgA、IgM、IgG的影响[J].吉林体育学院学报,2007,23(6):81-82.
[22] 冯德月,刘丽萍,林志芳,等.焦虑和抑郁情绪对胃癌患者免疫功能的影响[J].中国基层医药,2005,12(9):1179-1181.
Clinical study on serum levels of immunoglobulins and complement of Han and Uygur patients with Parkinson’s disease in Xinjiang region
WANG Pengfei1,JIANG Sen1,YANG Xinling2*,GAO Hua3, LUO Qin4
(1DepartmentofNeurology,FirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830011,China;2FirstAffiliatedHospitalofXinjiangMedicalUniversity;3DepartmentofNeurology,FifthAffiliatedHospitalofXinjiangMedicalUniversity;4DepartmentofMedicine,TumorHospitalAffiliatedofXinjiangMedicalUniversity;*Correspondingauthor,E-mail:poplar862@sohu.com)
ObjectiveTo explore the difference of serum levels of immunoglobulin(IgG,IgA,IgM) and complement(C3,C4) in patients with Parkinson’s disease(PD) between Han and Uygur nationality in Xinjiang province.MethodsA total of 104 cases of primary Parkinson’s disease(PD group) were selected, including 64 cases of Han nationality and 40 cases of Uygur nationality. Another 135 healthy controls were selected as control group, including 84 cases of Han nationality and 51 cases of Uygur nationality. The serum levels of immunoglobulins(IgG,IgA,IgM) and complements(C3,C4) were detected by special protein analyzer,and their relationship with PD were analyzed.ResultsIgG level in PD group was statistically higher than in control group(P<0.05).The serum level of IgA in Uygur PD patients was higher than that in Uygur controls(P<0.05). There was no significant difference in IgG, IgA, IgM, C3 and C4 levels between Han PD group and Han control group(P>0.05) and between Han PD group and Uygur PD group(P>0.05). Logistic regression analysis of the five factors associated with PD(IgG,IgA,IgM, C3, C4) showed that the risk of PD increased by 1.675 times for each additional unit of IgG(P=0.007,OR=1.675). And the Logistic regression analysis showed that the risk of PD increased by 2.096 times in Han nationality(OR=2.096,P=0.029),however,the level of serum IgG was not associated with PD in Uygur nationality.ConclusionThe IgG level is higher in PD patients than in normal controls. The IgA is higher in Uygur PD patients than that of normal Uighurs. IgG may be a risk factor of PD in Han nationality.
Parkinson’s disease; IgG; IgA; IgM; C3; C4
国家自然科学基金资助项目(U1503222)
王鹏飞,男,1988-03生,在读硕士,E-mail:1032600502@qq.com
2016-11-09
R745
A
1007-6611(2017)02-0156-05
10.13753/j.issn.1007-6611.2017.02.014

