食管鳞癌组织中Slug、Vimentin、E-cadherin与血管生成拟态的表达及意义
周芳芳, 陈 冰
(皖南医学院病理学教研室,芜湖 241000; *通讯作者,E-mail:281993214@qq.com)
食管鳞癌组织中Slug、Vimentin、E-cadherin与血管生成拟态的表达及意义
周芳芳, 陈 冰*
(皖南医学院病理学教研室,芜湖 241000;*通讯作者,E-mail:281993214@qq.com)
目的 观察食管鳞癌(human esophageal squamous cell carcinoma,ESCC)组织中上皮间质转化(epithelial mesenchymal transitions,EMT)相关蛋白锌指转录因子snail2(Slug)、E-钙黏附蛋白(E-cadherin)和波形蛋白(Vimentin)与血管生成拟态(vasculogenic mimicry,VM)的表达,并探讨其临床意义。 方法 收集120例ESCC组织采用CD34/PAS套染检测VM情况;免疫组化法检测Slug、血管内皮钙黏蛋白(vascular endothelial cadherin,VE-cadherin)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和Vimentin,E-cadherin表达。 结果 在120例ESCC中Slug的阳性表达与ESCC患者年龄、性别无关(P>0.05),但与分化程度、淋巴结转移、临床分期、脉管癌栓形成等有关(P<0.05);Slug,Vimentin在有VM组阳性表达率明显高于无VM组(P<0.05),且均与VM表达呈正相关(r=0.473、0.396);E-cadherin在有VM组阳性表达率明显低于无VM组(P<0.05),与VM表达呈负相关(r=-0.191);VE-cadherin,VEGF在Slug阳性组的阳性表达率明显高于Slug阴性组(P<0.05),两者均与Slug表达呈正相关(r=0.405,0.445)。 结论 Slug调控的上皮间质转化可能参与了食管鳞癌中血管生成拟态形成过程,另外Slug的高表达可能提示ESCC患者的不良预后。
Slug; 波形蛋白; E-钙黏蛋白; 血管生成拟态; 上皮间质转化; 食管鳞癌
血管生成拟态(vasculogenic mimicry,VM)是一种不依赖于内皮细胞的肿瘤新生血管,是近年来肿瘤血管的研究热点,其在缺氧环境下由HIF-1α[1]诱导VEGF[2]、VE-cadherin[3]等分子的经典信号通路的相关机制已经成熟,但有研究发现,COX-2[4]、TFPI-2[5]、小分子核酸[6]、Mig-7[7]等均参与了血管生成拟态的形成,证实了血管生成拟态的形成机制可能是非常复杂的多信号调控的多条通路的过程;另外在研究血管生成拟态形成过程中发现肿瘤细胞是通过自身变形和细胞外基质重塑构成血管样结构,因此推测肿瘤细胞可能是通过EMT过程来实现肿瘤细胞的变形从而形成VM,Slug是锌指蛋白家族中成员之一,参与调控多种恶性肿瘤的EMT过程。
本研究通过免疫组织化学法检测食管鳞癌中Slug及EMT相关分子Vimentin、E-cadherin的表达,并结合临床病理特征和分析Slug、EMT相关分子Vimentin、E-cadherin与VM之间的相关性,初步探讨Slug调控的EMT在食管鳞癌中VM形成过程中发挥的作用,旨在为研究VM形成机制和临床ESCC抗血管治疗提供新思路。
1 材料和方法
1.1 临床资料
1.1.1 病例来源及特征 收集2012-06~2014-06皖南医学院附属弋矶山医院食管鳞癌手术切除标本120例,其中男性患者96例,占80%;女性患者24例,占20%;年龄为42-77岁,平均(60.3±7.5)岁;所有患者术前均做过活检,无家族史,术后经由3位长期从事病理诊断的高年资医师确诊为食管鳞癌,手术前均无放化疗史。
1.1.2 组织学分级和临床分期 根据肿瘤的分化程度组织学分级:高分化31例,中分化70例,低分化19例;根据肿瘤浸润食管深度分为:浸润至黏膜层及浅肌层68例,深肌层及外膜层52例;淋巴结转移者41例,无转移者79例;有脉管癌栓形成47例,无脉管癌栓形成73例;根据TNM分期进行临床分期:Ⅰ-Ⅱ期70例,Ⅲ-Ⅳ期50例。
1.2 主要试剂
抗体Slug和VE-cadherin均购自Lifespan Bioscience公司,抗体CD34、VEGF、E-Cadherin以及Vimentin均购自北京中杉金桥生物技术有限公司;DAB显色试剂盒和二抗试剂盒均购自福州迈新公司,PAS染色试剂盒购自贝索生物公司。
1.3 实验方法
1.3.1 CD34/PAS双重染色法观察食管鳞癌VM ①根据免疫组化SP法,将抗体CD34免疫组化步骤到DAB显色反应,镜下观察到血管内皮着色后,水流冲洗1 min终止显色反应。②0.5%高碘酸1滴,还原10 min,水流冲洗10min。③Schiff试剂1滴,切片放于避光湿盒,置于37 ℃孵箱反应20 min,待目测组织变红色终止反应,细流水水冲洗20 min。④苏木素复染细胞核2 min。⑤50 ℃温水返蓝1 min,常规脱水,封片。PAS染色阳性对照为正常胃黏膜呈樱桃红色。
1.3.2 血管拟态(VM)评定方法 应用CD34/PAS套染后显微镜观察到由肿瘤细胞构成的管腔样结构,且管壁见不到内皮细胞、腔内可见红细胞或无红细胞、管壁全部或部分PAS阳性、免疫组化CD34(-)的均可判定为VM;不论管腔内有无红细胞,管壁出现CD34(+)的血管,均判定为内皮依赖性血管。血管拟态的评定由三位长期从事病理诊断的高年资医师盲法读片。
1.3.3 免疫组化染色及结果判定 实验用已知阳性作为对照,阴性对照中PBS代替一抗。免疫组化结果判定标准:Slug阳性是细胞核中出现黄色或棕黄色颗粒,E-cadherin和VE-cadherin阳性是细胞膜/浆中出现黄色或棕黄色颗粒,VEGF阳性是细胞质中出现黄色或棕黄色颗粒。Vimentin阳性是在肿瘤细胞中出现黄色或棕黄色颗粒,不论胞质还是胞核,另外其间质中也阳性表达。
对实验指标的阳性表达从两方面进行半定量判断,染色强度积分:0分阴性,1分淡黄,2分深黄,3分棕色。染色范围积分:每例标本选择含有阳性细胞的高倍视野(×400)5个,每个高倍视野计数100个肿瘤细胞及阳性细胞的个数,计算平均阳性细胞百分比,0分阳性细胞≤10%,1分阳性细胞10%-30%,2分阳性细胞30%-70%,3分阳性细胞≥70%。将两项积分相乘得出总积分,<3分为阴性,≥3分为阳性。
1.4 统计学方法
本实验所有相关数据均输入SPSS22.0进行统计学分析,各指标在两组之间阳性表达率的比较:采用四格表χ2检验,当理论值较小时,采用校正四格表χ2检验;两组数据之间的相关性采用Spearman相关分析;以P<0.05作为检验标准。
2 结果
2.1 Slug的表达与食管鳞癌的转移和预后相关
本研究120例食管鳞癌中Slug阳性病例为43例(35.8%)(见图1A),Slug阴性病例为77例(64.2%)。其中高分化组Slug阳性表达率为29.0%,中分化组Slug阳性表达率为28.6%,低分化组Slug阳性表达率为73.7%,组间表达差异有统计学意义(P<0.05,见表1);Slug在不同浸润程度间表达有差异,浸润至深肌层至外膜组Slug表达明显高于黏膜至浅肌层(P<0.05,见表1);Slug阳性表达在淋巴结转移组和无淋巴结转移组有差异(P<0.05,见表1);临床分期Ⅰ-Ⅱ期Slug阳性表达率为24.2%,Ⅲ-Ⅳ期Slug阳性表达率为52.0%,组间表达有统计学差异(P<0.05,见表1);Slug阳性表达在癌栓组和无癌栓组有差异(P<0.05,见表1),但Slug阳性表达在不同年龄和性别之间表达无差异(P>0.05,见表1)。
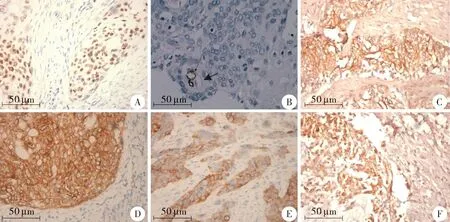
A.食管鳞癌中Slug的阳性表达;B.食管鳞癌中内皮性血管和VM,其中细箭头所指为内皮性血管,CD34(+),粗箭头所指为VM,CD34(-);C.食管鳞癌中VE-cadherin的阳性表达;D.食管鳞癌中的VEGF阳性表达;E.食管鳞癌中E-cadherin的阳性表达;F.食管鳞癌中Vimentin的阳性表达图1 食管鳞癌组织中Slug,VM,VE-cadherin,VEGF,E-cadherin和Vimentin的表达Figure 1 The expression of Slug,VM,VE-cadherin,VEGF,E-cadherin and Vimentin in esophageal squamous cell carcinoma
表1 Slug蛋白在食管鳞癌中的表达情况及其临床病理参数的关系
Table 1 The expression of Slug protein in ESCC and its relationship with clinicopathological parameters
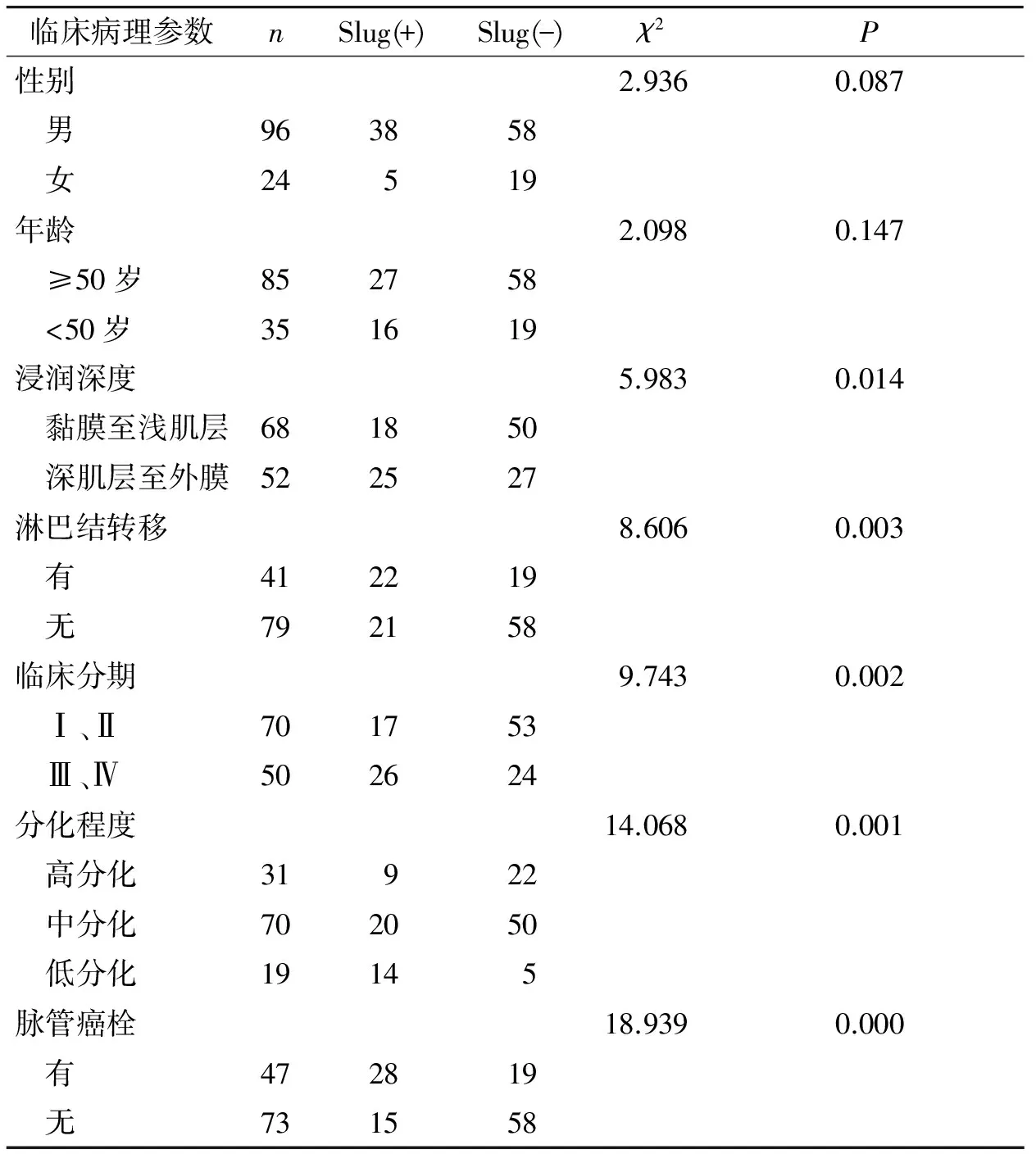
临床病理参数nSlug(+)Slug(-)χ2P性别2.9360.087 男963858 女24519年龄2.0980.147 ≥50岁852758 <50岁351619浸润深度5.9830.014 黏膜至浅肌层681850 深肌层至外膜522527淋巴结转移8.6060.003 有412219 无792158临床分期9.7430.002 Ⅰ、Ⅱ701753 Ⅲ、Ⅳ502624分化程度14.0680.001 高分化31922 中分化702050 低分化19145脉管癌栓18.9390.000 有472819 无731558
2.2 CD34/PAS双重染色法证实食管鳞癌中存在VM现象
在本研究120例食管鳞癌临床病例标本中,有25例(25/120,24%)具有典型的VM结构(见图1B)。
2.3 Slug的表达与VM的关系
在本研究中有25例标本中存在VM现象,有VM组Slug表达明显高于无VM组,并且两者成正相关(见表2)。另外,VE-cadherin和VEGF在Slug阳性组表达阳性均强于Slug阴性组,并且在食管鳞癌中Slug阳性表达与VE-cadherin和VEGF的阳性表达均呈正相关(见图1C、1D,表2)。
2.4 Slug与E-cadherin、Vimentin之间的关系
本研究中E-cadherin阳性表达70例,E-cadherin在Slug阳性组和阴性组表达分别为34.9%和71.4%,差异具有统计学意义。相关性分析表明两者呈负相关(r=-0.355,P=0.000,见图1E)。Vimentin阳性表达28例,Vimentin在Slug阳性组和阴性组表达分别为53.5%和11.7%,差异具有统计学意义,相关性分析表明两者呈正相关(r=0.533,P=0.000,见图1F和表3)。
2.5 VM与E-cadherin、Vimentin之间的关系
本研究中,E-cadherin在有VM组表达低于无VM组,差异有统计学意义,且两者负相关(r=-0.191,P=0.037)。Vimentin在有VM组高于无VM组,差异有统计学意义,且两者正相关(r=0.396,P=0.000,见表4)。
表2 食管鳞癌中Slug蛋白表达及其与VM,VE-cadherin和VEGF的关系
Table 2 The expression of Slug protein in ESCC and its relationship with vasculogenic mimicry(VM),VE-cadherin and VEGF
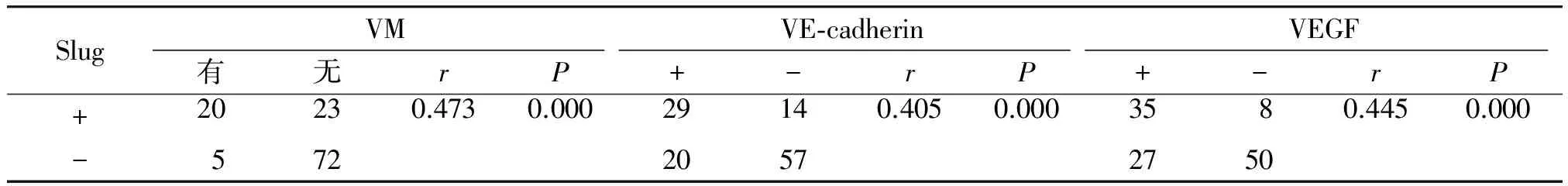
SlugVMVE⁃cadherinVEGF有无rP+-rP+-rP+20230.4730.00029140.4050.0003580.4450.000-57220572750
表3 食管鳞癌中Slug蛋白表达及其与E-cadherin,Vimentin的关系
Table 3 The expression of Slug protein in ESCC and its relationship with E-cadherin and Vimentin

SlugE⁃cadherinVimentin+-rP+-rP+1528-0.3550.00023200.5330.000-5522572
表4 食管鳞癌中VM表达及其与E-cadherin,Vimentin的关系
Table 4 The expression of VM in ESCC and its relationship with E-cadherin and Vimentin

VME⁃cadherinVimentin+-rP+-rP+1015-0.191 0.03714110.3960.000-60351481
3 讨论
食管鳞状细胞癌是消化系统的常见恶性肿瘤之一,由于其早期症状不明显,并且易局部浸润和转移,因此其死亡率较高。肿瘤的局部浸润和转移大多数情况下与肿瘤的血管生成关系密切。在20世纪70年代Folkman等[8]提出了血管依赖性生长肿瘤的概念后,关于肿瘤血管生成的影响因素和机制便成为了肿瘤研究的热点之一;其目的是为了向临床提供抗肿瘤血管生成治疗。但长期以来抗血管生成效果并不佳,甚至在部分临床研究中这一治疗方式反而能促进肿瘤血管生成[9]。直到肿瘤“血管生成拟态”[10]模式的提出,人们才意识到肿瘤中还存在着一种不依赖于内皮细胞的全新的肿瘤血液供应模式。血管生成拟态形成的三个中心环节是肿瘤细胞模拟内皮细胞变形、基质重塑、VM与内皮性血管相通;那么上皮来源的肿瘤细胞如何能够向间充质来源的内皮细胞分化,形成VM管道样结构?由缺氧诱导的VM的经典形成通路并不能很好地解释这一过程。
而上皮间质转化是指上皮细胞向间质细胞转变从而形成间充质细胞的过程,往往有上皮细胞标志物的下调和间质细胞标志物的上调以及上皮细胞获得迁移或者侵袭力增强的功能性改变,且这个过程具有暂时性和可逆性等特点[11]。
由于VM形成过程和EMT之间存在相似性,因此我们推测上皮来源的肿瘤细胞可能通过EMT向间充质来源的内皮细胞分化,模拟内皮细胞的形态和功能,从而形成VM。因此研究诱导EMT形成的重要核转录因子Twist、Slug、ZEB与VM形成的关键分子之间的关系,有助于进一步完善上皮来源的肿瘤中VM形成的机制。
Slug属于Snail基因超家族,这是一类具有锌指结构的转录因子家族,在多种恶性肿瘤中Slug能够促进转移与浸润;本实验结果也同样显示,Slug的阳性表达与年龄、性别无关,但与淋巴结转移、癌栓形成、临床分期、分化程度等有关;提示其参与食管鳞癌的转移与浸润。Slug、Twist、ZEB是调控EMT的三大重要核转录因子,研究表明[12-14],上调Twist、ZEB-1等,可以在VM形成中发挥关键作用,Sun等[12]发现,通过调控肝癌细胞的Twist的表达可以影响肝癌VM形成能力,两者呈正相关;Liu等[13]研究发现,在直肠癌中调控ZEB-1同样在促进VM形成,Yang等[14]在肝癌中发现ZEB-2促进VM形成。然而,Slug与食管鳞癌VM之间的关系目前尚不清楚,本研究结果显示,食管鳞状细胞癌中存在VM组的Slug的阳性表达率显著高于不存在VM组(r=0.473,P<0.05);并且Slug阳性组VE-cadherin、VEGF的表达均明显强于Slug阴性组(r=0.405,0.445,P<0.05);而VE-cadherin、VEGF是公认的VM形成的关键性因子,这些结果均提示Slug与食管鳞癌VM形成关系密切。
EMT是胚胎时期的一个正常发育过程,其标志性表现为上皮标志物E-cadherin的下降和间质标志物Vimentin的上调;当EMT发生于恶性肿瘤过程时往往可促进肿瘤细胞的浸润和转移,本研究结果显示E-cadherin、Vimentin在食管鳞癌VM(+)组和VM(-)组之间表达有差异(P<0.05),VM与E-cadherin的表达呈负相关,而与Vimentin呈正相关,这提示在食管鳞癌VM中有EMT的发生。
另外本研究中食管鳞癌Slug的表达与Vimentin呈正相关,与E-cadherin呈负相关,这些结果均提示Slug蛋白可能通过抑制上皮细胞标记E-cadherin的表达,促进间叶细胞标记Vimentin表达[15,16],诱导EMT的发生使肿瘤细胞之间的黏附性下降,利于肿瘤细胞的自身变形,从而促进食管鳞癌VM的形成。
综上所述,Slug蛋白诱导的EMT可能参与食管鳞癌的VM形成,从而促进食管鳞癌的转移和浸润,但具体机制目前还不是很清楚,有可能是通过抑制E-cadherin表达和促进Vimentin表达,这将是今后研究的重点,另外希望研究可以为临床的抗肿瘤血管治疗提供一些新的指导。
[1] Ra JA,Kale S,Thorat D,etal.Hypoxia-driven osteopontin contributes to breast tumor growth through modulation of HIF1alpha-mediated VEGF-dependent angiogenesis[J].Oncogene,2014,33(16):2053-2064.
[2] Liang X,Xu F,Ma C,etal.VEGF Signal system:The application of antiangiogenesis[J].Curr Med Chem,2014,21(7):894-910.
[3] Kirchann DA,Seftore A,Hardy KM,etal.Molecularpathways:Vasculogenic mimicry in tumor cells:Diagnostic and therapeutic implications[J].Clin Cancer Res,2012,18(10):2726-2732.
[4] Wu WK,Sung JY,Lee CW,etal.Cyclooxygenase-2 in tumorigenesis of gastrointestinal canceers:an update on the molecular mechanisms[J].Cancer Lett,2010,295:7-16.
[5] Ruf W,Seftor EA,Petrovan RJ,etal.Differential role of tissue factorpathway inhibitors 1 and 2 in melanoma vasculogenic mimicry[J].Cancer Res,2003,63(17):5381-5389.
[6] Song Y,Mu L,Han X,etal.MicroRNA-9 inhibits vasculogenic mimicry of glioma cell lines by suppressing Stathmin expression[J].Neuroncol,2013,115(3):381-390.
[7] Petty AP,Garman KL,Winn VD,etal.Overexpression of carcinoma and embryonic cytotrophoblast cell-specific Mig-7 induces invasion and vesse-like structure formation[J].Am J Pathol,2007,170:1763-1780.
[8] Folkman J.What is the evidence that tumors are angiogenesis dependent[J].Journal of the National Cancer Institute,1990,82(1):4-6.
[9] Carbone C,Moccia T,Zhu C,etal.Anti-VEGF treatment-resistant pancreatic cancers secrete proinflammatory factors that contribute to malignant progression by inducing an EMT cell phenotype[J].Clinical cancer research,2011,17(17):5822-5832.
[10] Maniotis AJ,Folberg R,Hess A,etal.Vascular channel formation by human melanoma cellsinvivoandinvitro:vasculogenic mimicry[J].Am J Pathol,1999,155(3):739-752.
[11] Thiery JP.Epithelial-mesenchymal transitions in development and pathologies[J].Curr Opin Cell Biol,2003,15(6):740-746.
[12] Sun T,Zhao N,Zhao XL,etal.Expression and functional significance of Twist1 in hepatocellular carcinoma:its role in vasculogenic mimicry[J].Hepatology,2010,51(2): 545-556.
[13] Liu Z,Sun B,Qi L,etal.Zinc finger Ebox binding homeobox 1 promotes vasculogenic mimicry in colorectal cancer through induction of epithelial to mesenchymal transition[J].Cancer Sci,2012,103(4):813-820
[14] Yang Z,Sun B,Li Y,etal.ZEB2 Promotes vasculogenic mimicry by TGF-beta1 induced epithelial-to-mesenchymal transition in hepatocellular carcinoma[J].Exp Mol Pathol,2015,98(3):352-359.
[15] Lim J,Thiery JP.Epithelial-mesenchymal transitions:Insights from development[J].Development,2012,139(19):3471-3486.
[16] Jing Y,Cui D,Guo W,etal.Activated androgen receptor promotes bladder cancer metastasis via Slug mediated epithelialmesenchymal transition[J].Cancer Lett,2014,348(1-2):135-145.
Expression of Slug,Vimentin,E-cadherin and vasculogenic mimicry in esophageal squamous cell carcinoma and its clinical significance
ZHOU Fangfang, CHEN Bing*
(DepartmentofPathology,WannanMedicalCollege,Wuhu241000,China;*Correspondingauthor,E-mail:281993214@qq.com)
ObjectiveTo study the expression of Slug,Vimentin,E-cadherin and vasculogenic mimicry in esophageal squamous cell carcinoma and its clinical significance.MethodsDual staining of CD34 and periodic acid-schiff(PAS) was performed to validate the existence of vasculogenic mimicry in human esophageal squamous cell carcinoma(ESCC). Immunohistochemical method was used to detect the expression of Slug,VE-cadherin,VEGF,Vimentin,E-cadherin in 120 case of ESCC.ResultsThe positive rate of Slug was correlated with differentiation,lymph node metastsis, cancer embolus and clinical stage(P<0.05),but not with age and gender(P>0.05). The expression of Slug and Vimentin in positive VM group was significantly higher than in negative VM group(P<0.05),and the expression of Slug and Vimentin was positively correlated with VM in ESCC(r=0.473,0.396).The expression of E-cadherin in positive VM group was lower than in negative VM group(P<0.05),and the expression of E-cadherin was negatively correlated with VM in ESCC(r=-0.191).The expression of VE-cadherin,VEGF in positive Slug group was obviously higher than that in negative Slug group(P<0.05),and the levels of VE-cadherin and VEGF expression were positively correlated with Slug in ESCC(r=0.405,0.445).ConclusionThe epithelial mesenchymal transitions regulated by Slug may promote VM formation in ESCC.High expression of Slug may indicate the poor prognosis of ESCC patients.
Slug; Vimentin; E-cadherin; vasculogenic mimicry; epithelial mesenchymal transitions; esophageal squamous cell carcinoma
皖南医学院校级中青年基金资助项目(WK201316)
周芳芳,女,1983-06生,硕士,助教,E-mail:379583530@qq.com
2016-11-09
R735.1
A
1007-6611(2017)02-0144-05
10.13753/j.issn.1007-6611.2017.02.011

