急性ST段抬高心肌梗死患者体内循环微粒对血管内皮功能的影响
李 芸, 张 伟
(1延安大学附属医院心脑专科分院电生理室,延安 716000; 2延安大学附属医院心脑专科分院心血管内科一病区)
急性ST段抬高心肌梗死患者体内循环微粒对血管内皮功能的影响
李 芸1, 张 伟2
(1延安大学附属医院心脑专科分院电生理室,延安 716000;2延安大学附属医院心脑专科分院心血管内科一病区)
目的 探讨急性ST段抬高心肌梗死(STEMI)患者体内循环微粒(MPs)对离体大鼠血管内皮功能影响的差异。 方法 通过离心提取正常志愿者(正常对照组,n=35),急性心肌梗死并心电图显示ST段抬高患者(STEMI组,n=40)体内的MPs,然后用分别用正常对照组和STEMI组的MPs孵育离体SD大鼠血管,进而用Western blot检测两组MPs对离体SD大鼠血管内皮素-1(ET-1)蛋白、内皮一氧化氮合酶(eNOS)蛋白表达影响的差异;用一氧化氮(NO)试剂盒检测两组MPs对离体SD大鼠血管NO水平影响的差异。 结果 与来自正常对照组的MPs比较,STEMI组的MPs明显抑制离体SD大鼠血管eNOS蛋白的表达、NO的产生(P<0.05),同时促进离体SD大鼠血管ET-1蛋白的表达(P<0.05)。 结论 急性STEMI患者体内MPs可能通过eNOS和ET-1途径影响血管内皮功能。
急性ST段抬高心肌梗死; 循环微粒; 内皮素-1; 内皮一氧化氮合酶
循环微粒(circulating microparticles,MPs)是内皮细胞、血小板、白细胞等血管或血液相关细胞被激活或凋亡时分泌的微小颗粒[1,2]。目前研究认为它不仅是内皮细胞是否受损的标志物,而且在炎症反应、凝血状态、血管功能障碍和血管再生等方面起着重要生物学作用,参与多种血管相关疾病的发生发展[3,4]。急性ST段抬高心肌梗死(ST-segment elevation myocardial infarction,STEMI)包括疾病前期的炎症状态、冠状动脉血管粥样硬化斑块的破裂、血小板黏附、聚集、活化和血管痉挛等。鉴于MPs及STEMI在内皮及血小板方面的重叠,本研究以STEMI患者及正常健康志愿者为研究对象,对比两者体内MPs对内皮功能影响的差异,以进一步明确MPs在心肌梗死病理生理过程中的作用机制。
1 资料与方法
1.1 研究对象
STEMI患者(STEMI组,40例)为2016-01~2016-08期间就诊于延安大学附属医院心内科,心电图提示相应导联ST段明显抬高的心肌梗死者。STEMI组年龄33-55岁,平均(41.35±6.62)岁;同时排除患糖尿病、高血压、严重感染性疾病、肾功能衰竭等可能影响机体MPs含量的疾病者。正常对照组(35例)为2016-01~2016-08期间于延安大学附属医院行健康体检者, 年龄30-55岁,平均( 39.64±8.85)岁。所有参与者均签署知情同意书,本研究已通过延安大学附属医院伦理委员会批准。
1.2 血浆MPs提取
按文献[5]描述进行MPs提取:首先经肘静脉抽取正常对照组(体检当天)及STEMI组(入院翌日)参与者的清晨空腹血液样本,经低温运送至实验室后离心(11 000×g,4 ℃,2 min)。离心结束后提取上层乏血小板血浆2 ml再次离心(13 000×g,4 ℃,45 min)。离心结束后弃去上层血浆,MPs为微量白色沉淀,若担心离心管管壁残留血浆影响后续结果,此次离心结束后可向离心管内加入2 ml生理盐水后重复第二次离心。将沉淀于离心管底部的MPs用RPMI1640培养基(GIBCO公司)悬浮后冻存于-80 ℃备用。
1.3 血管内皮细胞一氧化氮合酶(eNOS)及内皮素-1(ET-1)的表达
实验所用SD大鼠均购至延安大学实验动物中心。斩头处死大鼠后迅速分离取出大鼠胸主动脉并置于预冷的Kreb’s平衡液(NaCl 119.0 mmol/L,NaHCO325.0 mmol/L,glucose 11.1 mmol/L,CaCl21.6 mmol/L,KCl 4.7 mmol/L,KH2PO41.2 mmol/L,MgSO41.2 mmol/L,pH 7.4,所用试剂均为国产分析纯) 内。仔细分离血管周围脂肪组织(避免用力牵拉血管及破坏血管内膜)后将血管沿纵轴剖开。将剖开的血管置入37 ℃的Kreb’s平衡液中并置入细胞孵育箱平衡30 min后加入MPs孵育1 h[6]。实验分空白组(blank组,不处理)、正常对照组(加正常对照组MPs)、STEMI组(加STEMI组MPs)。孵育结束后用PBS(GIBCO 公司)清洗3次,用预冷的RIPA细胞裂解液(CST公司)裂解和提取细胞蛋白,经超声进一步破碎后离心(4 ℃,12 000 r/min 10 min)取上层蛋白液,用BCA蛋白浓度测定试剂盒(Thermo公司)测定蛋白浓度后用Western blot检测eNOS及ET-1蛋白的表达变化。
1.4 血管内皮细胞一氧化氮(NO)水平的检测
依步骤1.3中所述分离SD大鼠胸主动脉血管并孵育MPs 1 h。实验分空白组(blank组,不处理)、阳性对照组(vascular endothelial growth factor,VEGF,50 ng/ml,R&D公司)、正常对照组(加正常对照组MPs)、STEMI组(加STEMI组MPs)。孵育结束后弃取去孵育液,用含钙镁的HBSS(GIBCO公司)清洗细胞3次后将血管加入500 μl含钙镁的HBSS(含L-arginine 25 mmol/L)再次孵育细胞30 min后吸取孵育液用一氧化氮检测试剂盒(南京建成公司)测定NO含量。孵育结束后将血管烘干称重用来换算最终每克血管的NO产量(μmol/g)。
1.5 统计学方法
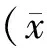
2 结果
2.1 一般临床数据比较
除血脂水平外(STEMI组参与者血脂水平偏高),对照组与STEMI组在年龄、性别、体质量指数上无明显统计学差异(见表1)。

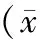
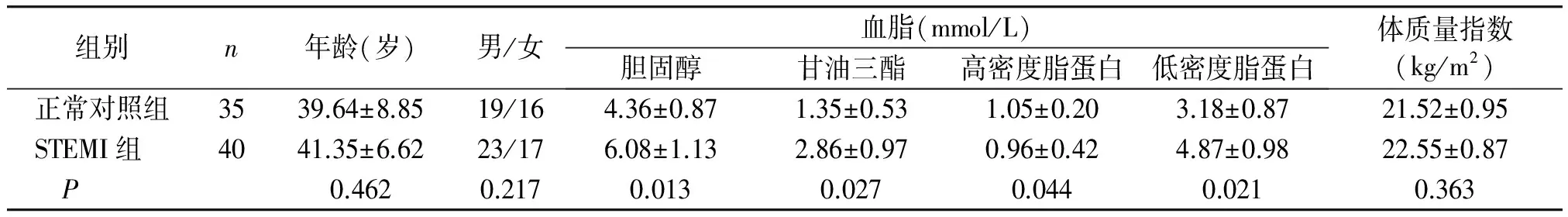
组别n年龄(岁)男/女血脂(mmol/L)胆固醇甘油三酯高密度脂蛋白低密度脂蛋白体质量指数(kg/m2)正常对照组3539.64±8.8519/164.36±0.871.35±0.531.05±0.203.18±0.8721.52±0.95STEMI组4041.35±6.6223/176.08±1.132.86±0.970.96±0.424.87±0.9822.55±0.87 P0.4620.2170.0130.0270.0440.0210.363
与对照组比较,*P<0.05
2.2 MPs对血管内皮eNOS及ET-1蛋白表达的影响
与空白组比较,正常对照组MPs对血管内皮eNOS蛋白的表达无影响(P>0.05,见图1),STEMI组MPs明显抑制了血管内皮eNOS蛋白的表达(P<0.05,见图1)。与空白组比较,正常对照组MPs对血管内皮ET-1蛋白的表达无影响(P>0.05,见图1),STEMI组MPs明显刺激了血管内皮ET-1蛋白的表达(P<0.05,见图1)。
2.3 MPs对血管内皮NO水平的影响
与空白组比较,VEGF组明显促进内皮细胞NO的产生(P<0.05),提示试验操作有效;正常对照组MPs对血管内皮NO的产生无影响(P>0.05);STEMI组MPs明显抑制血管内皮NO的产生(P<0.05,见图2)。

与空白组和对照组比较, *P<0.05图1 各组MPs对血管内皮eNOS及ET-1表达变化的影响Figure 1 Effect of MPs on the expression of eNOS and ET-1 in vascular endothelial cells

与空白组和对照组比较,*P<0.05;与对照组和VEGF组比较,#P<0.05图2 各组MPs对血管内皮NO含量的影响Figure 2 Effect of MPs from each group on the content of NO in vascular endothelial cells
3 讨论
本研究通过离心提取健康志愿者(正常对照组)和STEMI患者(STEMI组)的MPs,对比两组MPs对血管内皮功能的影响发现:与正常对照组比较,STEMI组MPs明显抑制血管内皮eNOS蛋白的表达和NO的产生(P<0.05);STEMI组MPs显著促进血管内皮ET-1蛋白的表达(P<0.05)。提示STEMI患者体内MPs可能通过下面两个方面影响血管舒张和收缩的平衡:抑制eNOS蛋白的表达和NO的产生影响血管舒张因子;刺激血管内皮ET-1蛋白的表达影响血管收缩因子。
近些年,EMPs作为一种内皮细胞、血小板、白细胞等血管细胞在受到外界激活或凋亡时,以“出泡”方式分泌的微小颗粒。目前认为它在细胞激活、损伤或凋亡时可由内皮细胞或血小板分泌,具有反映内皮细胞功能的作用[7]。MPs包含磷脂和表面蛋白,这些成分可以反映他们的起源细胞。例如内皮细胞表面抗原CD31、血小板内皮细胞黏附分子-1(PECAM-1)或CD62[8]。目前研究认为MPs不仅是反映内皮细胞是否受损的标志物,还在炎症反应、凝血状态、血管功能障碍和血管再生等方面起到重要的生物学作用,参与了多种血管相关疾病的发生发展[9,10]。2010-2011年期间,Circulation Research杂志以专题的形式连续报道了数篇有关微粒的综述评论,文章涉及细胞内信号传导、血管新生、血管功能、动脉粥样硬化等方面[9-12]。
STEMI的病理生理包含了疾病早期机体的炎症反应,以及心肌梗死发生时冠状动脉粥样硬化中不稳定斑块的破裂,进而激活体内血小板而致使血小板发生黏附和聚集,这些病理生理的改变必然影响冠状动脉内皮功能而发生冠状动脉痉挛和血栓形成,最终影响患者的生命安全。鉴于MPs的产生过程与SREMI的病理生理过程中的共性,也是我们本次研究的假设和宗旨。本研究通过MPs孵育大鼠离体胸主动脉后检测与血管内皮功能血管的指标发现:来自STEMI患者体内的MPs明显抑制了血管内皮eNOS蛋白的表达(见图1A)和NO的产生(见图2);来自STEMI患者体内的MPs明显刺激血管内皮ET-1蛋白的表达(见图1B)。NO主要通过一氧化氮合酶(NOS)的活化从L-精氨酸转化而来。NO是维持细胞功能的重要物质,同时是反映内皮细胞功能的重要指标[13-15]。ET-1为血管收缩肽,可以收缩动脉平滑肌,ET-1的水平升高与血管阻力、动脉压呈正相关[16,17]。
综上所述,本研究显示STEMI患者体内的MPs抑制血管内皮eNOS活化及NO的产生,同时促进血管内皮ET-1的产生,最终导致血管舒张和收缩因子的失衡,导致疾病的恶化。因此MPs有作为血管内皮功能受损标志物的潜能。
[1] Horstman LL,Jy W,Jimenez JJ,etal.Endothelial microparticles as markers of endothelial dysfunction[J].Front Biosci,2004,9:1118-1135.
[2] Chironi GN,Boulanger CM,Simon A,etal.Endothelial microparticles in diseases[J].Cell Tissue Res,2009,335(1):143-151.
[3] Dignat-George F,Boulanger CM.The many faces of endothelial microparticles[J].Arterioscler Thromb Vasc Biol,2011,31(1):27-33.
[4] Piccin A,Murphy WG,Smith OP.Circulating microparticles:pathophysiology and clinical implications[J].Blood Rev,2007,21(3):157-171.
[5] Boulanger CM,Scoazec A,Ebrahimian T,etal.Circulating microparticles from patients with myocardial infarction cause endothelial dysfunction[J].Circulation,2001,104:2649-2652.
[6] Fu L,Hu XX,Lin ZB,etal.Circulating microparticles from patients with valvular heart disease and cardiac surgery inhibit endothelium-dependent vasodilation[J].J Thorac Cardiovasc Surg,2015,150(3):666-672.
[7] van Ierssel SH,Hoymans VY,van Craenenbroeck EM,etal.Endothelial microparticles for the assessment of endothelial function:aninvitroandinvivostudy on possible interference of plasma lipids[J].PLoS One,2012,7(2):e31496.
[8] Jimenez JJ,Jy W,Mauro LM,etal.Endothelial cells release phenotypically and quantitatively distinct microparticles in activation and apoptosis[J].Thromb Res,2003,109:175-180.
[9] Martinez MC,Andriantsitohaina R.Microparticles in angiogenesis:Therapeutic potential[J].Circ Res,2011,109(1):110-119.
[10] Mause SF,Weber C.Microparticles:protagonists of a novel communication network for intercellular information exchange[J].Circ Res,2010,107(9):1047-1057.
[11] Owens AP 3rd,Mackman N.Microparticles in hemostasis and thrombosis[J].Circ Res,2011,108(10):1284-1297.
[12] Rautou PE,Vion AC,Amabile N,etal.Microparticles,vascular function,and atherothrombosis[J].Circ Res,2011,109(5):593-606.
[13] Aicher D,Urbich C,Zeiher A,etal.Endothelial nitric oxide synthase in bicuspid aortic valve disease[J].Ann Thorac Surg,2007,83(4):1290-1294.
[14] Crabtree MJ,Smith CL,Lam G,etal.Ratio of 5,6,7,8-tetrahydrobiopterin to 7,8-dihydrobiopterin in endothelial cells determines glucose-elicited changes in NO vs.superoxide production by eNOS[J].Am J Physiol Heart Circ Physiol,2008,294(4):H1530-H1540.
[15] Ou ZJ, Wei W,Huang DD,etal.L-arginine restores endothelial nitric oxide synthase-coupled activity and attenuates monocrotaline-induced pulmonary artery hypertension in rats[J].Am J Physiol Endocrinol Metab,2010,298(6):E1131-1139.
[16] 尹清茹,刘恒亮.厄贝沙坦对高血压患者纤溶活性内皮素一氧化氮降钙素基因相关肽的影响[J].中国临床保健杂志,2005,8(2):110-112.
[17] Yamamoto K,Ikeda U,Mito H,etal.Endothel in production in pulmonary circulation of patient with mitral stenos is[J].Circulation,1994,89(5):2093-2098.
Effect of circulating microparticles on endothelial function in patients with acute ST-segment elevation myocardial infarction
LI Yun1, ZHANG Wei2
(1DepartmentofElectrophysiology,CardiovascularSpecialistBranch,AffiliatedHospitalofYan’anUniversity,Yan’an716000,China;2DepartmentofCardiology,CardiovascularSpecialistBranch,AffiliatedHospitalofYan’anUniversity)
ObjectiveTo investigate the effect of circulating microparticles(MPs) on endothelial function in patients with acute ST-segment elevation myocardial infarction(STEMI).MethodsMPs of healthy subjects(control group,n=35) and patients with acute ST-segment elevation myocardial infarction(STEMI group,n=40) were obtained by centrifuge. Then, the effects of MPs on expression of endothelial nitric oxide synthase(eNOS) and endothelial-1(ET-1) were tested by Western blot, and the levels of nitric oxide(NO) in isolated SD rat vessels were detected by NO Kit.ResultsCompared with control group, MPs significantly inhibited the expression of eNOS and the generation of NO, but increased expression of ET-1 in STEMI group(P<0.05).ConclusionMPs in STEMI patients may affect endothelial function through eNOS and ET-1 pathway.
acute ST segment elevation myocardial infarction; circulating microparticles; endothelin-1; endothelial nitric oxide synthase
国家自然科学基金专项基金资助项目(81341112)
李芸,女,1979-02生,学士,主治医师
2016-11-24
R542.22
A
1007-6611(2017)02-0106-04
10.13753/j.issn.1007-6611.2017.02.003

