青蒿素通过抑制JAK2/STAT3信号通路诱导肝癌细胞凋亡
郭佳培, 郭 彬, 李雷雷, 刘殿星, 石 峻, 吴景华
(华北理工大学附属医院检验科,唐山 063000; *通讯作者,E-mail:tswujinghua@163.com)
青蒿素通过抑制JAK2/STAT3信号通路诱导肝癌细胞凋亡
郭佳培, 郭 彬, 李雷雷, 刘殿星, 石 峻, 吴景华*
(华北理工大学附属医院检验科,唐山 063000;*通讯作者,E-mail:tswujinghua@163.com)
目的 研究青蒿素对肝癌细胞中JAK2/STAT3信号通路活化的影响,探讨青蒿素抗肿瘤的相关机制。 方法 选择15只6-8周龄的C57BL/6J小鼠,采用二乙基亚硝胺(diethylnitrosamine,DEN)腹腔注射和CCl4灌胃方法构建小鼠肝癌模型,随机分为PBS组、青蒿素组和青蒿素+pJAK2多肽组,另选5只正常小鼠作为空白组。PBS组和青蒿素组分别腹腔注射PBS及青蒿素(100 mg/kg),隔日作用,3周后处死小鼠;青蒿素+pJAK2多肽组应用pJAK2多肽[100 μmol/(L·kg)]隔日作用3次后,再联合青蒿素隔日作用3周,处死小鼠;分离肿瘤组织,Western blot检测肿瘤组织Caspase 3的表达,免疫荧光检测组织中p-JAK2及p-STAT3的表达。 结果 成功构建小鼠肝癌模型,荷瘤小鼠经青蒿素作用后肿瘤组织Caspase 3蛋白表达显著增加(P<0.001)。同时免疫荧光结果显示青蒿素组肿瘤组织中的p-JAK2及p-STAT3磷酸化水平较之PBS组明显降低;荷瘤小鼠经pJAK2多肽预处理后,青蒿素诱导荷瘤小鼠表达Caspase 3显著降低(P<0.05),差异有统计学意义。 结论 青蒿素通过抑制JAK2/STAT3信号通路活化诱导肝癌细胞凋亡,进而发挥抗肿瘤作用。
肝癌; 青蒿素; JAK2/STAT3; 细胞凋亡
肝癌(hepatocellular carcinoma,HCC)是常见恶性肿瘤之一,其发病率逐年增高,病死率在肿瘤中位居第二[1]。由于其起病隐匿和进展迅速等特点,多数患者确诊时已是中晚期。因此,化疗成为常用的治疗手段。然而细胞毒性药物化疗效果往往不理想,并且对正常细胞也有一定的毒副作用[2],因此中晚期肝癌的治疗方式仍有待进一步拓展与改善。青蒿素是1971年由中国首次从黄花蒿叶中提取的倍半萜内酯类化合物,因其抗疟性强、毒性低,为治疗疟疾的首选药物。目前有研究表明,青蒿素具有抗肿瘤细胞活性和抑制肿瘤的作用,可以诱导肝癌细胞凋亡[3],本实验对青蒿素抗肿瘤作用进行深入观察与分析,探究青蒿素诱导肝癌凋亡的机制。
1 材料与方法
1.1 主要试剂与仪器
青蒿素注射液(广州汉方现代中药研究有限公司,批号100651),anti-p-JAK2抗体(美国,CST),anti-p-STAT3抗体(美国,CST),anti-Caspase 3抗体(美国,CST),p-JAK2多肽(上海,吉尔生化),FITC-anti-IgG(中国,碧云天),TRITC-anti-IgG(中国,碧云天),蛋白电泳仪(Bio-rad,美国),Image Lab凝胶成像分析系统(Bio-rad,美国),免疫荧光显微镜(日本,奥林巴斯)。
1.2 小鼠肝癌模型构建
选择SPF级C57BL/6J小鼠20只(华北理工大学实验动物中心SPF级环境饲养,生产许可证号:SCXK(军) 2014-0001),6-8周龄,体质量23-28 g。随机分为空白组、PBS组、青蒿素组、青蒿素+pJAK2多肽组,每组5只。其中PBS组、青蒿素组、青蒿素+pJAK2多肽组小鼠构建肝癌模型。三组小鼠在适宜的相同环境中饲养6 d,小鼠腹腔注射100 mg/kg的二乙基亚硝胺(diethylnitrosamine,DEN),小鼠腹腔注射3 d后,以5 ml/kg的CCl4和橄榄油(按20 ∶80的体积之比)灌胃,2次/周,第3周给予DEN 50 mg/kg腹腔注射1次,同时给予含9%乙醇饮用水,第4周开始加大CCl4剂量至8 ml/kg灌胃至18周,对荷瘤小鼠进行药物干预。
1.3 荷瘤小鼠的药物干预
空白组5只小鼠正常饲养,不做处理。取构建好的荷瘤小鼠进行药物干预:PBS组及青蒿素组分别腹腔注射PBS及青蒿素(100 mg/kg),隔日1次,连续作用3周,实验结束处死小鼠,分离肿瘤组织。p-JAK2多肽+青蒿素组腹腔注射p-JAK2多肽[100 μmol/(L·kg)],隔日注射一次,注射3次后,再用青蒿素(100 mg/kg)联合p-JAK2多肽[10 μmol/(L·kg)]作用,隔日1次,连续作用3周,处死小鼠,分离小鼠的肿瘤组织。
1.4 免疫荧光组织化学检测JAK2/STAT3的活化
将上述方法分离的各组小鼠的部分肿瘤组织,冰冻切片,加一抗4 ℃过夜,荧光标记的二抗37 ℃作用1 h,荧光显微镜观察肿瘤组织中JAK2和STAT3的活化情况。实验平行重复3次。
1.5 Western blot检测肿瘤组织中Caspase 3和P53的表达
提取上述方法分离的各组小鼠的部分肿瘤组织中的蛋白,用10%聚丙烯酰胺凝胶进行电泳,加一抗4 ℃过夜,二抗37 ℃作用1 h,应用Image Lab凝胶成像系统检测肿瘤组织中Caspase 3和P53的表达水平。实验平行重复3次。
1.6 统计学分析
2 结果
2.1 青蒿素诱导荷瘤小鼠肝癌组织凋亡情况
成功构建小鼠模型,分离肿瘤组织并提取蛋白,Western blot结果显示,荷瘤小鼠经青蒿素作用后,凋亡蛋白Caspase3表达较空白组及PBS组显著升高(见表1,图1)。
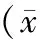
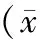

组别 Caspase3FP空白组142.637<0.001PBS组0.86±0.08青蒿素组2.53±0.20∗
与空白组和PBS组相比,*P<0.001

1.空白组;2.PBS组;3.青蒿素组 图1 青蒿素诱导肿瘤组织细胞凋亡情况Figure 1 Apoptosis induced by artemisinin in tumor tissues
2.2 青蒿素抑制肝癌组织JAK2/STAT3信号通路的活化情况
通过免疫荧光检测发现,荷瘤小鼠JAK2的磷酸化水平(p-JAK2)及STAT3磷酸化水平(p-STAT3)较之空白组明显升高,同时经青蒿素作用后,荷瘤小鼠JAK2和STAT3磷酸化水平又显著降低(见图2)。结果提示,青蒿素可以抑制肿瘤组织JAK2,STAT3的磷酸化激活。
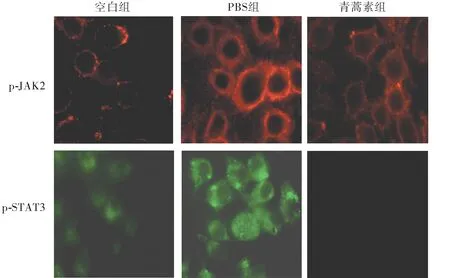
图2 免疫荧光检测肿瘤组织JAK2/STAT3的活化情况 (×400)Figure 2 The activation of JAK2/STAT3 in tumor tissues by immunofluorescence histochemistry (×400)
2.3 青蒿素通过JAK2/STAT3通路诱导肝癌细胞凋亡情况
为了进一步验证青蒿素通过活化JAK2/STAT3信号通路对肿瘤凋亡的影响,加入了pJAK2多肽。Western blot结果显示,加入pJAK2多肽后肝癌细胞中的JAK2/STAT3信号通路被显著活化(见表2,图3A);同时可以显著降低肿瘤的凋亡蛋白Caspase3的表达(见表3,图3B)。结果进一步证明了青蒿素通过抑制JAK2/STAT3信号通路抑制细胞的凋亡。
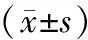
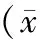
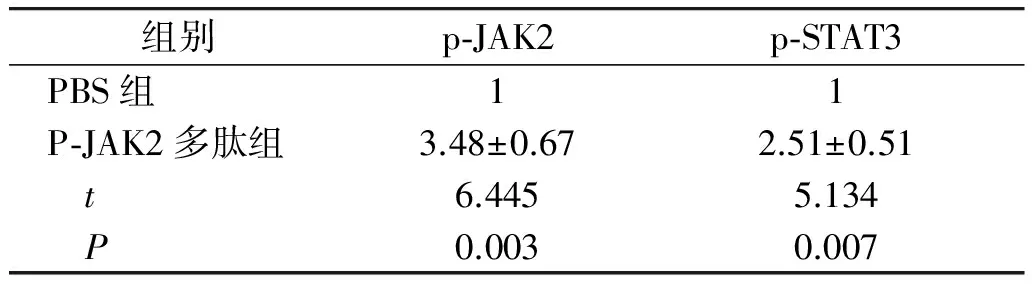
组别p⁃JAK2p⁃STAT3PBS组11P⁃JAK2多肽组3.48±0.672.51±0.51 t6.4455.134 P0.0030.007
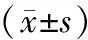
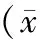

组别Caspase3FP空白组176.531<0.001PBS组0.94±0.30青蒿素组3.67±0.52∗pJAK2多肽+青蒿素组1.17±0.53
与其他三组相比,*P<0.05
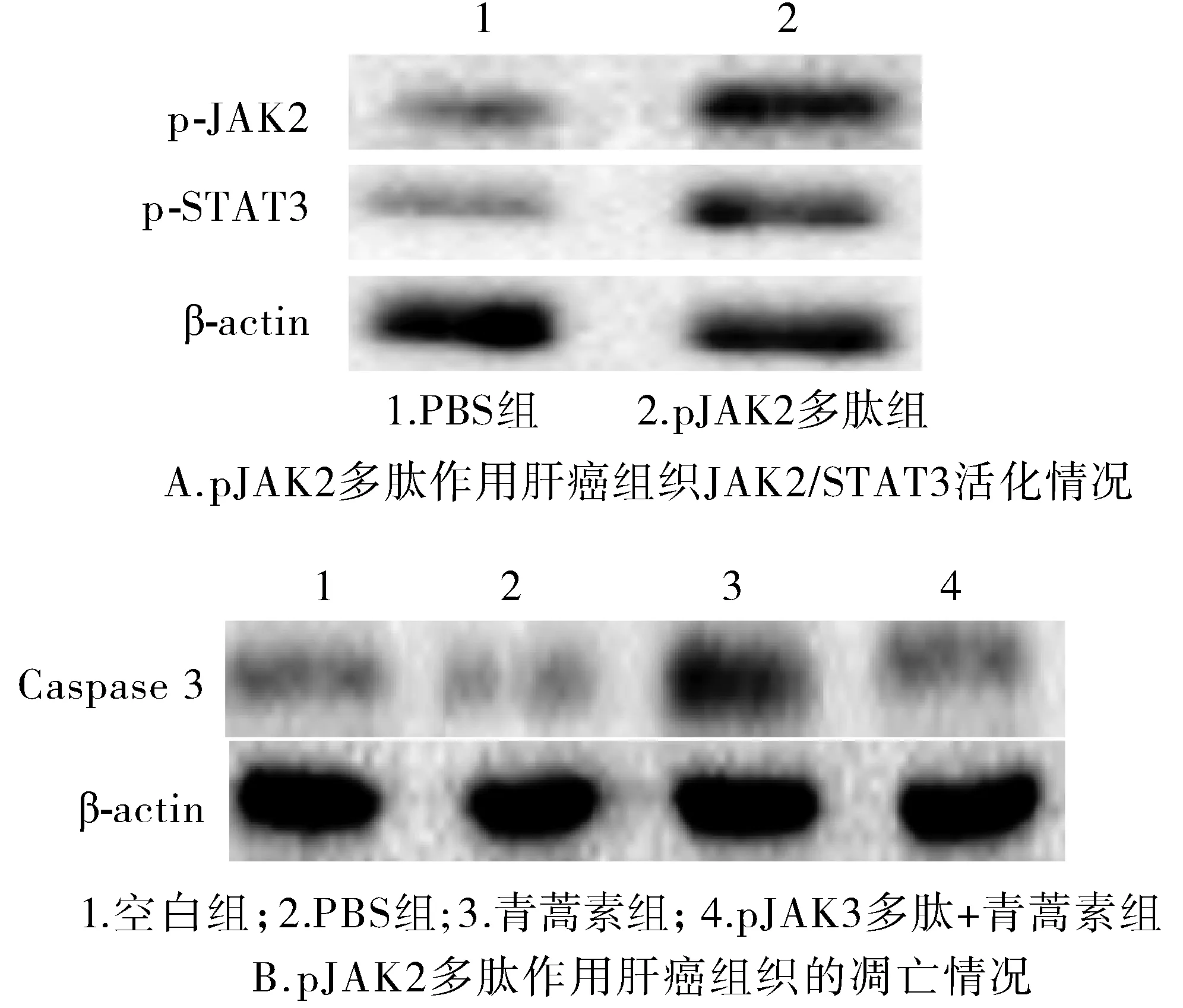
图3 pJAK2多肽激活JAK2/STAT3后细胞的凋亡情况Figure 3 Apoptosis after JAK2/STAT3 activation induced by pJAK2 polypeptide
3 讨论
肝癌是我国常见的恶性肿瘤之一,病死率极高。目前,治疗肝癌的化疗药物主要是以细胞毒性药物为主。细胞毒性药物不仅杀死肝癌细胞,而且正常的肝细胞也受到损害。因此,寻找治疗效果好、毒副作用小的抗肝癌药物成为研究热点。青蒿素是我国首次发现的,具有很强的抗疟活性的药物。近年来又发现青蒿素类药物具有较强的抗肿瘤作用[4]。研究发现,青蒿素作用荷瘤小鼠后,可以使荷瘤小鼠肿瘤得到显著抑制,同时小鼠的生存时间可以明显延长[5]。本研究成功构建小鼠肝癌模型,通过青蒿素作用荷瘤小鼠后发现,小鼠肿瘤组织的凋亡显著增加。因此,我们认为肝癌细胞对青蒿素具有良好的凋亡敏感性。
JAK2/STAT3信号通路是细胞因子激活相关的信号转导通路,主要参与细胞增殖、分化、凋亡以及免疫调节等过程。越来越多的研究发现JAK/STAT信号通路在多种肿瘤组织中被异常激活而高表达[6]。研究发现,JAK/STAT3 信号通路在多种肝癌细胞系中均有异常活化[7]。JAK/STAT 信号通路过度活化在肝细胞性肝癌的发生和发展过程中起重要作用,并作为评价肝细胞性肝癌恶性程度及预后的重要生物学指标[8]。为了验证青蒿素诱导肝癌细胞凋亡是否与JAK2/STAT3信号通路有关联,青蒿素作用后JAK2/STAT3的表达情况首先被检测,结果证明青蒿素可以显著抑制JAK2/STAT3的活化。那么,青蒿素的这种抑制作用是否就是其诱导凋亡的机制呢?pJAK2多肽激活JAK2/STAT3信号通路使结果得到进一步验证。当JAK2/STAT3信号通路被持续激活后,青蒿素抑制JAK2/STAT3信号活化被阻断,结果显示青蒿素诱导的凋亡作用被明显的抑制,因此我们认为青蒿素主要通过抑制JAK2/STAT3信号通路的活化来发挥抗肿瘤作用。
综上所述,青蒿素抗肝癌细胞活性主要通过抑制JAK2/STAT3信号活化发挥作用,进一步拓宽了对青蒿素抗肿瘤的认识,为增强其抗肿瘤活性提供了基础。
[1] Zhao Y,Wang Q,Deng X,etal.Quantitative assessment of the association between GSTP1 gene Ile105Val polymorphism and susceptibility to hepatocellular carcinoma[J].Tumor Biol,2013,34(4):2121-2126.
[2] 郑绍琴,刘亚军,宋健平,等.青蒿素对小鼠Lewis肺癌的抑制及TNF-α和IFN-γ的影响[J].江西中医药,2014,45(9):20-23.
[3] 盛庆寿,王武,郭洪武.双氢青蒿素对原发性肝癌大鼠的治疗作用及机制[J].中国实验方剂学杂志,2014,20(14):150-154.
[4] 张宇祥,呼彩莲,张彩莲.双氢青蒿素对肺癌抑制作用的研究进展[J].当代医学,2008,14(1):35-36.
[5] 万成亮,蒋永新,寸英丽,等.蒿甲醚与顺铂联用对Lewis肺癌小鼠的抑瘤作用及其机制探讨[J].昆明医学院学报,2011,32(3):21-26.
[6] Kowshik J,Baba AB,Giri H.Astaxanthin inhibits JAK/STAT-3 signaling to abrogate cell proliferation,invasion and angiogenesis in a hamster model of oral cancer[J].PLoS One,2014,9(10):e109114.
[7] Wei RC,Cao X,Gui JH,etal.Augmenting the antitumor effect of TRAIL by SOCS3 with double-regulated replicating oncolytic adenovirus in hepatocellular carcinoma[J].Hum Gene Ther,2011,22(9):1109-1119.
[8] 张斌,钟德玝,王群伟,等.JAK/STAT信号通路与肝细胞性肝癌的肿瘤进展和预后的相关性研究[J].细胞与分子免疫学杂志,2010,26(4):368-370.
Effect of artemisinin inhibiting JAK2/STAT3 pathway on apoptosis of hepatocellular carcinoma cells
GUO Jiapei, GUO Bin, LI Leilei, LIU Dianxing, SHI Jun, WU Jinghua*
(DepartmentofLaboratoryMedicine,AffiliatedHospitalofNorthChinaUniversityofScienceandTechnology,Tangshan063000,China;*Correspondingauthor,E-mail:tswujinghua@163.com)
ObjectiveTo explore the anti-tumor mechanism of artemisinin by investigating effects of artemisinin on JAK2/STAT signal patway in the hepatocellular carcinoma(HCC).MethodsThe C57BL/6J HCC model mice were induced with diethylnitrosamine(DEN) injection and intragastric administration of CCl4.Fifteen HCC model mice were randomly divided into PBS group, artemisinin group and polypeptide+artemisinin group, and 5 normal mice were used as control group. The mice were intraperitoneally injected with PBS and artemisinin(100 mg/kg) for three weeks in PBS group and artemisinin group, respectively, and then the mice were killed. Mice in polypeptide+artemisinin group were killed after intraperitoneal injection of polypeptide[100 μmol/(L·kg)] every other day for one week and then treatment with artemisinin for three weeks. After tumor tissues were separated, the expression of caspase 3 in tumor tissues was detected by Western blot, and the expression of p-JAK2 and p-STAT3 was measured with immunofluorescence histochemistry.ResultsThe C57BL/6J mice of HCC models were successfully constructed. The expression of Caspase 3 was significantly increased in tumor tissues after treated with artemisinin(P<0.001), while the p-JAK2 and p-STAT3 were decreased significantly(P<0.05). Compared with artemisinin group, Caspase 3 expression was decreased significantly after preconditioning with pJAK2 in polypeptide+artemisinin group(P<0.05).ConclusionArtemisinin may play a vital role in anti-tumor by inducing the apoptosis of hepatocellular carcinoma cells through inhibiting the activation of JAK2/STAT3 signal pathway.
hepatocellular carcinoma(HCC); artemisinin; JAK2/STAT3; apoptosis
河北省自然科学基金资助项目(H2016209007)
郭佳培,女,1991-02生,在读硕士,初级检验师,E-mail:806364261@qq.com
2016-11-24
R735.7
A
1007-6611(2017)02-0097-04
10.13753/j.issn.1007-6611.2017.02.001
——青蒿素

