黄芪花中主要化学成分的定性及定量分析
王桂臻, 郝 霞, 刘 磊, 李震宇, 秦雪梅,李 科*
(1山西大学中医药现代研究中心,太原 030006; 2山西大学化学化工学院; *通讯作者,E-mail: like@sxu.edu.cn)
黄芪花中主要化学成分的定性及定量分析
王桂臻1,2, 郝 霞1,2, 刘 磊1,2, 李震宇1, 秦雪梅1,李 科1*
(1山西大学中医药现代研究中心,太原 030006;2山西大学化学化工学院;*通讯作者,E-mail: like@sxu.edu.cn)
目的 对黄芪花中主要化学成分进行定性及定量分析,为充分利用丰富的药用植物资源提供依据。 方法 该研究采用GC-MS对黄芪花中的糖类和氨基酸类化学成分进行分析以及采用HPLC对黄酮类、皂苷类等化学成分进行定性及定量分析。 结果 经测定,黄芪花中含有6种黄酮类成分、2种皂苷类成分、丰富的糖类成分和17种氨基酸成分。 结论 黄芪花中含有黄酮类、皂苷类、糖类、氨基酸类等多种有效化学成分,这可以为黄芪花的资源开发利用提供参考依据。
黄芪花; 化学成分; 定性分析; 定量分析
黄芪为豆科植物膜荚黄芪[Astragalusmembranaceus(Fisch.)Bunge]或蒙古黄芪[A.membranaceus(Fisch.)Bunge var.mongholicus(Bunge)Hsiao]的干燥根[1],始载于《神农本草经》,临床应用非常广泛,近年来对于黄芪的化学成分、药理作用的研究已有大量报道[2]。黄芪在唐代《新修本草》、宋代《本草图经》及明代《本草纲目》均有记载,其味甘,性微温,归肺、脾、肾经,具有利水消肿、生肌托搭、固脱敛汗、固表益气的功效[3]。
传统蒙古黄芪为多年生草本植物,为山西恒山山脉野生或仿野生种植,一般需要生长6年以上采挖,根部入药,因此在黄芪入药时地上部分大多被丢弃,造成大量的资源浪费[4]。目前已有研究发现黄芪地上部分的主要化学成分如氨基酸类、黄酮类、皂苷类及糖类等和根部类似[5],而且其中一些化学成分含量高于传统用药部位根部[6]。对茎叶的利用会影响根的产量和质量,黄芪植物从种子萌芽的第二年即每年开花结果,资源丰富,对花和果实的采摘会减少植物的营养消耗,更有利于根的生长。
在我国黑龙江地区,人们有食用黄芪叶和花的习惯,认为它们也有一定的营养价值与疗效。但目前尚未见有关黄芪花化学成分的全面系统的研究报道。因此,本课题组选取黄芪花为研究对象,对其主要化学成分进行定性和定量分析,以期为黄芪的综合开发利用提供依据,避免资源浪费。
1 材料
1.1 仪器
气相色谱-质谱联用仪(Thermo Finnigan离子阱GC/MS);高效液相色谱仪[Waters e2695高压泵、Waters2689紫外可见检测器、蒸发光散射(Chromachem ELSD)检测器、Empower色谱工作站];Sartorius BSA124S分析天平。真空冷冻干燥仪(宁波新芝科技有限公司TGL-16型);真空旋转蒸发仪RE-52A;高效液相色谱仪(依利特P230);示差检测器(Shodex RI-201H);高速冷冻离心机(ZD-A1L);SHK-99-Ⅱ型台式恒温摇床等。
1.2 试剂
三氟乙酸(TFA);二甲基亚砜(DMSO);1-甲基咪唑;乙酸酐;二氯甲烷;氯仿;硼氢化钠;正己烷;吡啶;无水乙醇;正丁醇;甲醇,氯甲酸乙酯(ECF)等均为分析纯,乙腈为色谱纯(美国Fisher公司);娃哈哈纯净水。20种氨基酸标品(批号为140624-201506)购买自中国生物制品检定所;右旋糖酐标准品(2500,4600,7100,10000,21400,41100,84400,133800)(批号为140638-140645)购买自中国生物制品检定所,Dextran 270000(BCBN4623V)购自Sigma公司。DEAE-Cellulose 52购自北京索莱宝科技有限公司。8种单糖标准品(葡萄糖、半乳糖、甘露糖、果糖、木糖、阿拉伯糖、岩藻糖、鼠李糖)与9种糖醇标准品(山梨醇、半乳糖醇、甘露醇、木糖醇、阿拉伯糖醇、岩藻糖醇、鼠李糖醇、肌醇、核糖醇)均购自Sigma公司(批号依次为158968,G5388,M2069,F2543,1722005,605425,R3875,S1876,G0049000,M9546,X3375,L1326,G4325,43434,E3445,D3245,I5125)。1-10号对照品:毛蕊异黄酮葡萄糖苷;芒柄花素;(6aR,11aR)-9,10-二甲氧基紫檀烷-3-O-β-D-葡萄糖苷;7,2′-二羟基-3′,4′-二甲氧基异黄烷-7-O-β-D-葡萄糖苷;黄芪皂苷Ⅰ、Ⅱ、Ⅲ、Ⅳ(均购于上海永恒生物科技有限公司,批号依次为20120428、20120528、20120515、20100202、20111125、20110503、20120411、20120315);芒柄花苷;毛蕊异黄酮(购于成都曼斯特公司,批号依次为13021808、13082713)。
本实验所需植物材料为山西浑源传统蒙古黄芪的花,将处于盛花期的植物花朵摘下,晾干,粉碎后置于阴凉处备用。植物样品由山西大学秦雪梅教授鉴定,标本保存于山西大学中医药现代研究中心。
2 方法与结果
2.1 黄芪花中黄酮与皂苷类成分测定
2.1.1 黄芪花供试品溶液的制备 参照文献[7]方法,取黄芪花中粉约3.0 g,置圆底烧瓶中,加甲醇120 ml,水浴回流提取3 h,滤过,回收溶剂至干,残渣加甲醇溶解,定容至5 ml容量瓶中,加甲醇至刻度,摇匀,即得。
2.1.2 色谱条件 流动相为乙腈(A)-水(B),体积流量1.0 ml/min,蒸发光检测器参数:N2压力为156 kPa,雾化温度为35 ℃,汽化温度为50 ℃,增益值为5.0,Venusil MP C18色谱柱(250 mm×4.6 mm,5 μm),紫外检测波长230 nm,柱温25 ℃,进样量20 μl。梯度洗脱:0-8 min,20%A;8-15 min,30%A;15-30 min,43%A;30-40 min,60%A;40-50 min,100%A;50-60 min,100%A;60-65 min,20%A。
2.1.3 混合对照品溶液的制备 10种标准品分别为毛蕊异黄酮苷,芒柄花苷,(6aR,11aR)-9,10-二甲氧基紫檀烷-3-O-β-D-葡萄糖苷,7,2′-二羟基-3′,4′-二甲氧基异黄烷-7-O-β-D-葡萄糖苷,毛蕊异黄酮,芒柄花素,黄芪皂苷Ⅳ,黄芪皂苷Ⅲ,黄芪皂苷Ⅱ,黄芪皂苷Ⅰ。分别精密称10种对照品适量,置于10 ml容量瓶中,用甲醇溶解,摇匀,定容,分别制成935.0,680.0,681.0,601.0,522.0,627.0,979.0,250.0,582.0,986.0 μg/ml的对照品贮备液。再分别吸取适量至25 ml容量瓶中,定容,制成浓度分别为200.09,85.6,141.2,60.1,29.2,12.5,62.7,45.8,55.9,164.0 μg/ml的混合对照品溶液。
2.1.4 标准曲线的绘制 标准曲线的绘制过程中,至少包含5个浓度梯度,将以上配制的对照品贮备液分别逐级稀释。1号对照品,对照品浓度系列分别为原浓度的1,1/2,1/4,1/8,1/16,1/32,1/64;2,3,5,6号对照品,对照品浓度系列分别为原浓度的1/2,1/4,1/8,1/16,1/32,1/64;4号对照品,对照品浓度系列分别为原浓度的1/2,1/4,1/8,1/16,1/32;7,8号对照品,对照品浓度系列分别为原浓度的1,1/2,1/4,1/8,1/16,1/32。过0.45 μm滤膜后,进样20 μl。绘制标准曲线,得回归方程及其线性范围,见表1。
2.1.5 方法学考察
2.1.5.1 系统适应性试验将混合对照品溶液与黄芪花供试品溶液20 μl分别注入液相色谱仪,理论塔板数以芒柄花素峰算不低于4 000,对照品溶液和样品溶液色谱图中的各峰之间的分离度大于1.5,见图1。
2.1.5.2 精密度试验吸取混合对照品溶液,连续进样6次,以10种成分的峰面积值计。计算RSD值,结果见表1。
2.1.5.3 重复性试验精密称取同一批黄芪样品6份,按2.1.1项下方法制备供试品溶液,按2.1.2项下色谱条件进样分析。计算RSD值,结果见表1。
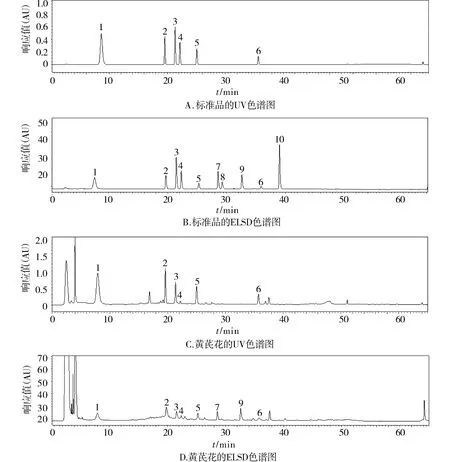
1.毛蕊异黄酮葡萄糖苷;2.芒柄花苷;3.(6aR, 11aR)-9,10-二甲氧基紫檀烷-3-O-β-D-葡萄糖苷;4.7,2 ′-二羟基-3′,4′-二甲氧基异黄烷-7-O-β-D-葡萄糖苷;5.毛蕊异黄酮;6.芒柄花素;7.黄芪甲苷;8.黄芪皂苷Ⅲ;9.黄芪皂苷Ⅱ;10.黄芪皂苷Ⅰ图1 对照品及供试品的HPLC图谱Figure 1 HPLC Chromatograms of reference substances and samples
2.1.5.4 稳定性试验取同一批黄芪药材,按2.1.1项下方法制备供试品溶液,分别于0,2,4,6,8,10,12,24 h后进样分析。计算RSD值,结果见表1。
2.1.5.5 加样回收率试验取已知成分含量的黄芪药材,精密称定1.5 g,按样品中已知成分含量的50%、100%和150%分为高中低三个组,每组三个平行样品,一共9份样品。每组加入一定量的对照品,按2.1.1项下方法制备供试品溶液,进样。计算RSD值,结果见表2。回收率计算公式如下:回收率(%)=(实测值-供试品中含有量)/加入对照品量×100%。
由表1标准品及供试品的线性回归、精密度、重复性、稳定性试验结果及表2加样回收率实验结果可见,线性回归、精密度、重复性、稳定性试验RSD均小于3%。加样回收率实验中RSD小于 5%。因此,该方法稳定性好、重复性好,可靠,可用于黄酮及皂苷的测定。
2.1.6 黄芪花中黄酮和皂苷类成分测定 按照上述方法制备黄芪花供试品溶液,并进样分析,按如下方法计算含量。
对黄酮类成分,对照品溶液和供试品溶液分别进样20 μl,测定,公式如下:M待测样=M标准品×A待测样/A标准品,其中,M为质量,A为峰面积。
对皂苷类成分,将对照品溶液分别进样10 μl和20 μl,供试品溶液进样20 μl,用外标两点法测定含量,公式如下:lgA=blgM+lga,其中,M为质量,A为峰面积,a、b为常数。
表1 黄芪花8种化学成分的线性回归、精密度、重复性、稳定性试验
Table 1 Linear equation,precision,repeatability and stability of 8 components in Astragalus flower
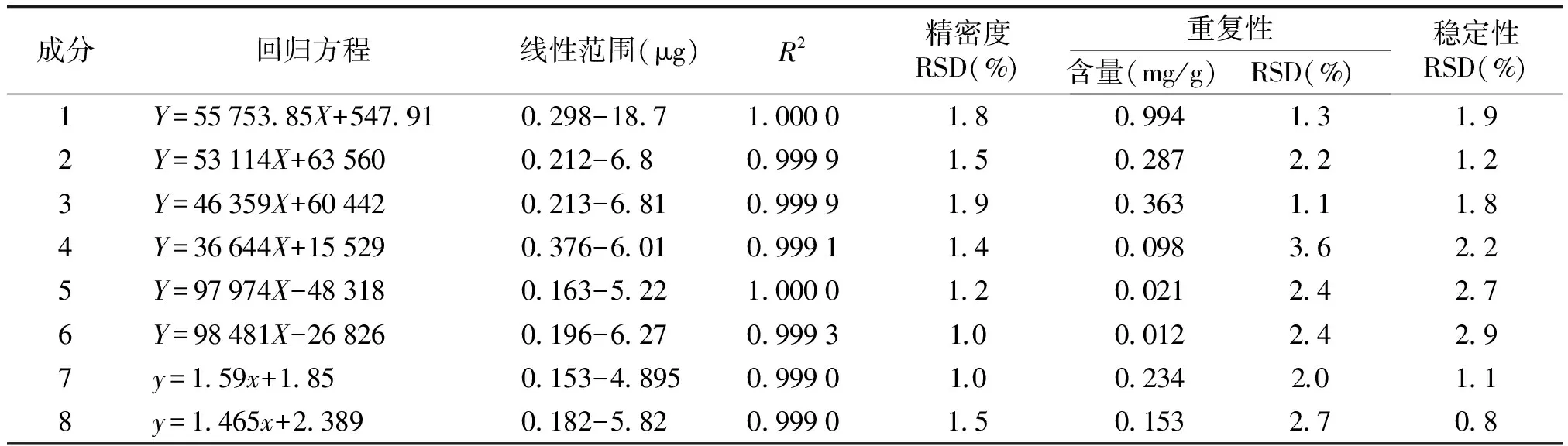
成分回归方程线性范围(μg)R2精密度RSD(%)重复性含量(mg/g)RSD(%)稳定性RSD(%)1Y=55753 85X+547 910 298-18 71 00001 80 9941 31 92Y=53114X+635600 212-6 80 99991 50 2872 21 23Y=46359X+604420 213-6 810 99991 90 3631 11 84Y=36644X+155290 376-6 010 99911 40 0983 62 25Y=97974X-483180 163-5 221 00001 20 0212 42 76Y=98481X-268260 196-6 270 99931.00 0122 42 97y=1 59x+1 850 153-4 8950 99901.00 2342.01 18y=1 465x+2 3890 182-5 820 99901 50 1532 70 8
对于6种黄酮类成分,横坐标为进样量(X),纵坐标为峰面积(Y);对于2种皂苷成分,以进样量的对数(x)为横坐标,峰面积的对数(y)为纵坐标
表2 回收率测定试验 (n=6)
Table 2 The recovery test (n=6)

成分编号50%100%150%平均回收率(%)RSD(%)平均回收率(%)RSD(%)平均回收率(%)RSD(%)1100 22 499 32 897 72 02100 91 698 61 1100 52 1399 20 3102 12 299 20 54100 50 6101 31 3100 60 9599 33 099 32 8102 23 4697 14 399 92 397 23 57100 61.097 11 5101.01 3899 41 499 71 2103 12 2
实验结果表明,黄芪花中含有毛蕊异黄酮苷、芒柄花苷、紫檀烷苷、异黄酮苷、毛蕊异黄酮、芒柄花素6种黄酮类成分及黄芪皂苷Ⅳ,黄芪皂苷Ⅱ两种皂苷类成分(见表3)。
表3 黄芪样品中8种成分的含量 (n=3)
Table 3 Contents of 8 components of Astragalus samples (n=3)

编号名称含量(mg/g)百分含量(%)1毛蕊异黄酮苷0 7270 07272芒柄花苷0 9250 09253紫檀烷苷0 0540 00544异黄酮苷0 1490 01495毛蕊异黄酮0 0420 00426芒柄花素0 0120 00127黄芪甲苷0 0740 00748黄芪皂苷Ⅱ0 0620 0062
2.2 黄芪花中多糖分子量测定
2.2.1 黄芪花粗多糖的提取 黄芪花药材,粉碎,取中粉约5.0 g,精密称定,置于1 000 ml圆底烧瓶中,第一次加500 ml蒸馏水,回流提取1 h,取上清。残渣中加400 ml蒸馏水再次回流提取1 h,合并两次提取液,旋转蒸发浓缩,定容至100 ml容量瓶中。加入无水乙醇配成含醇量80%的溶液。静置过夜,3 000 r/min离心5 min,沉淀用90 ml蒸馏水复溶,得粗多糖溶液。
2.2.2 除去粗多糖中的蛋白质 参照文献[8]方法,将90 ml粗多糖溶液倒入150 ml锥形瓶中,加入氯仿-正丁醇(预先配制成体积比4 ∶1混合液)溶液,料液比3 ∶1,充分振摇30 min后,静置,收集氯仿相。水相中再加入相当于1/3水相体积的氯仿-正丁醇溶液,重复上述过程两次。将两次分离的氯仿相合并,加少量蒸馏水洗涤,共洗涤三次,洗涤液与水相合并,即得到粗多糖溶液,冷冻干燥,备用。
2.2.3 分离纯化粗多糖 参照文献[9]方法,精密称定0.20 g粗多糖,蒸馏水溶解,DEAE-纤维素52柱色谱分离,分别用蒸馏水,0.3 mol/L的NaCl,0.1 mol/L的NaOH 各300 ml洗脱,流速为0.6 ml/min,每10 min收集1管。用苯酚-硫酸法在490 nm处测定吸光度值,绘制洗脱曲线,收集各洗脱峰组分,浓缩,透析,冷冻干燥。
2.2.4 标准曲线制作 参照文献[10]方法,精密称定多糖标准品Dextran 2500,Dextran 4600,Dextran 7100,Dextran 10000,Dextran 21400,Dextran 41100,Dextran 84400,Dextran 133800,Dextran 270000分别置于10 ml容量瓶中,娃哈哈纯净水定容至刻度,配制成2 mg/ml的标准溶液。精密吸取20 μl进样,测得各标准品的保留时间。以保留时间为横坐标,分子量的对数为纵坐标,绘制标准曲线。色谱柱:凝胶柱(TSK gel G4000PWXL(10)7.8*300);进样量20 μl;检测器:示差检测器,34 ℃;柱温35 ℃;流速0.3 ml/min;流动相:娃哈哈纯净水。
DEAE-纤维素52柱色谱分离后,共得到3个组分Asp-1,Asp-2和Asp-3,其中Asp-1和Asp-2两组分含量较多。按照2.2.4所示的方法进样分析,以分子量为2 500,4 600,7 100,41 100,84 400,133 800等葡聚糖标准品得到的标准曲线,见图2,标准曲线方程为y=-0.234 42x+11.826,R2=0.999 26,线性关系良好(见图2)。依次将Asp-1,Asp-2,Asp-3三个组分进样分析,实验结果见图3。将保留时间代入标准曲线方程,通过计算得出水洗脱组分的分子量范围为3 kD以下,NaCl洗脱组分的分子量范围为为270 kD以上,NaOH洗脱组分的分子量范围为3-10 kD。所以猜测黄芪花多糖分子量的主要分布范围是3 kD以下及270 kD以上。
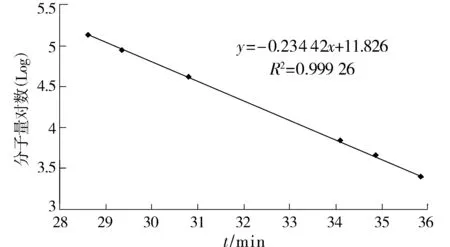
图2 多糖分子量标准曲线图 Figure 2 Standard curve of molecular weight of polysaccharides
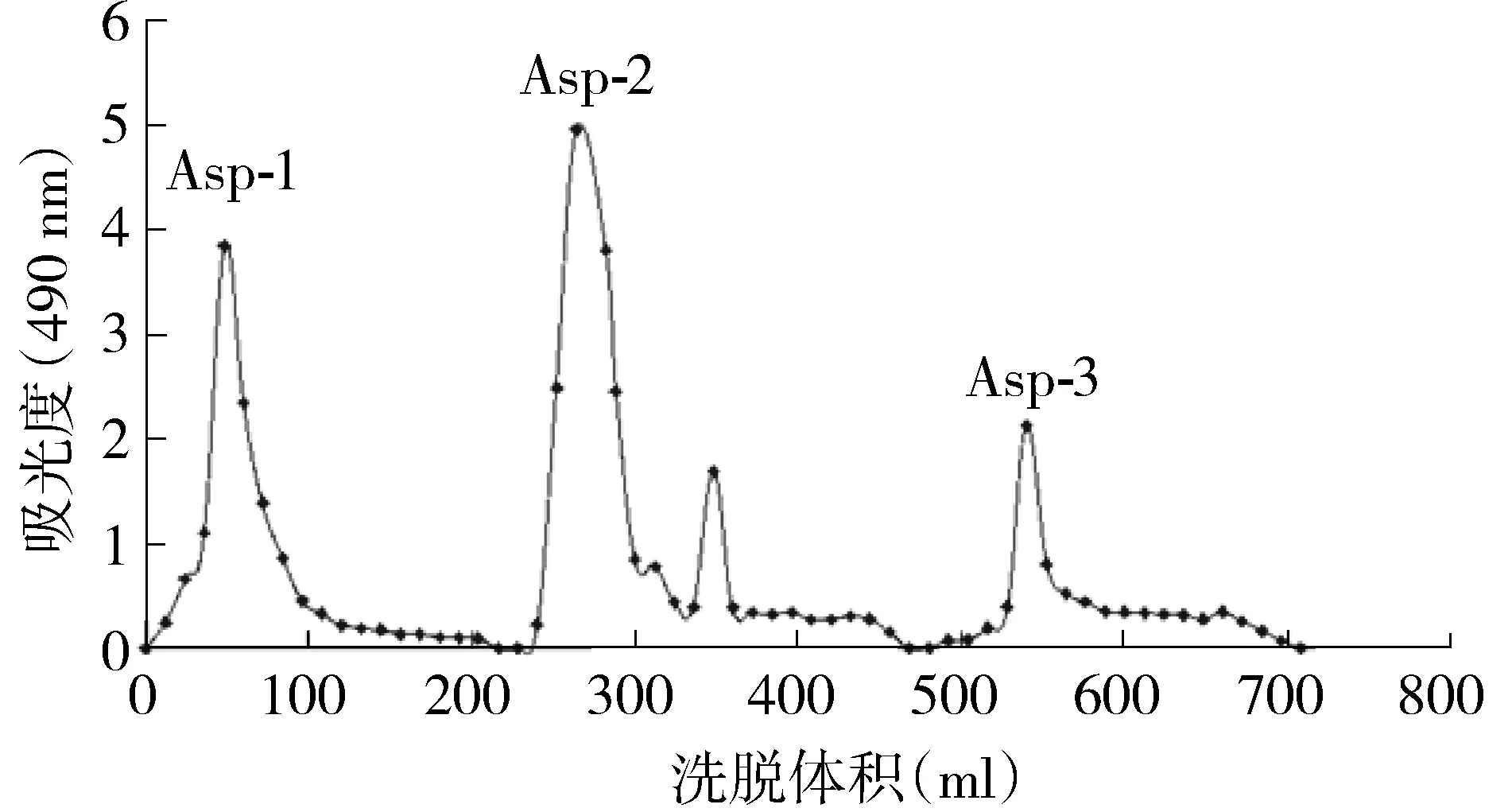
Asp-1为蒸馏水洗脱组分;Asp-2为0.3 mol/L氯化钠洗脱组分;Asp-3为0.1 mol/L氢氧化钠洗脱组分图3 DEAE-52纤维素柱洗脱曲线图Figure 3 DEAE-52 cellulose column elution curve
2.3 黄芪花中多糖的单糖组成测定
2.3.1 气相色谱-质谱(GC-MS)条件 气相条件:DB-5毛细管柱(30 m×0.5 mm×0.25 μm);载气:高纯氦;流速1.0 ml/min;分流比10 ∶1;进样口温度220 ℃;程序升温:起始温度100 ℃,5 ℃/min升至180 ℃,保持1 min,1 ℃/min升至190 ℃,保持2 min,30 ℃/min升至220 ℃,保持2 min,1 ℃/min升至230 ℃,保持2 min,20 ℃/min升至280 ℃,保持10 min。
质谱条件:Xcalibur 2.0.7工作站,电子轰击(EI)离子源,离子源温度220 ℃,传输线温度250 ℃,扫描模式Full Scan;质量扫描范围m/z 45-550。
2.3.2 黄芪花多糖的酸水解 精密称取黄芪花多糖粉末(Asp-1,Asp-2和Asp-3)5.00 mg分别置于10 ml具塞玻璃管中,加入500 μl,2 mol/L的TFA,120 ℃水解1.5 h,氮气吹干,加甲醇复溶,氮气吹干。加入1 ml 2% NaBH4-DMSO溶液,40 ℃摇床反应90 min,加入乙酸调pH值至中性。再向溶液中加入200 μl的乙酸酐和50 μl的1-甲基咪唑,涡旋,反应10-15 min,加入500 μl的蒸馏水终止反应,加入500 μl的二氯甲烷,涡旋,离心,取下层,重复萃取2次,合并有机相,吹干,备用。
2.3.3 标准品的衍生化 参照文献衍生化方法[11],分别称取8种单糖及对应的糖醇标准品,溶于0.1 mg/ml的核糖醇-二甲亚砜溶液中。以1-甲基咪唑为催化剂,乙酸酐为乙酰化试剂,衍生化反应10 min。取蒸馏水终止反应,二氯甲烷萃取两次,合并有机相,吹干后,复溶于二氯甲烷中,0.22 μm有机滤膜过滤,取1 μl滤液注入GC-MS,得到单糖及糖醇标准品的GC-MS色谱图(见图4)。以核糖醇为内标,加入含核糖醇 1%,10%,30%,50%,80%,根据下列公式分别求算核糖醇的标准曲线及各标准品与核糖醇的相对校正因子。标准曲线计算公式:lgms=algAs+b,相对校正因子计算公式:f=(ms/mi)·(Ai/As),其中mi、ms分别表示待测糖和内标的质量,Ai、As分别表示待测糖和内标的峰面积,f表示待测糖和内标的相对校正因子。单糖及其糖醇标准品测定结果见表4。
经测定,DEAE-52纤维素柱洗脱得到的三个组分中,蒸馏水洗脱组分ASP-1中含有岩藻糖、葡萄糖、甘露糖。NaCl洗脱组分ASP-2中主要有木糖、鼠李糖、阿拉伯糖、甘露糖、半乳糖。NaOH洗脱组分ASP-3中主要有岩藻糖、阿拉伯糖、半乳糖、甘露糖、葡萄糖。
2.4 黄芪花中氨基酸成分测定

图4 DEAE-52纤维素柱各洗脱组分单糖组成总离子流图Figure 4 The monosaccharide composition of DEAE-52 cellulosic column elution component
2.4.1 氨基酸标准品的制备 参照文献[12]方法略有改进,取20种氨基酸标准品,加蒸馏水配成浓度1 mg/ml的溶液,各取1 ml,分别加入400 μl的无水乙醇,100 μl的吡啶,50 μl的氯甲酸乙酯(ECF),20 ℃ 40 kHz超声1 min,立即用500 μl正己烷萃取,涡旋,3 000 r/min离心,取上清。用7 mol/L的NaOH约100 μl调整pH 值为9-10,再加入50 μl的氯甲酸乙酯(ECF)进行二次衍生化,超声1 min,500 μl正己烷萃取,涡旋30 s,3 000 r/min离心10 min,取上清,合并上清,氮气吹干。用100 μl氯仿复溶,混合所有标准品的衍生化产物,氮气吹干。100 μl复溶,加入少量无水硫酸钠,0.22 μm微孔滤膜滤过,0.2 μl进样分析。
2.4.2 供试品溶液制备 黄芪花药材粉碎后,称取10 g黄芪花粗粉,加入70%乙醇溶剂300 ml,加热回流提取,提取时间为3 h,料液比为1∶30。旋转蒸发浓缩后用蒸馏水定容于100 ml容量瓶。
2.4.3 黄芪花中氨基酸衍生化 取氨基酸样品1 ml,参照标准品的衍生化方法进行衍生化。
气相条件:DB-5毛细管柱(30 m×0.5 mm×0.25 μm);载气:高纯氦;流速1.0 ml/min;分流比10 ∶1;进样口温度220 ℃;程序升温:起始温度80 ℃,保持2 min。10 ℃/min升至140 ℃,保持1 min,4 ℃/min升至240 ℃,保持1 min,5 ℃/min升至280 ℃,保持5 min。
质谱条件:同2.3.1中所述的质谱条件。
表4 单糖及糖醇标准品的测定
Table 4 Detection of standard monosaccharides and alditols

编号名称保留时间(min)回收率(%)RSD(%)检出限(mol/L)校正因子f1木糖20.8694.241.342.5×10-80.522岩藻糖21.0295.491.787.6×10-90.743鼠李糖21.0891.113.459.1×10-80.684阿拉伯糖21.2097.780.971.1×10-70.845鼠李糖醇24.8294.111.284.6×10-80.346核糖醇24.9399.043.223.4×10-81.007岩藻糖醇25.3496.833.419.2×10-80.378阿拉伯糖醇25.5394.772.255.8×10-80.719木糖醇26.2192.161.664.2×10-81.0910果糖30.6095.962.691.7×10-70.5511半乳糖31.1496.212.236.3×10-81.0112甘露糖31.2598.353.716.6×10-80.8513葡萄糖31.5894.183.676.9×10-80.9514肌醇31.8896.164.285.6×10-90.8215甘露醇33.2396.601.435.5×10-90.8416山梨醇33.3295.512.191.2×10-80.7017半乳糖醇33.7396.891.451.9×10-80.72
RSD(relative standard deviation):相对标准偏差
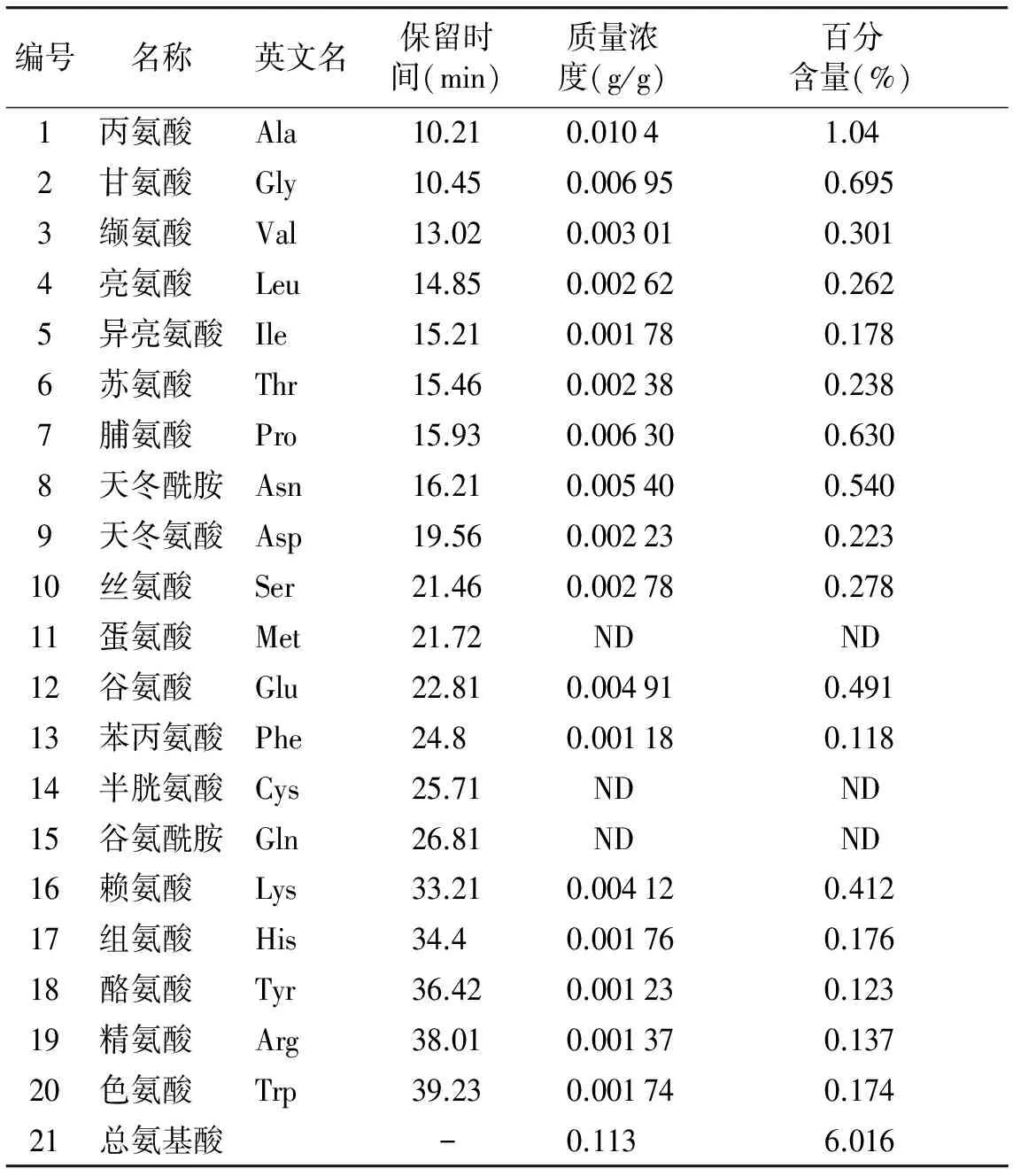
按照2.4所示方法提取测定黄芪花中的氨基酸,其总离子流图见图5,各氨基酸含量见表5。
经测定,黄芪花中含有17种氨基酸,其中有2种酸性氨基酸,3种碱性氨基酸,12种中性氨基酸。总氨基酸含量为6.016%。由氨基酸总离子流图说明此方法测定氨基酸能较好地分离各种氨基酸,并且杂质峰较少。
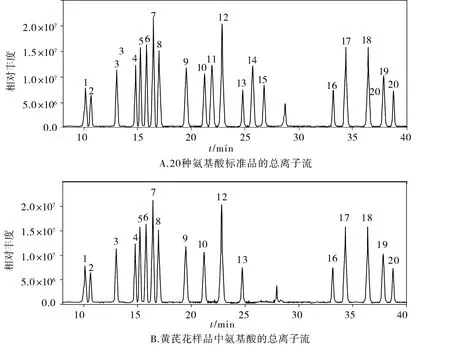
图5 黄芪花中氨基酸总离子流Figure 5 The total ion current of amino acids in Astragalus
表5 黄芪花中氨基酸含量 (n=3)
Table 5 Amino acids in flowers of Astragalus (n=3)
编号名称英文名保留时间(min)质量浓度(g/g)百分含量(%)1丙氨酸Ala10.210.01041.042甘氨酸Gly10.450.006950.6953缬氨酸Val13.020.003010.3014亮氨酸Leu14.850.002620.2625异亮氨酸Ile15.210.001780.1786苏氨酸Thr15.460.002380.2387脯氨酸Pro15.930.006300.6308天冬酰胺Asn16.210.005400.5409天冬氨酸Asp19.560.002230.22310丝氨酸Ser21.460.002780.27811蛋氨酸Met21.72NDND12谷氨酸Glu22.810.004910.49113苯丙氨酸Phe24.80.001180.11814半胱氨酸Cys25.71NDND15谷氨酰胺Gln26.81NDND16赖氨酸Lys33.210.004120.41217组氨酸His34.40.001760.17618酪氨酸Tyr36.420.001230.12319精氨酸Arg38.010.001370.13720色氨酸Trp39.230.001740.17421总氨基酸-0.1136.016
ND(not detected): 样本中未检测到该氨基酸
3 讨论
本文对黄芪花进行了化学成分测定实验,初步确定了其可能含有的化学成分。实验结果表明,黄芪花中含有6种黄酮类成分、2种皂苷类成分、多种糖类成分以及17种氨基酸成分。与根部相比,黄芪花中芒柄花苷、异黄酮苷、毛蕊异黄酮等黄酮类成分含量较高,而毛蕊异黄酮苷、紫檀烷苷、芒柄花素等3种黄酮类成分及黄芪甲苷、黄芪皂苷Ⅱ两种皂苷成分含量较低。黄芪花中共检测到17种氨基酸,总氨基酸含量为6.016%,其中以丙氨酸含量最高,其次为甘氨酸、脯氨酸,除甲硫氨酸未测得外,人体必需氨基酸的含量为1.683%。黄芪与黄芪花中多糖组分均由葡萄糖、甘露糖、岩藻糖、木糖、鼠李糖、阿拉伯糖、半乳糖等单糖组成。通过闫巧娟等[13]测定黄芪多糖的分子量分布,我们发现黄芪多糖与黄芪花多糖分子量的分布范围均主要在3 kD及270 kD以上。实验结果表明,黄芪花具有极好的开发利用前景,为进一步研究开发利用黄芪花资源提供了线索和依据。
大量临床实践与实验研究已证实,黄芪在保健品、食品、化妆品中具有重要的药理作用,并具有剂型多(口服液、冲剂、注射液)、用药方便等优点。随着科学技术的进步,对黄芪花的研究越来越广泛,应用领域也将不断扩大,这对于充分和对资源的可持续利用和开发具有重要的指导意义。
[1] 国家药典委员会.中华人民共和国药典2015版(一部)[M].北京:化学工业出版社,2015:249.
[2] 张娟,陈建宗,张金平,等.黄芪甲甙体外抗乙型肝炎病毒的作用[J].第四军医大学学报,2007,28(24):2291-2293.
[3] 王东娜,宋宏春.黄芪在肿瘤治疗中的减毒增效作用研究概述[J].北方药学,2010,7(2):27-29.
[4] 吴珍,梁宗锁.商洛市木本药用植物种类调查研究[J].西北林学院学报,2008,23(2):53-57.
[5] 赵霞.黄芪炮制品中皂苷成分含量的比较研究[J].光明中医,2011,26(7):1349-1350.
[6] 万国靖,刘洪艳.黄芪根茎叶中黄芪甲苷的含量测定[J].黑龙江医药科学,2008,31(1):22.
[7] 万燕晴.基于化学成分的黄芪药材质量评价研究[D].太原:山西大学,2015.
[8] 张萍,贺茂萍,殷力.石榴皮多糖的Sevage法除蛋白工艺研究[J].食品科技,2013,12(20):219-222.
[9] 闫景坤,李琳,吴建勇.人工培养冬虫夏草胞外多糖的分离纯化研究[J].现代食品科技,2010,26(4):366-369.
[10] 赵颖,宋新波,张丽娟,等.高效凝胶色谱法测定甘草多糖分子量及其分子量分布[J].天津中医药,2015,32(1)46-48.
[11] Li K,Liu S,Tan Y,etal.An optimized GC-MS method to simultaneously quantify acetylated aldose,ketose and alditol for plant tissues based on derivatization in methyl sulfoxide/1-methylimidazole system[J].J Agr Food Chem,2013,61:4011-4018.
[12] Namera A,Yashiki M,Nishida M,etal.Direct extract derivatization for determination of amino acids in human urine by gas chromatography and mass spectrometry[J].J Chromatogr B,2002,776:49-55.
[13] 闫巧娟,韩鲁佳,江正强,等.黄芪多糖的分子量分布[J].食品科学,2004,25(8):27-30.
Qualitative and quantitative analysis of the main chemical components from flowers ofAstragalusmembranaceus
WANG Guizhen1,2, HAO Xia1,2, LIU Lei1,2,LI Zhenyu1, QIN Xuemei1, LI Ke1*
(1ModernResearchCenterforTraditionalChineseMedicine,ShanxiUniversity,Taiyuan030006,China;2CollegeofChemistryandChemicalEngineering,ShanxiUniversity;*Correspondingauthor,E-mail:like@sxu.edu.cn)
ObjectiveTo provide the basis for the full use of the medicinal plants by making qualitative and quantitative analysis of the main chemical components from flowers ofAstragalusmembranaceus.MethodsGC-MS was used to analyze the saccharides and amino acids in flowers ofAstragalusmembranaceus, and HPLC was used to analyze the flavonoids, saponins.ResultsAstragalusmembranaceusflowers contained 6 kinds of flavonoids ingredients, 2 kinds of saponins and sugars, and 17 kinds of amino acid.ConclusionAstragalusmembranaceusflowers contains a variety of chemical composition such as flavonoids, saponins,saccharides and amino acids, which will provide reference for the utilization ofAstragalusmembranaceusflowers.
Astragalus flower; chemical consistent; qualitative analysis; quantitative analysis
国家自然科学基金资助项目(31200278);教育部博士点新教师类基金资助项目(20131401120006)
王桂臻,女,1990-09生,在读硕士,E-mail:1158319787@qq.com
2016-11-11
284.1
A
1007-6611(2017)02-0136-08
10.13753/j.issn.1007-6611.2017.02.010

