液相色谱-质谱联用技术在药物代谢产物鉴定中的应用
李 亮,陈笑艳,钟大放
(中国科学院上海药物研究所药物代谢研究中心,上海 201203)
液相色谱-质谱联用技术在药物代谢产物鉴定中的应用
李 亮,陈笑艳,钟大放
(中国科学院上海药物研究所药物代谢研究中心,上海 201203)
药物代谢研究贯穿药物开发的整个过程。生物基质中药物代谢产物的快速、准确鉴定有助于理解药物或候选化合物的生物转化途径,确定代谢软位点,从而帮助优化先导物结构,筛选出具有更高代谢稳定性的药物。利用亲核性捕获试剂开展体外代谢实验,检测反应性代谢产物的生成,相关结果可以帮助规避候选化合物进入临床后可能产生的毒性风险。由于液相色谱-质谱联用技术(LC/MS)具有分析通量高、检测灵敏度高、选择性好、能提供丰富的结构相关信息等优点,其在药物代谢研究中的作用越来越重要。本工作综述了近年来作者所在实验室采用LC/MS法开展的药物代谢产物鉴定研究,提出了基于LC/MS技术的药物代谢产物鉴定研究的基本流程和药物在人体内的主要代谢产物,可为临床药动学研究和药物相互作用研究提供数据基础。
液相色谱-质谱(LC/MS);代谢产物鉴定;反应性代谢产物;高分辨质谱(HRMS)
药物的吸收、分布、代谢和排泄(ADME)性质影响其成药性、有效性和安全性,药物代谢研究是药物研发过程中的重要环节和内容,贯穿药物发现和开发的全过程,是决定药物是否能上市的关键因素之一。药物代谢产物的追踪和结构鉴定是创新药物ADME试验的核心内容之一,也是药物代谢研究的难点。阐明药物的体内外代谢途径,建立结构-代谢途径的关系,可以指导药物设计和结构优化;发现活性代谢物和毒性代谢物,对于药效学和安全性评价非常重要[1]。
大多数药物代谢途径被认为是去毒过程,即药物在体内药物代谢酶的介导下发生生物转化生成具有更大极性、更高水溶性的代谢产物。与原型药物相比,这些代谢产物的药理活性通常会减弱或者完全消失。但在少数情况下,一些药物和候选化合物在体内药物代谢酶的介导下可能生成反应性代谢中间体,该反应性中间体进一步与蛋白质、DNA等生物大分子发生共价结合,导致细胞损伤从而产生毒性。近年来,筛查新药候选化合物生成反应性代谢物的潜在风险已经引起广泛关注[2-3]。
药物化学结构的多样性和体内生物转化途径的复杂性使得药物代谢产物鉴定研究具有较高挑战性。此外,生物基质中各种内源性物质的干扰和代谢产物本身的低含量进一步提高了快速、准确结构鉴定的难度。液相色谱-质谱联用技术(LC/MS)具备了液相色谱的高分离能力和质谱的高灵敏度及优异的选择性,可以用来开展高通量、高效率的代谢产物鉴定研究,现已逐渐成为药物代谢产物鉴定研究领域的主流方法[4-5]。
本实验室长期开展LC/MS法对药物代谢产物的鉴定研究,分别建立了“基于离子阱质谱的代谢产物鉴定”和“基于超高效液相色谱-高分辨质谱的代谢产物快速鉴定”技术体系。开展了多项从体外、动物体内到人体内的药物代谢产物鉴定工作。本工作将对近年来本实验室采用LC/MS法开展的药物代谢产物鉴定研究进行综述,总结基于该方法的药物代谢产物鉴定的基本流程。
1 基于离子阱质谱仪的代谢产物鉴定研究
在高分辨质谱仪被广泛应用于药物代谢产物鉴定之前,离子阱质谱仪是代谢产物结构分析的首选仪器。由于其独特的离子捕获方式,使用离子阱质谱仪开展代谢产物鉴定实验可以快速地获得高灵敏度的全扫描质谱图和多级质谱信息(MSn),帮助研究者推测原型药物的质谱裂解途径,从而有助于代谢产物的结构确认。由于离子阱质谱仪不能实现中性丢失过滤(NLF)和前体离子过滤(PIF),因此,采用该仪器开展代谢产物鉴定研究时,发现代谢产物的主要手段是基于药物结构推测可能的代谢产物,在总离子流色谱图中提取相关离子,对比测试样品和空白对照样品提取离子流色谱图(EIC)中色谱峰的差异,确认代谢产物的种类和代谢物谱。一些通过特殊代谢途径生成的代谢产物可能会难以发现[4],所以需要研究者对药物代谢反应的类型和药物的化学结构有较深入的了解。采用离子阱质谱仪开展药物代谢产物鉴定研究的基本流程示于图1。
1.1离子阱质谱仪在天然活性成分代谢产物鉴定研究中的应用
采用液相色谱-离子阱质谱法共检测出24种20(S)-原人参二醇(PPD)在人肝微粒体和人肝细胞中的代谢产物[6]。包括22种Ⅰ相代谢物和2种Ⅱ相结合物,主要代谢途径为侧链双键环氧化并分子内重排、羟基化、脱氢和葡萄糖醛酸结合。由于其结构中仅含碳、氢和氧原子,在电喷雾(ESI)离子源正离子检测模式下,PPD的质谱响应较差,在产物离子扫描模式下,主要产生中性丢失水的系列碎片离子,无法提供有效的结构信息。当其侧链部分环化后,在产物离子扫描模式下容易产生m/z143碎片离子,结合高分辨质谱数据,推测其是由侧链部分C—C键断裂所形成的,主要根据m/z143碎片离子是否发生变化及变化的程度来推测氧化和脱氢代谢位点是否位于侧链的四氢呋喃环部分。由于PPD分子中包含较多的手性中心,在氧化代谢时会产生较多的同分异构体,这增加了代谢产物结构鉴定的难度。为了准确鉴定PPD相关代谢产物的结构,从灌胃给药后的大鼠粪样中分离获得了4个主要代谢产物的对照品,采用一维和二维核磁共振波谱(NMR)技术确定其结构分别为(20S,24S)-环氧达玛烷-3,12,25-三醇、(20S,24R)-环氧达玛烷-3,12,25-三醇、(20S,24S)-环氧达玛烷-12,25-二醇-3-酮和(20S,24R)-环氧达玛烷-12,25-二醇-3-酮。在PPD的氧化代谢过程中,细胞色素P450(CYP)3A4介导的双键环氧化是起始步骤,生成一对互为C24-位差向异构体的环氧化代谢产物。采用间氯过氧苯甲酸氧化方法,以LC/MS法检测反应液中各产物含量的实时变化情况,确定了环氧化中间体的结构,深入理解了PPD环氧化产物发生分子内重排的机制。推测的20(S)-原人参二醇在体内外的主要代谢途径示于图2。

注:左侧虚线框为采用离子阱质谱仪的鉴定流程;右侧为采用高分辨质谱仪的鉴定流程图1 基于LC/MS技术开展药物代谢产物鉴定研究的基本流程Fig.1 General workflow using LC/MS for drug metabolite detection and structure elucidation

图2 20(S)-原人参二醇的主要代谢途径Fig.2 Major metabolic pathways of 20(S)-protopanaxadiol
相似的分析策略还成功地应用于人参皂苷20(S)-Rh2的体外代谢种属比较及氧化代谢酶表型鉴定研究,在人、猴、犬、大鼠和小鼠肝微粒体和人肝S9中共检测并鉴定了25种Ⅰ相代谢产物[7]。受离子阱质谱的1/3截止效应的影响,产物离子扫描模式下获得的碎片离子主要来自糖苷键断裂和中性丢失水分子,不能帮助确定准确的代谢位点。采用化学方法合成了7个代谢产物的对照品,采用一维和二维NMR技术确定了化学结构。为了确认代谢过程中环氧中间体的生成,分别以亲核性的谷胱甘肽(GSH)、谷胱甘肽乙酯(GEE)和N-乙酰半胱氨酸为捕获试剂,在人肝S9孵化体系中开展代谢研究。通过LC/MS分析,检测到GSH结合物和GEE结合物,通过分析产物离子扫描质谱图,确定了结合位点。结果表明,20(S)-Rh2在肝中主要发生侧链双键的环氧化并分子内重排、甲基羟基化进一步氧化为醛和羧酸,以及谷胱甘肽结合代谢。
采用液相色谱-离子阱质谱法研究蝙蝠葛碱在人肝微粒体和大鼠胆汁中的代谢产物,通过多级质谱数据(MS2和MS3)分析,鉴定了15个代谢产物的结构,确定蝙蝠葛碱主要发生N-去甲基、O-去甲基、脱氢、羟基化和谷胱甘肽结合等代谢[8]。通过NMR分析化学合成GSH结合物的对照品,确定了结合位点,阐明了蝙蝠葛碱的代谢活化导致肺毒性的机理是对亚甲基酚氧化为亚甲基醌中间体[9-10]。将相同的策略应用于另一双苄基异喹啉生物碱类化合物粉防己碱的生物活化导致肺毒性的机理研究[11]。结果表明,尽管粉防己碱自身不包含对亚甲基酚结构,但是在CYP3A的催化下,粉防己碱可以发生O-去甲基代谢,生成的含有对亚甲基酚结构片段的代谢产物可进一步发生代谢活化,生成对亚甲基醌中间体导致毒性。液相色谱-离子阱质谱法还成功地应用于黄酮类化合物灯盏乙素在人体内的代谢产物鉴定研究[12]。
1.2离子阱质谱仪在化学药物代谢产物鉴定研究中的应用
采用液相色谱-离子阱质谱法鉴定健康受试者口服300 mg抗病毒药物阿比多尔胶囊后尿样中的代谢产物[13]。通过对原型药物进行多级质谱分析(MS2、MS3、MS4、MS5),总结其在ESI源正离子检测模式下的质谱裂解规律。在碰撞诱导解离(CID)实验中,阿比多尔母离子(m/z477)主要发生中性丢失二甲胺分子生成m/z432碎片离子,少量发生中性丢失水分子生成m/z459碎片离子。m/z432碎片离子可进一步发生中性丢失乙醛(-44 u)、苯硫自由基(-109 u)、一氧化碳(-28 u)或者溴自由基(-79 u)等。当硫原子氧化为亚砜后,代谢产物在CID实验中主要发生C—S键断裂(-125 u),进而发生中性丢失二甲胺(-45 u)、乙醛(-44 u)、甲酸乙酯(-109 u)或者乙烯自由基(-29 u)等。亚砜代谢产物进一步发生硫酸结合或者葡萄糖醛酸结合后,代谢产物在CID实验中仍然主要发生C—S键断裂,而非常见的中性丢失三氧化硫(-80 u)或者葡萄糖醛酸(-176 u)。根据上述质谱裂解规律,在服药后的受试者尿样中鉴定出17种代谢产物的结构。结果表明,阿比多尔在受试者体内主要发生硫氧化(生成亚砜进而生成砜)、二甲氨基部分N-去甲基、硫酸结合以及葡萄糖醛酸结合等代谢。
2 基于高分辨质谱仪的代谢产物鉴定研究
基于离子阱质谱仪的代谢产物鉴定流程存在分析周期长,需要多次进样分析,易受生物基质干扰等问题。此外,分析人员的经验也在很大程度上影响代谢产物鉴定研究的结果[4]。在2005年前后,一系列具有高灵敏度、高扫描速度、高分辨率、高质量准确度和高稳定性的商业化质谱仪,如四极杆-飞行时间质谱仪(Q-TOF MS)和轨道离子阱质谱仪(Orbitrap MS)纷纷面世。与之同时,研究人员开发了一些基于高分辨质谱平台的新型数据采集方式(如MSE[14])和数据挖掘工具(如质量亏损过滤(MDF)[15])。这些方法的建立弥补了高分辨质谱不能实现真正NLF和PIF的缺陷,大大提高了代谢产物鉴定研究的准确度和分析通量。基于高分辨质谱平台的代谢产物鉴定研究的流程示于图1。
2.1高分辨质谱仪在天然活性成分代谢产物鉴定研究中的应用
采用超高效液相色谱/四极杆-飞行时间质谱(UPLC/Q-TOF MS)联用技术研究大鼠灌胃给予50 mg/kg天然活性香豆素类化合物蟛蜞菊内酯(WEL)后,血浆、尿、粪和胆汁中的代谢产物[16]。首先对原型药物WEL的质谱裂解途径进行分析,结果表明,在ESI离子源正离子模式下,WEL母离子发生中性丢失水(-18 u)和一氧化碳(-28 u);香豆素母核发生C—C键或者C—O键断裂等裂解途径。最低能量构型分析表明,WEL是一个平面分子,其分子中所有非氢原子均处在同一个平面内。推测在离子源内,WEL分子中氧原子均可结合质子发生离子化,与其在CID实验中发生多种裂解途径的几率接近,因此,产生的碎片离子丰度较为一致。考虑到WEL的结构特点和所分析的生物基质类型,设置了基于多重质量亏损过滤(MMDF)的信息依赖型(IDA)产物离子扫描实验,在一次进样分析中同时获得WEL及其代谢产物的高分辨全扫描质谱图和产物离子扫描质谱图。利用Metabolite Pilot 1.5软件内置的多重峰查找策略筛选可能的代谢产物,确定了各基质中WEL的代谢物谱,共检测到17种代谢产物。利用高分辨质谱数据推测代谢产物的分子式组成,解析产物离子碎片信息,推测代谢位点,确定WEL在大鼠体内主要发生葡萄糖醛酸结合、甲基化、O-去甲基和内酯环开环等代谢。通过分析最低能量下代谢产物分子的平面性对碎片离子种类和丰度的影响,确定了2个甲基化代谢产物异构体的代谢位点。利用液相色谱-在线固相萃取-核磁共振波谱(LC-SPE-NMR)技术从大鼠尿样中分离获得3个对照品,采集一维和二维NMR图谱,鉴定其结构分别为WEL-5-葡萄糖醛酸结合物、11-甲基-WEL-5-葡萄糖醛酸结合物和12-甲基-WEL-5-葡萄糖醛酸结合物。
基于UPLC/Q-TOF MS技术的研究流程还成功地应用于人参皂苷20(S)-Rh2在大鼠体内的代谢产物鉴定研究[17],绿原酸在缓冲液、大鼠血浆和尿中的异构化研究[18],绿原酸在大鼠体内的代谢物鉴定[19],人肝细胞、肝微粒体中绿原酸的代谢活化研究[20],川楝素在大鼠体内的代谢活化研究[21],以及大鼠体内雷公藤甲素代谢产物鉴定研究[22],具体情况示于图3和表1。

图3 开展代谢产物研究的药物化学结构Fig.3 Chemical structures of drugs performed metabolite identification studies
2.2高分辨质谱仪在化学创新药物代谢产物鉴定研究中的应用
采用UPLC/Q-TOF MS法研究了慢性粒细胞白血病患者口服小分子酪氨酸激酶抑制剂氟马替尼后血浆、尿和粪中的代谢产物[23]。采用ESI离子源正离子扫描模式,在一次分析中同时获得样品在高碰撞和低碰撞能量下的全扫描质谱图。首先,对原型药物氟马替尼的质谱裂解途径进行分析,氟马替尼母离子可发生多种断裂,主要碎片离子来自于中性丢失甲基哌嗪环,其他裂解途径还包括不同位置的C—N键断裂。采用MetaboLynx软件进行数据处理,通过与空白样品对照,结合质量亏损过滤功能进行代谢产物的筛选,确定各基质中氟马替尼的代谢物谱,共检测到34种代谢产物。利用低碰撞能量下的高分辨质谱数据推测代谢产物的分子式组成。解析高碰撞能量下的碎片离子信息,推测代谢位点,确定氟马替尼在患者体内主要发生N-去甲基、N-氧化、羟基化、酰胺键水解、葡萄糖醛酸结合、以及乙酰化等代谢。化学合成了7个主要代谢产物的对照品,通过NMR波谱分析确定了化学结构。利用离子阱质谱法(MS2、MS3、MS4、MS5)进一步研究了酰胺键水解代谢产物M3的质谱裂解规律。
基于UPLC/Q-TOF MS技术的研究流程还应用在化学创新药物法米替尼[24]、阿比多尔[25]、阿帕替尼[26]、艾力替尼[27]、丁苯酞[28-29]、MRX-1[30]、奥硝唑[31-32]、胺碘酮[33]、吗啉硝唑[34]、莫非赛定[35]、TPN729[36]、吡咯替尼[37]在人体内的代谢产物鉴定研究,具体情况示于图3和表1。


3 药物代谢产物鉴定研究结果对临床安全用药的指导意义
开展药物代谢产物鉴定研究,阐明药物在体内的生物转化过程及主要的催化酶表型,鉴定血液循环中主要的代谢产物,确定药物从体内排泄的主要形式、途径及速率,可以为保障临床安全用药提供基础资料。
Gao等[34]采用UPLC/Q-TOF MS法鉴定了吗啉硝唑在健康受试者体内的代谢产物,结果表明,吗啉硝唑在人体内主要发生N+-葡萄糖醛酸结合代谢和羟基的硫酸结合代谢,生成一对互为差向异构体的N+-葡萄糖醛酸结合物M8-1和M8-2,以及硫酸结合物M7,示于图4。M7、M8-1和M8-2是受试者血浆中的主要代谢产物,也是静脉注射给药后受试者尿中的主要排泄物质。
鉴于吗啉硝唑主要从尿中排泄,有必要对肾功能不全患者体内吗啉硝唑的药动学性质进行考察[38]。结果表明,同健康受试者相比,重度肾功能不全的患者静脉注射吗啉硝唑后,原形药物的药-时曲线下面积(AUC)增加1.5倍,而结合型代谢产物M7、M8-1和M8-2的AUC分别增加15.1、20.4和17.4倍。尿样中3个代谢产物的排泄量无明显差异,因此,在重度肾功能不全的患者中,M7、M8-1和M8-2的肾清除率分别较健康受试者降低了85.3%、92.5%和92.2%。转运体研究结果表明,M7主要由肾脏高表达的有机阴离子转运蛋白OAT1和OAT3进行转运,而M8-1和M8-2是由OAT3的底物转运。在重度肾功能不全患者体内,OAT的表达量及转运功能的改变使得M7、M8-1和M8-2的肾清除显著减弱,导致AUC急剧增加。相关研究结果表明,重度肾功能不全患者使用吗啉硝唑时需要调整剂量。
许多以绿原酸为主要活性成分的中药注射液在临床使用中会发生过敏反应,结合前期体外异构化和大鼠体内代谢研究结果[18-19],推测过敏反应的发生可能与绿原酸的代谢活化过程有关。采用加入谷胱甘肽(GSH)的人肝微粒孵化体系开展体外代谢研究,检测并鉴定了2种类型的GSH结合物。结果表明,绿原酸分子中的共轭不饱和双键本身可以与GSH发生亲电加成反应生成M2。此外,在CYP3A4和CYP2E1的催化下,绿原酸分子中的儿茶酚部分可以氧化生成邻醌中间体,进而与GSH发生亲电加成反应生成M1,示于图5。进一步研究发现,在炎症状态下,绿原酸的代谢活化程度显著提高,而儿茶酚O-甲基转移酶则可以通过催化绿原酸的甲基化代谢过程抑制绿原酸的代谢活化程度[20]。上述研究结果为含绿原酸的药物在不同疾病状态下的安全应用提供了基础资料。

图4 吗啉硝唑在人体内的主要代谢途径Fig.4 Major metabolic pathways of morinidazole in humans

图5 绿原酸的代谢活化过程Fig.5 Bioactivation of 5-O-caffeoylquinic acid
灯盏乙素是一种黄酮苷类天然活性化合物,临床上广泛应用于心血管疾病的治疗。健康受试者口服灯盏乙素滴丸后,血浆中原型药物含量极低,主要代谢产物为其同分异构体异灯盏乙素[12]。体内外代谢及转运机制研究表明,灯盏乙素口服给药后在肠道菌群作用下发生水解代谢生成苷元,并主要以苷元的形式穿过肠壁,在肠壁葡萄糖醛酸转移酶(UGT)的作用下,苷元发生葡萄糖醛酸结合代谢生成灯盏乙素和异灯盏乙素吸收入血,示于图6。在肝脏中,由于有机阴离子转运多肽(OATP2B1)特异性摄取灯盏乙素,促使其更快地发生进一步的葡萄糖醛酸结合代谢和胆汁排泄,最终导致系统循环中主要检测到异灯盏乙素[39-40]。相关结果为灯盏乙素制剂的生物等效性研究指明了测试物质,也为探究灯盏乙素制剂的药效机制提供了基础。
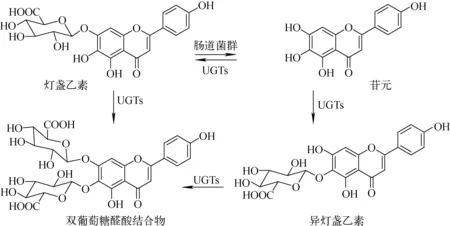
图6 灯盏乙素在人体内的代谢和处置过程Fig.6 Metabolism and disposition of scutellarin in humans
4 体内药物代谢产物鉴定研究中生物样品的选择
在体内药物代谢产物鉴定研究中,需要根据实验目的选择合适的生物样品。通常,人血液循环中主要代谢产物的种类及其暴露程度与药物的药效和安全性直接相关。此外,比较不同动物种属血浆中药物代谢物谱与人血浆中代谢物谱的相似性可为安全性评价研究动物种属的选择提供支持。因此,需要确定人或者动物血浆/血清中的代谢物谱。通常情况下,血浆样品的选择有两种方法。以口服给药为例,其一,根据药动学研究结果,分别在药物的吸收相、达峰时刻附近以及消除相选取数个时间点的血浆样品进行代谢产物鉴定研究。这种方法的优点是简单易行、单个时间点需要的血浆体积小,适用于啮齿类动物血浆代谢产物鉴定研究;缺点是需要进行大量的数据处理和分析,不能体现一定时间区间内原型药物和代谢产物之间相对量的变化。其二,根据血浆样品的采集时间间隔进行合并,获得一定时间区间内合并血浆样品[41]开展代谢产物鉴定研究。这种方法的优点是分析通量高,能体现药物和代谢产物之间相对暴露量的关系;缺点是样品合并方法比较繁琐,部分采样点血浆体积需要量大。需要指出的是,在血浆代谢产物鉴定研究中,通常需要关注代谢物谱的性别差异。
为了确定药物从体内排泄的主要途径和形式,需要对人或者动物尿样、粪样和胆汁样品中的代谢物谱进行研究。样品的选择需要考虑药物的血液消除半衰期和尿、粪中的累积排泄回收情况。与血浆样品相比,尿、粪和胆汁等排泄物的基质更为复杂,也包含更多种类的代谢产物。一般而言,尿中会检测到分子质量较小、水溶性好的代谢产物,例如血浆中存在的代谢产物及其衍生物;胆汁中以Ⅱ相结合物为主,如葡萄醛酸结合代谢产物、硫酸结合物和谷胱甘肽结合物等;粪中通常以Ⅰ相代谢产物为主,部分为胆汁中检测到代谢产物的降解产物。尿液、粪便和胆汁代谢产物鉴定研究同样需要关注性别差异。
与体内样品相比,体外孵化样品中药物代谢物谱通常较简单,可以根据孵化体系中存在的代谢酶种类及添加的辅因子类别预测可能的代谢途径,以提高代谢产物检测和鉴定的准确度。如肝微粒体中CYP酶和UGT酶表达量高,当孵化体系中加入NADPH作为辅酶时,主要发生氧化代谢;当加入UDPGA作为辅酶时,主要发生葡萄糖醛酸结合代谢;肠道菌群中表达多种还原酶和水解酶,主要发生还原和水解代谢等。一般而言,体内检测到的代谢产物在合适的体外实验体系中可以生成,或者可以生成其前体。
5 总结与展望
本实验室建立了“基于离子阱质谱的代谢产物鉴定”和“基于超高效液相色谱-高分辨质谱的代谢产物快速鉴定”技术体系,开展了22种化学创新药物和天然活性成分的体内、外代谢产物鉴定研究。随着LC/MS技术的持续发展,HR-MS在药物代谢产物鉴定研究中得到广泛的应用,不同药物代谢实验室采用的分析策略大同小异。仪器灵敏度的持续提高使得分析人员需要处理海量的数据信息,代谢产物的去伪存真和结构鉴定已成为整个分析流程的限速步骤,新的数据采集方法和数据挖掘工具取代灵敏度、分辨率和质量准确度等参数,成为实验人员关注的重点。在常规的药物代谢产物鉴定研究中,IDA、MSE和SWATH[42]数据采集模式各有优劣,互为补充,需要根据药物的化学结构和生物基质的种类等因素选择合适的方法,这依赖于分析人员的实际经验。深入理解药物代谢反应机理和质谱裂解规律有助于代谢产物结构的快速和准确鉴定。对于一些代谢产物,单纯依靠质谱信息无法准确鉴定其结构,需要结合其他技术手段,如NMR、生物或化学反应。近年来,单次分析同时获得定性和定量数据受到越来越多的关注。在多数情况下,单纯依靠质谱响应难以判断药物和代谢产物的相对含量,紫外色谱(UV)和放射性色谱等是有益的补充。
[1] 钟大放,李桦. 药物设计和开发中的药物代谢——基本原理和实践[M]. 北京:人民军医出版社,2011: 1-136.
[2] PARK B K, KITTERINGHAM N R, MAGGS J L, et al. The role of metabolic activation in drug-induced hepatotoxicity[J]. Annu Rev Pharmacol Toxicol, 2005, 45: 177-202.
[3] WALQREN J L, MITCHELL M D, THOMPSON D C. Role of metabolism in drug-induced idiosyncratic hepatotoxicity[J]. Crit Rev Toxicol, 2005, 35(4): 325-361.
[4] WEN B, ZHU M S. Applications of mass spectrometry in drug metabolism: 50 years of progress[J]. Drug Metab Rev, 2015, 47(1): 71-87.
[5] XIE C, ZHONG D F, CHEN X Y. A fragmentation-based method for the differentiation of glutathione conjugates by high-resolution mass spectrometry with electrospray ionization[J]. Anal Chim Acta, 2013, 788(14): 89-98.
[6] LI L, CHEN X Y, LI D, et al. Identification of 20(S)-protopanaxadiol metabolites in human liver microsomes and human hepatocytes[J]. Drug Metab Dispos, 2011, 39(3): 472-483.
[7] LI L, CHEN X Y, ZHOU J, et al.Invitrostudies on the oxidative metabolism of 20(S)-ginsenoside Rh2in human, monkey, dog, rat, and mouse liver microsomes, and human liver S9[J]. Drug Metab Dispos, 2012, 40(10): 2 041-2 053.
[8] WANG Y Y, ZHONG D F, CHEN X Y, et al. Identification of quinone methide metabolites of dauricine in human liver microsomes and in rat bile[J]. Chem Res Toxicol, 2009, 22(5): 824-834.
[9] JIN H, DAI J Y, CHEN X Y, et al. Pulmonary toxicity and metabolic activation of dauricine in CD-1 mice[J]. J Pharmacol Exp Ther, 2010, 332(3): 738-746.
[10]JIN H, SHEN S, CHEN X Y, et al. CYP3A-mediated apoptosis of dauricine in cultured human bronchial epithelial cells and in lungs of cd-1 mice[J]. Toxicol Appl Pharmacol, 2012, 261(3): 248-254.
[11]JIN H, LI L, ZHONG D F, et al. Pulmonary toxicity and metabolic activation of tetrandrinein CD-1 mice[J]. Chem Res Toxicol, 2011, 24(12): 2 142-2 152.
[12]CHEN X Y, CUI L, DUAN X T, et al. Pharmacokinetics and metabolism of the flavonoid scutellarin inhumans after a single oral administration[J]. Drug Metab Dispos, 2006, 34(8): 1 345-1 352.
[13]WANG Y Y, CHEN X Y, LI Q, et al. Metabolite identification of arbidol in human urine by the study of CID fragmentation pathways using hplc coupled with ion trap mass spectrometry[J]. J Mass Spectrom, 2008, 43(8): 1 099-1 109.
[14]WRONA M, MAURIALA T, BATEMAN K P, et al. ‘All-in-One’ analysis for metabolite identification using liquid chromatography/hybrid quadrupole time-of-flight mass spectrometry with collision energy switching[J]. Rapid Commun Mass Spectrom, 2005, 19(18): 2 597-2 602.
[15]ZHANG H Y, ZHANG D L, RAY K. A software filter to remove interference ions from drug metabolites in accurate mass liquid chromatography/mass spectrometric analyses[J]. J Mass Spectrom, 2003, 38(10): 1 110-1 112.
[16]LI L, HUANG X J, PENG J L, et al. Wedelolactone metabolism in rats through regioselective glucuronidation catalyzed by uridine diphosphate-glucuronosyltransferases 1As (UGT1As)[J]. Phytomedicine, 2016, 23(4): 340-349.
[17]邓泮,钟大放,谢岑,等. UPLC/Q-TOF MS 鉴定人参皂苷Rh2在大鼠体内的代谢产物[J]. 质谱学报,2009,30(增刊):83-85, 88.
DENG Pan, ZHONG Dafang, XIE Cen, et al. Metabolism investigation of ginsenoside Rh2in rat using UPLC/Q-TOF MS[J]. J Chin Mass Spectro Soc, 2009, 30(Suppl): 83-85, 88(in Chinese).
[18]XIE C, YU K, ZHONG D F, et al. Investigation of isomeric transformations of chlorogenic acid in buffers and biological matrixes by ultraperformance liquid chromatography coupled with hybrid quadrupole/ion mobility/orthogonal acceleration time-of-flight mass spectrometry[J]. J Agric Food Chem, 2011, 59(20): 11 078-11 087.
[19]谢岑,钟大放,陈笑艳. 鉴定大鼠注射绿原酸后体内的代谢产物[J]. 药学学报,2011,46(1):88-95.
XIE Cen, ZHONG Dafang, CHEN Xiaoyan. Metabolites of injected chlorogenic acid in rats[J]. Acta Pharma Sin, 2011, 46(1): 88-95(in Chinese).
[20]XIE C, ZHONG D F, CHEN X Y. Identification of the ortho-benzoquinone intermediate of 5-O-caffeoylquinic acidinvitroandinvivo: comparison ofbioactivation under normal and pathological situations[J]. Drug Metab Dispos, 2012, 40(8): 1 628-1 640.
[21]YU J H, DENG P, ZHONG D F, et al. Identification of amino acid and glutathioneN-conjugates oftoosendanin: bioactivation of the furan ring mediated by CYP3A4[J]. Chem Res Toxicol, 2014, 27(9): 1 598-1 609.
[22]LIU J, LI L, ZHOU X, et al. Metabolite profiling and identification of triptolide in rats[J]. J Chromatogr B, 2013, 939(22): 51-58.
[23]GONG A S, CHEN X Y, DENG P, et al. Metabolism of flumatinib, a novel antineoplastic tyrosine kinaseinhibitor, in chronic myelogenous leukemia patients[J]. Drug Metab Dispos, 2010, 38(8): 1 328-1 340.
[24]XIE C, ZHOU J L, GUO Z T, et al. Metabolism and bioactivation of famitinib, a novel inhibitor of receptor tyrosine kinase, in cancer patients[J]. Br J Pharmacol, 2013, 168(7): 1 687-1 706.
[25]DENG P, ZHONG D F, YU K, et al. Pharmacokinetics, metabolism, and excretion of the antiviral drugarbidol in humans[J]. Antimicrob Agents Chemother, 2013, 57(4): 1 743-1 755.
[26]DING J F, CHEN X Y, GAO Z W, et al. Metabolism and pharmacokinetics of novel selective vascularendothelial growth factor receptor-2 inhibitor apatinib in human[J]. Drug Metab Dispos, 2013, 41(6): 1 195-1 210.
[27]LIN L S, XIE C, GAO Z W, et al. Metabolism and pharmacokinetics of allitinib in cancer patients: the roles of cytochrome P450s and epoxide hydrolase inits biotransformations[J]. Drug Metab Dispos, 2014, 42(5): 872-884.
[28]DIAO X X, DENG P, XIE C, et al. Metabolism and pharmacokinetics of 3-n-butylphthalide (NBP) in humans: the role of cytochrome P450s and alcoholdehydrogenase in biotransformations[J]. Drug Metab Dispos, 2013, 41(2): 430-444.
[29]DIAO X X, PANG X Y, XIE C, et al. Bioactivation of 3-n-butylphthalide via sulfation of its major metabolite 3-hydroxy-NBP: mediated mainly bysulfotransferase 1A1[J]. Drug Metab Dispos, 2014, 42(4): 774-781.
[30]MENG J, ZHONG D F, LI L, et al. Metabolism of MRX-I, a novel antibacterial oxazolidinone, in humans: the oxidative ring opening of 2,3-dihydropyridin-4-onecatalyzed by non-P450 enzymes[J]. Drug Metab Dispos, 2015, 43(5): 646-659.
[31]DU J B, DENG P, CHEN X Y, et al. Characterization of ornidazole metabolites in human bile after intraveneous doses by ultraperformance liquid chromatography/quadrupole time-of-flight mass spectrometry[J]. Acta Pharm Sin B, 2012, 2(2): 159-167.
[32]DU J B, YOU T G, CHEN X Y, et al. Stereoselective glucuronidation of ornidazole in humans: predominant contribution of UDP-glucuronosyltransferases 1A9 and 2B7[J]. Drug Metab Dispos, 2013, 41(7): 1 306-1 318.
[33]DENG P, YOU T G, CHEN X Y, et al. Identification of amiodarone metabolites in human bile by ultraperformance liquid chromatography/quadrupole time-of-flight mass spectrometry[J]. Drug Metab Dispos, 2011, 39(6): 1 058-1 069.
[34]GAO R N, LI L, XIE C, et al. Metabolism and pharmacokinetics of morinidazole in humans: identification of diastereoisomeric morpholineN+-glucuronidescatalyzed by UDP glucuronosyltransferase 1A9[J]. Drug Metab Dispos, 2012, 40(3): 556-567.
[35]ZHOU X, LI L, DENG P, et al. Characterization of metabolites of GLS4 in humans using ultrahigh-performance liquid chromatography/quadrupole time-of-flight mass spectrometry[J]. Rapid Commun Mass Spectrom, 2013, 27(21): 2 483-2 492.
[36]ZHU Y T, LI L, DENG P, et al. Characterization of TPN729 metabolites in humans using ultra-performance liquid chromatography/quadrupole time-of-flight mass spectrometry[J]. J Pharm Biomed Anal, 2016, 117: 217-226.
[37]ZHU Y T, LI L, ZHANG G, et al. Metabolic characterization of pyrotinib in humans by ultra-performance liquid chromatography/quadrupole time-of-flight mass spectrometry[J]. J Chromatogr B, 2016, (1 033/1 034): 117-127.
[38]ZHONG K, LI X L, XIE C, et al. Effects of renal impairment on the pharmacokinetics of morinidazole: uptake transporter-mediated renal clearance of the conjugatedmetabolites[J]. Antimicrob Agents Chemother, 2014, 58(7): 4 153-4 161.
[39]GAO C Y, CHEN X Y, ZHONG D F. Absorption and disposition of scutellarin in rats: a pharmacokinetic explanation for the high exposure of its isomeric metabolite[J]. Drug Metab Dispos, 2011, 39(11): 2 034-2 044.
[40]GAO C Y, ZHNG H J, GUO Z T, et al. Mechanistic studies on the absorption and disposition of scutellarin in humans: selective OATP2B1-mediated hepatic uptake is a likely key determinant for its uniquepharmacokinetic characteristics[J]. Drug Metab Dispos, 2012, 40(10): 2 009-2 020.
[41]HOP C E, WANG Z, CHEN Q, et al. Plasma-pooling methods to increase throughput forinvivopharmacokinetic screening[J]. J Pharm Sci, 1998, 87(7): 901-903.
[42]ZHU X C, CHEN Y P, SUBRAMANIAN R. Comparison of information-dependent acquisition, swath, and MSalltechniques in metabolite identification study employing ultrahigh-performance liquid chromatography-quadrupole time of-flight mass spectrometry[J]. Anal Chem, 2014, 86(2): 1 202-1 209.
ApplicationsofLiquidChromatography-MassSpectrometryinDrugMetaboliteIdentification
LI Liang, CHEN Xiao-yan, ZHONG Da-fang
(CenterforDrugMetabolismandPharmacokinetics,ShanghaiInstituteofMateriaMedica,ChineseAcademyofSciences,Shanghai201203,China)
Drug metabolism study is an integral part of drug discovery and development. Quick and accurate identification of the metabolites that formed in the biological matrix is crucial for the understanding of biotransformation pathways of drugs or drug candidates. Information on the metabolic soft sites of a candidate could help the optimization of the lead compound to screen drugs that have higher metabolic stability. On the other hand, the use of nucleophilic capture reagents to carry outinvitrometabolism studies to screen reactive metabolites could avoid the possible toxicity risks in clinical practice. Because of its high speed, high sensitivity, good selectivity, and the ability to provide rich structure-related informations, liquid chromatography-mass spectrometry (LC/MS) has become a dominant tool in drug metabolism studies. In recent ten years, metabolism studies on more than one hundred drugs, drug candidates, or natural active compounds have been carried out in our lab by either liquid chromatography/ion trap mass spectrometry (LC/MSn) or ultrahigh performance liquid chromatography/quadrupole time-of-flight mass spectrometry (UPLC/Q-TOF MS). At present, some drugs have either entered into clinical research or been approved for the treatment of multiple diseases by China Food and Drug Administration. This paper reviews the use of LC/MS in the drug metabolite identification studies in our lab, and offers thoughts on the general workflow for drug metabolite detection and structure elucidation using LC/MS. The workflow proposed in this review has focused on the metabolite identification studies on small-molecule xenobiotics. In addition, this review also discusses the advantages and disadvantages as well as the remaining challenges in drug metabolism and disposition studies using LC/MS technology. Principles of biological samples selection and preparation in drug metabolism studies has also been involved. In conclusion, the general workflow for small-molecule drug metabolism study using LC/MS has been proposed, which intends to provide a basis for clinical pharmacokinetics and drug-drug interaction studies.
liquid chromatography-mass spectrometry (LC/MS); metabolite identification; reactive metabolites; high-resolution mass spectrometry (HRMS)
2016-12-23;
2017-03-04
李 亮(1980—),男(汉族),河南人,副研究员,从事药物代谢动力学研究。E-mail: liliang@simm.ac.cn
钟大放(1957—),男(汉族),吉林人,研究员,从事药物代谢动力学研究。E-mail: dfzhong@simm.ac.cn
O657.63
:A
:1004-2997(2017)04-0375-13
10.7538/zpxb.2016.0208

