毛细管电泳-质谱联用技术及其在药物和生物分析中的应用
周 韦,刘易昆,陈子林
(武汉大学药学院,湖北 武汉 430071)
毛细管电泳-质谱联用技术及其在药物和生物分析中的应用
周 韦,刘易昆,陈子林
(武汉大学药学院,湖北 武汉 430071)
毛细管电泳-质谱(CE-MS)联用技术是在液相色谱-质谱联用技术基础上发展起来的一项新型分析技术,它结合了毛细管电泳具有的分离效率高、分离速度快、样品消耗量少以及质谱检测具有的高灵敏度和强结构解析能力等优点,现已成为倍受分析化学工作者关注的新型微量分析技术。目前,CE-MS联用技术是中药有效成分分析,体内药物分析以及生物样品,如氨基酸、多肽、蛋白质和多糖等分析的重要手段。本文对CE-MS联用技术中同轴鞘流及无鞘流纳流电喷雾等几种接口装置的研究进展,CE-MS技术在中药活性成分分析及多级质谱结构解析以及氨基酸、多肽及蛋白质等生物样品分析中的应用研究进行了综述,并对该技术的发展进行了展望。
毛细管电泳-质谱(CE-MS);电喷雾离子化接口装置;药物分析;生物分析;综述
毛细管电泳(CE)具有分离速度快、样品消耗量少、分离效率高等特点。目前,用于毛细管电泳的检测器主要有紫外(UV)、激光诱导荧光(LIF)和质谱(MS)。在CE与UV联用时,由于毛细管电泳内径一般只有几十微米左右,其进样量相对较小,且紫外检测器光程较短,导致了CE-UV方法的检测灵敏度较低,在检测痕量样品时,尤其是在检测较为复杂的生物样品基质时受到限制。虽然LIF检测器灵敏度较高,但其检测对象必须能够发射荧光,对于没有荧光信号的物质,常常需要经过复杂的衍生化处理,另外,商品化的毛细管电泳仪由于激光诱导荧光检测器检测波长单一,故受到激发光波长的限制,导致CE-LIF技术的应用范围受到一定的限制。MS检测器具有高选择性、高灵敏度的特点,此外,它还可以准确地测定化合物的相对分子质量,并提供结构信息,对于复杂样品特别是未知样品的检测是一种理想的方法。CE-MS联用技术的发展结合了毛细管电泳在分离上以及质谱在检测上的优势,在微量复杂样品的分析中体现出自身的优势。自1987年Smith等[1]首次提出该技术以来,CE-MS联用装置及应用受到了广泛的关注与研究,并得到了快速发展。
CE-MS技术的发展对毛细管电泳以及质谱的应用起着促进作用。一方面,MS为CE提供了一种高选择性和高灵敏度的检测手段,并且不会影响毛细管电泳中样品的分离;另一方面,CE为MS检测提供了高效分离过程,比较适合复杂的分析对象,如药物及生物样品。因此,CE-MS作为一种快速、高效的分析手段,在药物及生物样品分析中倍受关注。与常用的高效液相色谱-质谱联用(HPLC-MS)技术相比,CE-MS技术需要的样品量更少、分离效率更高、分析速度更快,在蛋白质组学等领域中,已经作为HPLC-MS的补充应用于复杂样品的分析[2]。目前,CE-MS技术已广泛应用于药学[3]、蛋白质组学[4]、多糖分析[5]、代谢组学[6]、生物标志物分析[7]、法医学[8]、食品分析以及单细胞分析[9-10]等多个领域。但是,由于CE进样量较少、分离的重现性不好、定量分析时线性范围相对较窄等原因,在药物代谢动力学等领域的发展受到限制。
在CE-MS联用中,对于CE的限制主要是背景缓冲液(BGM)的选择,添加剂以及表面活性剂等必须容易离子化,防止其不利于电离,且毛细管壁的涂层要足够稳定,避免因其脱落而污染离子源。目前,CE中的毛细管区带电泳(CZE)、胶束电动毛细管色谱(MEKC)以及毛细管电色谱(CEC)等多种分离模式都已经实现与MS联用,其中CZE因为简单方便且不需添加剂,是目前CE-MS联用中应用最多的模式。在CE-MS中,背景缓冲液必须与质谱离子化方式相匹配,大多数用的是挥发性较强的甲酸、乙酸及其铵盐。非水毛细管电泳(NACE)因其BGM中的有机溶剂易挥发且导热性好,在CE-MS中受到了科学家的青睐。CE-MS接口技术是实现联用的最关键部分,也是多年研究的重点之一。目前,常用于CE-MS联用的离子源主要有电喷雾电离源(ESI)、基质辅助激光解吸电离源(MALDI)和电感耦合等离子体(ICP)。其中,MALDI主要用于离线的CE-MS联用,ICP主要用于金属或含金属元素样品的分析,ESI是目前在线CE-MS应用最广泛的离子源技术,绝大多数的接口技术都是基于ESI离子化原理来设计并应用的,这也是本文讨论的重点。
CE-MS接口装置研发是研究的热点与重点课题之一。因为用于CE分离的管路较细,电泳中能够产生的电渗流(EOF)流量较小,在与MS连接时,一方面需要保证CE出口端能够导电,以确保外加CE分离电场,另一方面需要产生稳定的电喷雾,以实现质谱的检测。在尽量减小对CE分离效果影响的前提下,研发高效、稳定、具有高离子化效率的电喷雾接口是科学家关注的重要研究内容,也是限制CE-MS技术实际应用的关键性问题[11]。多种形状和材料的管路,如金属毛细管、有机聚合物管以及削尖处理的石英毛细管等已被应用于CE-MS接口装置,以改善电喷雾效率。多种微流体装置也被设计用于改善CE-MS联用的电喷雾接口问题[12]。下面将对近5年来,CE-MS联用装置及其在药物及生物样品分析中的应用进行综述。
1 CE-MS联用装置的研究进展
自CE-MS联用技术提出以来,对于联用接口装置的研究一直是倍受科学家关注的重点课题。ESI离子源的出口端喷雾液体与CE中的缓冲液可以相互匹配,接口处的电压可以同时用于毛细管电泳的分离以及电喷雾的进行,有利于产生稳定的电喷雾。由于ESI自身的优势以及LC-ESI-MS接口技术的成熟,使得ESI源的接口在CE-MS联用装置中占据了主导地位,这是接口技术研发的重点方向。CE-ESI-MS接口主要分为有鞘流液(sheath-flow)和无鞘流(sheathless)两种,两种接口各有优势。因为易导电、挥发性较强且易电离的鞘流液的加入,鞘流接口装置产生的电泳及电喷雾都较稳定,是最早实现商品化的接口技术;但是鞘流液的加入对样品产生了稀释作用,降低了质谱检测的灵敏度,且鞘流液也容易使出口端的样品发生扩散,影响出峰的峰型及分离效率,这是目前鞘流接口存在的主要问题。无鞘流接口可分为毛细管末端直接加电压和液接型(liquid junction)两种。因为不会对样品产生稀释,其检测灵敏度较高。但因为没有鞘流液的辅助,喷雾端液体过少,容易导致电喷雾不稳定,因此,无鞘流接口一般要求毛细管电泳的电渗流相对较大[13]。另外,未经鞘流液稀释的高浓度样品在喷雾时也容易发生较强的离子抑制作用,影响样品电离的效率。目前,针对无鞘流接口的研究较多,但商品化的仪器较少。
1.1鞘流接口装置
鞘流接口装置是通过在毛细管出口端加入液体以达到产生稳定电泳及电喷雾的作用。鞘流液的引入主要有三个作用:第一,在喷雾端电极和毛细管电泳的缓冲液之间起导电作用,使CE中能够产生稳定的电驱动;第二,可以通过调节鞘流液的组成成分对CE中的背景缓冲液进行修饰,使其更利于电喷雾及质谱检测;第三,补充CE中产生的EOF,防止因为EOF过小而造成喷雾不稳定的情况。相对来说,鞘流接口装置的发展较为成熟,是最早实现商品化的CE-MS接口装置[14],目前已经有多种接口装置被应用于实际分析中。
最早商品化并被广泛使用的CE-MS接口是同轴三通的鞘流接口[15],装置示意图示于图1。该接口装置主要由一个同轴三通的金属套管组成,最里面是分离用的毛细管,中间可以通过外接纳升泵提供鞘流液,最外部通入N2气流辅助产生电喷雾。在中间的金属套管中通入电流,一方面用于电喷雾,另一方面通过鞘流液的导电性,连接CE管路的出口端为其提供稳定的电回路。这种设计的优势在于几乎没有死体积,不会对CE分离产生不利的影响,其稳定性相对较好。但是,此装置在使用过程中对鞘流液的流量要求较大,一般需要达到μL/min级别,是CE分离流量的几十倍甚至上百倍,对样品的稀释作用较强,会降低质谱分析的灵敏度。另外,末端的鞘流液会导致样品峰的扩散,降低CE的分离度,也会对CE的峰型产生不利的影响。目前,主要通过对其内部毛细管进行削尖成锥形[16],或者将内部连接鞘流的金属套管设计成锥形等方法进行改进,以提高电喷雾的稳定性及喷雾效率[17]。为了在不影响其接口端喷雾稳定性的前提下减小鞘流液对分离和检测的不利影响,可采用减少鞘流液流量以及取消喷雾气等多种方法。

图1 同轴三通鞘流接口装置示意图Fig.1 Scheme of coaxial sheath-flow interface with sheath gas

图2 二元斜面形鞘流接口装置示意图Fig.2 Scheme of the dual-beveled-edge CE-ESI-MS interface
通过纳升喷雾的方法可以有效地减小鞘流液对样品的稀释效应。在分离毛细管的末端采用镀金处理,使毛细管末端液体接电形成稳定的电回路。用于分离的毛细管被插入另一个内径较大且末端经过打磨成锥形的石英套管中。鞘流液通过外层包裹的大孔径毛细管引入,在末端尖端处与CE毛细管中的缓冲液混合并喷出。采用这种包裹型的鞘流接口装置,其最终的流量大约为500 nL/min,与普通的同轴三通鞘流接口相比,其稀释倍数降低了1倍以上[17]。此外,还采用了一种斜面接口来提高CE-MS接口处较小流量液体的喷雾稳定性,装置示意图示于图2。CE分离毛细管与用于提供鞘流液的毛细管末端都被磨成斜面型,电渗流与鞘流液在毛细管尖端处混合后,通过电喷雾离子化后进入MS分析,管路末端通过镀金进行导电,以提供稳定的电流回路用于CE。结果显示,采用此种斜面型的接口装置,其产生稳定电喷雾的液体流量可以减小到600 nL/min,减小了鞘流液对样品的稀释作用[18-19]。此外,将毛细管套入不锈钢管的内部,利用套管与毛细管外壁之间的空隙来传输鞘流液的方式也被应用于接口技术中,其可以产生最低流速为100 nL/min的电喷雾[20]。
圣母大学的Dovichi课题组研究了一种利用电驱动鞘流液的自动化鞘流CE-MS接口装置[21],该装置将传统的机械泵驱动鞘流液更换为同样使用电泳来驱动,实现了鞘流液部分的自动化以及微量鞘流液的引入,装置示意图示于图3。该装置将传统的外部金属套管换成可以同样产生EOF的玻璃毛细管,在外部玻璃毛细管中引入一个较低的电压HV2,该电压既可以作为CE分离出口端的电压,产生用于分离的稳定电流回路,又可以通过自身产生电渗流的方式驱动鞘流液,产生微量且稳定的流体。与传统的机械泵相比,电驱动的鞘流液装置在不加入分流装置的情况下就可以产生用于辅助喷雾的流量更小且稳定的流体,加电压的方式也更利于自动化调控和使用。目前,该装置已经被商品化生产,并逐渐应用于药物、蛋白质、多肽、多糖等多类复杂生物样品的分离与检测中,在某些方面表现出比传统LC-MS更加优良的分析性能。

图3 电驱动鞘流液型CE-MS接口装置示意图[21]Fig.3 Scheme of the CE-MS sheath interface with electrokinetic flow[21]
1.2无鞘流接口装置
CE-MS在1987年被研发出来时,所使用的接口是无鞘流装置,但因为其稳定性和重复性较差,很快被加入鞘流液的同轴接口所取代。由于无鞘流的接口不存在对样品的稀释作用,检测灵敏度相对较高,因此又逐渐被探索和研究,尤其是近些年来,无鞘流接口装置的研发倍受关注。
CE能够产生的EOF流量较小,在不加鞘流液的情况下,存在的最主要挑战是在出口端如何加上电压使其形成稳定的电流回路进行电泳分离并提供喷雾电压。在此前提下,要尽可能的使其对CE分离效率以及电喷雾的稳定性产生较小的影响,并且接口装置要易于制备,耐用性好。最早使用的加电压方式是在毛细管的末端直接插入尺寸较细的金属电极[22],或者在毛细管末端通过机械或者侵蚀的方法制造一个小孔,插入金属电极,用于接入电压[23],示于图4a。这种方法的问题在于插入的金属电极会对流路产生阻碍,容易形成涡旋或产生气泡,影响CE分离的效率和稳定性。还有一种最常见的毛细管出口端加电压的方式是在其末端镀上一层导电的涂层,包括多种金属涂层,如金[24]、银[25]、铜[26]、镍,以及非金属导电涂层,如石墨等,导电涂层被涂覆在管壁的末端用于导电连接[27-28],示于图4b。但这种涂层涂覆方法存在的最大问题是操作较为复杂且稳定性较差,多次重复使用后涂层容易脱落,导致分离与电喷雾的不稳定,因此这种方法很少被商品化生产和使用。

图4 多种无鞘流接口装置原理示意图Fig.4 Scheme of several sheathless CE-MS interfaces
另外一种方式是将毛细管分成两段[29],中间管路裸露部分的液体可以通过外部包裹的电极加上电压形成回路,示于图4c,但这种方法存在的主要问题是在分成两段的过程中,形成孔的大小难以保证,导致其重复性差,操作较为困难。为了解决这一问题,氢氟酸腐蚀的方法被用于形成末端多孔的毛细管柱,在多孔的末端管路外部加一个具有缓冲液薄层的金属套管,可以成功地实现电压的加入,示于图4d[30]。虽然这种方式解决了电压加入的问题,但是氢氟酸的腐蚀会导致毛细管非常脆弱,容易损坏,不利于商品化的生产和使用。通过将毛细管分离和电喷雾电离分开成两部分,在断开的部分加入金属导电套管,也可以解决末端加电的问题,示于图4e[31]。这种两段式连接方式同样可以通过将第二段毛细管换成金属管路,直接在金属管路外部加入电压,示于图4f[32]。但是这些装置需要特别注意两段毛细管必须对齐才能保证稳定的流路,且存在一定的死体积,容易影响分离和喷雾的效果。
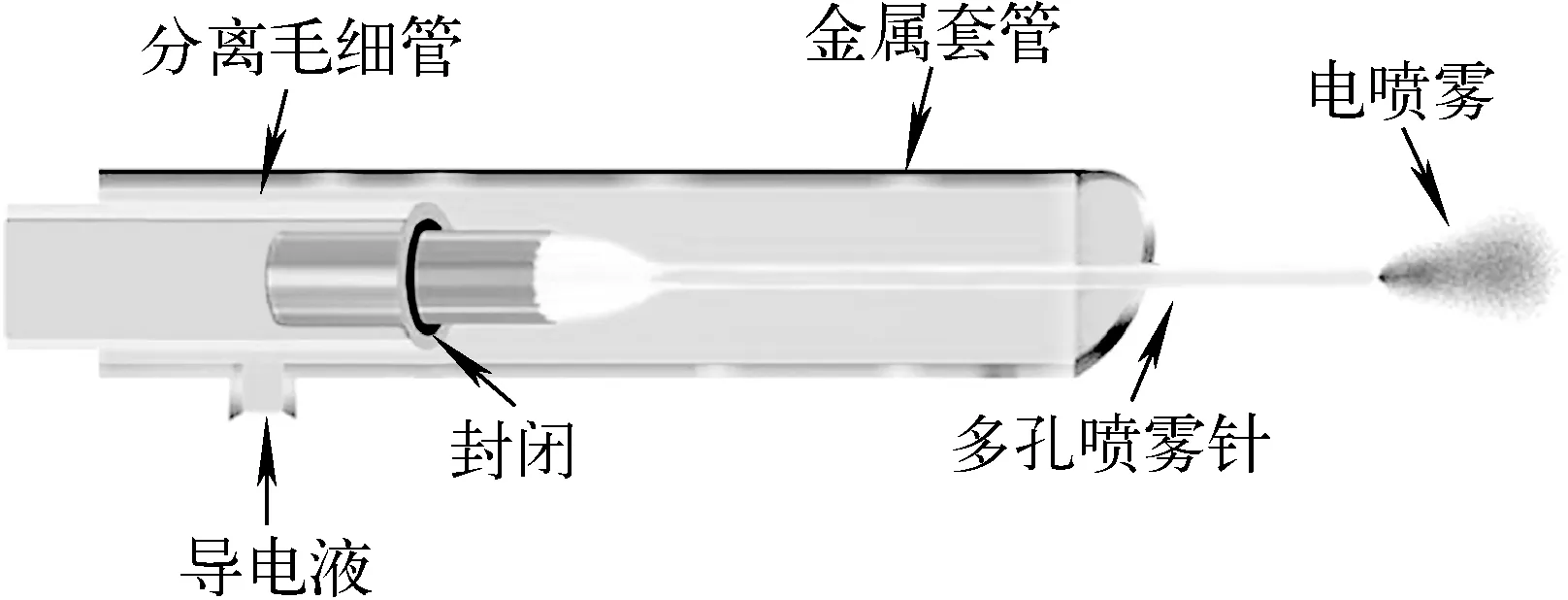
图5 外部包裹的多孔无鞘流CE-MS接口装置示意图[33] Fig.5 Scheme of the CE-MS interface with a large inner diameter separation capillary and a small porous emitter[33]
因为较脆、易损坏,末端腐蚀后形成多孔毛细管用于导电的方法没有被广泛应用。将腐蚀的一小段易损坏的毛细管与前面用于分离的毛细管分开,再用金属套管包裹住接口部分,可以有效地解决这一问题[33],示于图5。这种接口装置由三部分组成,最内层是一个经过腐蚀处理后的多孔毛细管,其内径20 μm,外径90 μm,在管子的外部套上一个用于分离的大孔径毛细管,外径360 μm,内径100 μm,在起到CE分离作用的同时,可对内部较脆弱的多孔毛细管起到保护作用。在这两根毛细管的外部再加上一根金属套管,用于为内部液体导电,形成稳定的电流回路。金属套管内部的导电液体可以通过多孔毛细管接上电压用于电泳分离和电喷雾。该装置表现出良好的分离效果和稳定性,因为没有鞘流液的存在,使其检测的灵敏度得到了明显提升,因为用于分离的毛细管内径较大,其分离的柱容量也相对较大。目前,这种接口装置已经被商品化销售和使用,在蛋白质组学分析中有着良好的应用前景。
陈子林等[34]研制了一种液接型无鞘流电喷雾装置,示于图6。该方法利用一段可以导电的全氟磺酸(Nifion)管将CE分离毛细管和MS电喷雾毛细管连接,在全氟磺酸管的外部加入一小段用于装载缓冲盐的聚氯乙烯管。聚氯乙烯管缓冲液中外加的电压HV2不仅可以用于质谱电喷雾,还可以有效地解决分离毛细管出口端接电的问题。作者同时研制了一种Lupamin高分子聚合物涂覆的毛细管电色谱柱,现已成功地应用于氨基酸和多肽样品的CE-MS分析[35]。

图6 液接型无鞘流CE-MS接口装置示意图[34] Fig.6 Scheme of the sheathless CE-MS interface by liquid junction method
2 CE-MS应用研究进展
CE-MS联用技术具有分离效率高、分析速度快、高灵敏度和高选择性的优点,不仅可以应用于一些复杂样品的分离和检测,还可以提供分子质量信息用于解析结构特征,因此,在复杂生物样品分析中具有独特的优势。下面将对CE-MS技术在药物、蛋白质、多肽分析中的应用进展进行概述。
2.1药物分析
CE-MS作为一种微量、高灵敏度分离与检测技术,在药物结构、组分、纯度分析中发挥着重要的作用。例如,CE-MS在中药有效成分的结构鉴定及含量分析,单克隆抗体药物的分析[36],生物药物在体内的N端糖基化修饰的分析[37],蛋白质药物的生物相似性分析等[38]领域均有报道。

注:BC为补骨脂甲素;IBC为补骨脂乙素图7 采用CE-MS分析补骨脂甲素和补骨脂乙素[39]Fig.7 Analysis of bavachin and isobavachalcone by CE-MS[39]
采用同轴三通的CE-MS接口装置,本课题组成功地将CE-MS用于补骨脂中有效成分的含量测定[39]。补骨脂是一种具有抗炎、抗氧化等多种功效的传统中药材,对于其有效成分的分离和检测具有重要的意义。补骨脂甲素和补骨脂乙素是补骨脂中两种重要的有效成分,互为同分异构体。由于其分子质量相同,较难分离,所以在质谱检测中将其分离后再进行检测具有重要的意义。采用醋酸铵作为流动相,通过优化缓冲液的pH值、浓度、鞘流液种类等条件,成功地实现了这对同分异构体的分离,结果示于图7。采用质谱检测器,其最低检测限达到了60 μg/L,远低于紫外检测器,可以实现对中药补骨脂提取物中这两种成分的直接分离和检测。采用CE-MS分离模式,已成功地实现了长春花等中药中有效成分的分离和含量检测[40]。
非水毛细管电泳是毛细管电泳(NACE)的一种模式,与普通的水相毛细管电泳相比,其具有不同的分离选择性及分离机理,特别适用于水相溶解度差或稳定性差的药物分析。本课题组将非水毛细管电泳通过同轴三通的接口与离子阱质谱相连,成功实现了对传统中药材防己科植物中的汉防己甲素、汉防己乙素和及育哼宾3种有效成分的分析[41]。以1号峰对应的小檗碱为内标物,NACE-MS对3种有效成分以及内标小檗碱分离效果良好,结果示于图8a和8b。由于MS检测的灵敏度相对较高,利用该方法还实现了对中药防己和蝙蝠葛提取物中3种成分含量的直接测定,结果示于图8c和8d。结果表明,NACE与质谱联用在中药活性组分分析中具有很好的应用前景。
此外,采用质谱法不仅可以实现对中药中有效成分的高效分离和测定,还可以实现对其分子结构裂解情况的解析。本课题组利用离子阱质谱可以进行多级质谱分析的特点,探索了汉防己乙素在多级质谱条件下主要碎片峰的分子质量信息,进行了分子结构裂解情况的分析,结果示于图9。
本课题组还实现了对石蒜、苦参等传统中药材中主要生物碱成分含量的测定,并通过离子阱质谱提供的分子裂解信息,对其多级质谱裂解规律进行解析[42-43]。
此外,多种不同接口装置也被应用于实际药物分析中。Haselberg等[44]报道了无鞘流CE-ESI装置在糖蛋白类药物分析中的应用,在检测人类干扰素-β重组子中,至少有18种多糖类组分被检测和鉴定,包括多种脱酰胺基、琥伯酰亚胺衍生化和氧化产物。在对人类红细胞生成素的重组子检测中,可以实现60 min内检测并鉴定74种多糖类组分和250多种氧化和乙酰化的同分异构体,其含量范围在0.35~950 nmol/L之间。这些检测方法和数据对生物药品的生产和生物相似物的鉴定起着重要作用。CE-MS也是一种独特的在线酶活性鉴定以及酶抑制剂筛选手段,如将该方法应用于肿瘤入侵和转移相关的金属蛋白酶-9的酶活性测定以及抑制剂筛选中[45]。Marakova等[46]利用无鞘流的CE-ESI-MS/MS装置与三重四极杆质谱联用,同时鉴定和定量了多种协同作用药物和生物基质。Harrison[47]建立了一种用于运动员兴奋剂检测的CE-MS技术,因为CE具有快速和高通量的特点,这种检测方法在运动员兴奋剂检测中具有潜在的优势。

注:a.总离子流色谱图;b.提取离子色谱图;c.中药防己中成分含量的测定;d.中药蝙蝠葛中成分含量的测定1.小檗碱;2. 汉防己乙素;3. 汉防己甲素;4. 育哼宾图8 采用非水CE-MS分析防己科植物中3种有效成分[41]Fig.8 Analysis of active alkaloids in menispermaceae family by NACE-MS

图9 正离子模式下,汉防己乙素的分子裂解分析[41]Fig.9 Fragmentation pathways of main fragment ions for tetrandrine in positive ion mode
2.2氨基酸、多肽及蛋白质的分析
氨基酸和多肽样品是CE-MS研究中相对较多的分析对象,在生物分析领域具有一定的实用价值。Lupamin是一种带有大量氨基的高分子聚合物,本课题组通过将Lupamin涂覆在毛细管柱中,在酸性条件下实现了对多种氨基酸和多肽样品的分离。并利用图6中搭建的液接型无鞘流电喷雾接口,实现对样品的MS检测,其结果示于图10。通过在毛细管内表面引入带正电的固定相,可以防止在酸性条件下带正电的氨基酸和多肽样品在毛细管内表面的静电吸附,另外,无鞘流的电喷雾接口也可以防止鞘流液带来的稀释作用,提高了检测的灵敏度。
近年来,CE-MS技术在蛋白质组学分析中的应用也是研究的热点领域,用于蛋白质组学分析的新装置和新方法不断被发现和应用。目前,在蛋白质分析中应用较为广泛的有电驱动鞘流液接口和金属套管包裹的腐蚀多孔无鞘流接口装置。
Docvichi课题组利用研发的电驱动鞘流液电喷雾接口技术将CE与多种MS连接,如三重四极杆、轨道离子阱等,由于该接口技术既可以产生稳定的EOF和电喷雾,又可以减少鞘流液对样品的稀释作用,实现了对多种蛋白质的微量分析,证明了这种装置在蛋白质组学中的应用优势与价值[48-49]。将CE与轨道离子阱质谱(CE-Orbitrap MS)相连用于胰蛋白酶消化后的牛血清蛋白匀浆分析时,其最低检测限达到0.3 nmol/L[50]。利用该装置与三重四极杆质谱相连,采用多反应监测模式(MRM)对阿片类神经递质亮氨酸脑啡肽进行定量检测,其检测限达到60 pmol/L,灵敏度相当于nanoLC/MS的10~20倍,比LC-MS/MS的检测灵敏度提高的倍数更高[51]。通过在CE-MS分析前加入一段C18固相微萃取柱进行富集处理,在大肠杆菌的胰蛋白酶细胞裂解液中鉴定出了4 902种多肽和871种蛋白质,该结果也是目前CE-MS鉴定出的最大的蛋白质组学数据[52]。目前,该接口装置已经成功地被商品化生产,将在蛋白质组学研究中发挥更大的作用。

图10 几种氨基酸和多肽样品的CE-MS色谱图[34]Fig.10 Chromatogram of amino acids and peptides by CE-MS
金属套管包裹的腐蚀多孔无鞘流接口装置在蛋白质分析中的应用也较为广泛,通过该接口装置实现了大量天然蛋白质分子的分离和检测,包括多种高分子质量的蛋白质非共价复合物。实验证明,在4~900 nL/min流量范围内,该接口装置都可以产生稳定的电喷雾,特别是在较低流量时,该接口装置因为离子抑制作用的减少而体现出更高的灵敏度。该装置能够检测螃蟹中分子质量在445 ku~1.34 mu之间血蓝蛋白的含量,而普通的含鞘流液的接口装置却无法检测[53]。这一结果进一步验证了无鞘流的CE-MS接口装置在小流量分析、大分子分析和提高灵敏度方面的优势。
CE-MS方法也同样被应用于在线酶反应与检测中。将一个固定化的酶微反应器加入CE-MS装置中,可以实现酶的在线反应与分离检测。蛋白质的磷酸化在细胞分裂、分化、转移和信号通路中都发挥着重要作用,对其含量的测定也是研究的重点。Mou等[54-55]通过这种方法将碱性磷酸酶固定在一个CE-MS微反应器上,用于蛋白质和多肽样品中磷酸化酶的化学计量学测定。该装置的原理示于图11,它包括一个二维的分离过程。首先,因为带电荷量和分子大小的差异,磷酸化和未磷酸化的多肽在第一段分离毛细管中分离,先后到达含有固定了碱性磷酸酶的微反应器中,磷酸化的多肽会在酶的作用下发生去磷酸化作用,而本身没有磷酸化的蛋白质和多肽不会发生改变。通过第二段分离毛细管,未磷酸化的蛋白质或多肽和去磷酸化的蛋白质或多肽分别到达质谱检测端,测出其含量,并可以算出磷酸化蛋白质或多肽的含量及其所占的比例。该方法通过加入一个微反应器,成功地实现了磷酸化蛋白质去磷酸化后的在线含量测定,防止因为离子化效率的差异造成检测结果不准确。因此,该方法实现了一种对磷酸化蛋白质和多肽的“非差异性”在线快速检测。

图11 CE-MS在线磷酸化酶反应器原理示意图[54] Fig.11 Determination of peptide phosphorylation stoichiometry via automatic CE-MS system[54]
3 总结与展望
经过20多年的发展,CE-MS联用技术已经成为一种重要的分析手段,特别是在生物体系中微量成分的分离、定性和定量检测中体现了独特的优势。结合CE分析速度快、分离效率高和易于实现微型化的特点与质谱分析的灵敏度高、选择性好以及可以提供物质的分子质量和结构信息的优势,CE-MS在药物、蛋白质组学、多糖组学中已实现高通量和高灵敏度的分析。
今后,CE-MS联用技术在以下几个方面将具有良好的发展前景:1) 新型毛细管电色谱柱在CEC-MS联用技术中的应用。目前,CE-MS使用的大多数是空的毛细管柱或通过简单的涂覆改变毛细管壁的带电情况,从而改善分离效果,与MS匹配的新型毛细管电色谱柱相对较少。随着CE-MS技术逐渐从装置的研发向应用实际复杂样品分析方向的发展,开发分离选择性好、分离效率高且适合质谱联用的毛细管电色谱柱具有重要意义;2) 在线酶反应、在线固相微萃取等技术与CE-MS联用的结合。实现样品的高效、快速和自动化分析一直是分析领域的热点,而在线酶反应或富集技术与CE-MS的结合是实现复杂样品快速高灵敏度分析的重要手段;3) CE-MS技术在复杂样品分析中的应用。CE-MS联用技术在微量复杂样品分析中具有独特的优势,目前在实际样品中的应用相对较少,CE-MS联用技术在药物、蛋白质组学、多糖组学、食品分析和单细胞分析等领域都具有良好的应用前景。
[1] OLIVARES J, NGUYEN N, YONKER C, et al. On-line mass spectrometric detection for capillary zone electrophoresis[J]. Analytical Chemistry, 1987, 59(8): 1 230-1 232.
[2] SCHIAVONE N, SARVER S, SUN L, et al. High speed capillary zone electrophoresis-mass spectrometry via an electrokinetically pumped sheath flow interface for rapid analysis of amino acids and a protein digest[J]. Journal of Chromatography B, 2015, (991): 53-58.
[3] KOHLER I, SCHAPPLER J, RUDAZ S. Highly sensitive capillary electrophoresis-mass spectrometry for rapid screening and accurate quantitation of drugs of abuse in urine[J]. Analytica Chimica Acta, 2013, 780(780): 101-109.
[4] SUN L, ZHU G, YAN X, et al. Capillary zone electrophoresis for bottom-up analysis of complex proteomes[J]. Proteomics, 2016, 16(2): 188-196.
[5] SUN X, LIN L, LIU X, et al. Capillary electrophoresis-mass spectrometry for the analysis of heparin oligosaccharides and low molecular weight heparin[J]. Analytical Chemistry, 2016, 88(3): 1 937-1 943.
[6] RAMAUTAR R, MAYBORODA O, SOMSEN G, et al. CE-MS for metabolomics: developments and applications in the period 2008-2010[J]. Electrophoresis, 2011, 32(1): 52-65.
[7] MISCHAK H, SCHANSTRA J. CE-MS in biomarker discovery, validation, and clinical application[J]. Clinical Applications, 2011, 5(1/2): 9-23.
[8] CRUCES-BLANCO C, GARCA-CAMPAA A. Capillary electrophoresis for the analysis of drugs of abuse in biological specimens of forensic interest[J]. Trends in Analytical Chemistry, 2012, 31(1): 85-95.
[9] RODRIGUEZ R, SMYTH W. The application of CE-MS in the trace analysis of environmental pollutants and food contaminants[J]. Electrophoresis, 2009, 30 (10): 1 647-1 660.
[10]HEINEMANN M, ZENOBI R. Single cell metabolomics[J]. Current Opinion in Biotechnology, 2011, 22(1): 26-31.
[11]MAXWELL E, CHEN D. Twenty years of interface development for capillary electrophoresis-electrospray ionization-mass spectrometry[J]. Analytica Chimica Acta, 2008, 627(1): 25-33.
[12]PANTUCKOVA P, GEBAUER P, BOCEK P, et al. Recent advances in CE-MS: synergy of wet chemistry and instrumentation innovations[J]. Electrophoresis, 2011, 32(1): 43-51.
[13]KLEPARNIK K. Recent advances in combination of capillary electrophoresis with mass spectrometry: methodology and theory[J]. Electrophoresis, 2015, 36(1): 159-178.
[14]KLEPARNIK K. Recent advances in the combination of capillary electrophoresis with mass spectrometry: from element to single-cell analysis[J]. Electrophoresis, 2013, 34(1): 70-85.
[15]BONVIN G, SCHAPPLER J, RUDAZ S. Capillary electrophoresis-electrospray ionization-mass spectrometry interfaces: fundamental concepts and technical developments[J]. Journal of Chromatography A, 2012, 1 267(23): 17-31.
[16]LIU C, ALARY J, VOLLMERHAUS P, et al. Design, optimisation, and evaluation of a sheath flow interface for automated capillary electrophoresis-electrospray-mass spectrometry[J]. Electrophoresis, 2005, 26(7/8): 1 366-1 375.
[17]LIU C, ZHANG J, DOVICHI N. A sheath-flow nanospray interface for capillary electrophoresis/mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2005, 19(2): 187-192.
[18]TSENG M, CHEN Y, HER G. A beveled tip sheath liquid interface for capillary electrophoresis-electrospray ionization-mass spectrometry[J]. Electrophoresis, 2004, 25(13): 2 084-2 089.
[19]CHEN Y, TSENG M, HER G. Design and performance of a low-flow capillary electrophoresis-electrospray-mass spectrometry interface using an emitter with dual beveled edge[J]. Electrophoresis, 2005, 26(7/8): 1 376-1 382.
[20]ZHONG X, MAXWELL E, CHEN D. Mass transport in a micro flow-through vial of a junction-at-the-tip capillary electrophoresis-mass spectrometry interface[J]. Analytical Chemistry, 2011, 83(12): 4 916-4 923.
[21]WOJCIK R, DADA O, SADILEK M, et al. Simplified capillary electrophoresis nanospray sheath-flow interface for high efficiency and sensitive peptide analysis[J]. Rapid Communications in Mass Spectrometry, 2010, 24(17): 2 554-2 560.
[22]FANG L, ZHANG R, WILLIAMS E,et al. Online time-of-flight mass spectrometric analysis of peptides separated by capillary electrophoresis[J]. Analytical Chemistry, 1994, 66(21): 3 696-3 701.
[23]CAO P, MOINI M. A novel sheathless interface for capillary electrophoresis/electrospray ionization mass spectrometry using an in-capillary electrode[J]. Journal of the American Society for Mass Spectrometry, 1997, 8(5): 561-564.
[24]KELE Z, FERENC G, KLEMENT E,et al. Design and performance of a sheathless capillary electrophoresis/mass spectrometry interface by combining fused-silica capillaries with gold-coated nanoelectrospray tips[J]. Rapid Communications in Mass Spectrometry, 2005, 19(7): 881-885.
[25]CHEN Y, HER G. A simple method for fabrication of silver-coated sheathless electrospray emitters[J]. Rapid Communications in Mass Spectrometry, 2003, 17(5): 437-441.
[26]ZAMFIR A, DINCA N, SISU E,et al. Copper-coated microsprayer interface for on-line sheathless capillary electrophoresis electrospray mass spectrometry of carbohydrates[J]. Journal of Separation Science, 2006, 29(3): 414-422.
[27]BENDAHL L, HANSEN S, OLSEN J. A new sheathless electrospray interface for coupling of capillary electrophoresis to ion-trap mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2002, 16(24): 2 333-2 340.
[28]DAHLIN A, WETTERHALL M, LILJEGREN G, et al. Capillary electrophoresis coupled to mass spectrometry from a polymer modified poly(dimethylsiloxane) microchip with an integrated graphite electrospray tip[J]. The Analyst, 2005, 130(2): 193-199.
[29]MOINI M. Design and performance of a universal sheathless capillary electrophoresis to mass spectrometry interface using a split-flow technique[J]. Analytical Chemistry, 2001, 73(14): 3 497-3 501.
[30]MOINI M. Simplifying CE-MS operation. 2. Interfacing low-flow separation techniques to mass spectrometry using a porous tip[J]. Analytical Chemistry, 2007, 79(11): 4 241-4 246.
[31]TONG W, LINK A, ENG J, et al. Identification of proteins in complexes by solid-phase microextraction/multistep elution/capillary electrophoresis/tandem mass spectrometry[J]. Analytical Chemistry, 1999, 71(13): 2 270-2 278.
[32]ISHIHAMA Y, KATAYAMA H, ASAKAWA N, et al. Highly robust stainless steel tips as microelectrospray emitters[J]. Rapid Communications in Mass Spectrometry, 2002, 16(10): 913-918.
[33]WANG C, LEE C, SMITH R, et al. Capillary isotachophoresis-nanoelectrospray ionization-selected reaction monitoring MS via a novel sheathless interface for high sensitivity sample quantification[J]. Analytical Chemistry, 2013, 85(15): 7 308-7 315.
[34]CHEN Z, BOGGESS B, CHANG H. Open-tubular capillary electrochromatography-mass spectrometry with sheathless nanoflow electrospray ionization for analysis of amino acids and peptides[J]. Journal of Mass Spectrometry, 2007, 42(2): 244-253.
[35]WU Y, XIE J, WANG F, et al. Electrokinetic separation of peptides and proteins using a polyvinylamine-coated capillary with UV and ESI-MS detection[J]. Journal of Separation Science, 2008, 31(5): 814-823.
[36]HAN M, ROCK B, PEARSON J, et al. Intact mass analysis of monoclonal antibodies by capillary electrophoresis-mass spectrometry[J]. Journal of Chromatography B, 2016, (1 011): 24-32.
[37]KALMAN-SZEKERES Z, OLAJOS M, GANZLER K. Analytical aspects of biosimilarity issues of protein drugs[J]. Journal of Pharmaceutical and Biomedical Analysis, 2012, (69): 185-195.
[38]GROSS P, BURKART S, MULLER R. Analytics of the therapeutic peptide aviptadil by sheathless CE-MS and comparison with nanoRP-HPLC-MS[J]. Journal of Pharmaceutical and Biomedical Analysis, 2014, (88): 477-482.
[39]ZHANG Y, CHEN Z. Separation of isomeric bavachin and isobavachalcone in the Fructus Psoraleae by capillary electrophoresis-mass spectrometry[J]. Journal of Separation Science, 2012, 35(13): 1 644-1 650.
[40]CHEN Q, LI N, ZHANG W, et al. Simultaneous determination of vinblastine and its monomeric precursors vindoline and catharanthine in catharanthus roseus by capillary electrophoresis-mass spectrometry[J]. Journal of Separation Science, 2011, 34(20): 2 885-2 892.
[41]CHEN Q, ZHANG J, ZHANG W, et al. Analysis of active alkaloids in the menispermaceae family by nonaqueous capillary electrophoresis-ion trap mass spectrometry[J]. Journal of Separation Science, 2013, 36(2): 341-349.
[42]ZHANG Y, CHEN Z. Nonaqueous CE ESI-IT-MS analysis of amaryllidaceae alkaloids[J]. Journal of Separation Science, 2013, 36(6): 1 078-1 084.
[43]ZHANG J, CHEN Z. Determination of matrine and oxymatrine in sophora flavescens by nonaqueous capillary electrophoresis-electrospray ionization-ion trap-mass spectrometry[J]. Analytical Letters, 2013, 46(4): 651-662.
[44] HASELBERG R, JONG G, SOMSEN G. Low-flow sheathless capillary electrophoresis-mass spectrometry for sensitive glycoform profiling of intact pharmaceutical proteins[J]. Analytical Chemistry, 2013, 85(4): 2 289-2 296.
[45]WANG X, DOU Z, YUAN Y, et al. On-line screening of matrix metalloproteinase inhibitors by capillary electrophoresis coupled to ESI mass spectrometry[J]. Journal of Chromatography B, 2013, 930(7): 48-53.
[46]MARAKOVA K, PIESTANSKY J, VEIZEROVA L, et al. Multidrug analysis of pharmaceutical and urine matrices by on-line coupled capillary electrophoresis and triple quadrupole mass spectrometry[J]. Journal of Separation Science, 2013, 36(11): 1 805-1 816.
[47]HARRISON C. Role of capillary electrophoresis in the fight against doping in sports[J]. Analytical Chemistry, 2013, 85(15): 6 982-6 989.
[48]SUN L, ZHU G, YAN X, et al.Capillary zone electrophoresis for analysis of complex proteomes using an electrokinetically pumped sheath flow nanospray interface[J]. Proteomics, 2014, 14(4/5): 622-628.
[49]ZHAO Y, RILEY N, SUN L,et al. Coupling capillary zone electrophoresis with electron transfer dissociation and activated ion electron transfer dissociation for top-down proteomics[J]. Analytical Chemistry, 2015, 87(10): 5 422-5 429.
[50]SUN L, ZHU G, LI Y, et al.CZE-ESI-MS/MS system for analysis of subnanogram amounts of tryptic digests of a cellular homogenate[J]. Proteomics, 2012, 12(19/20): 3 013-3 019.
[51]LI Y, WOJCIK R, DOVICHI N J, et al. Quantitative multiple reaction monitoring of peptide abundance introduced via a capillary zone electrophoresis-electrospray interface[J]. Analytical Chemistry, 2012, 84(14): 6 116-6 121.
[52]ZHU G, SUN L, YAN X, et al. Single-shot proteomics using capillary zone electrophoresis-electrospray ionization-tandem mass spectrometry with production of more than 1250 Escherichia coli peptide identifications in a 50 min separation[J]. Analytical Chemistry, 2013, 85(5): 2 569-2 573.
[53]GAHOUAL R, BUSNEL J, WOLFF P, et al. Novel sheathless CE-MS interface as an original and powerful infusion platform for nanoESI study: from intact proteins to high molecular mass noncovalent complexes[J]. Analytical and Bioanalytical Chemistry, 2014, 406(11): 1 029-1 038.
[54]MOU S, SUN L, DOVICHI N. Accurate determination of peptide phosphorylation stoichiometry via automated diagonal capillary electrophoresis coupled with mass spectrometry: proof of principle[J]. Analytical Chemistry, 2013, 85(22): 10 692-10 696.
[55]MOU S, SUN L, WOJCIK R, et al. Coupling immobilized alkaline phosphatase-based automated diagonal capillary electrophoresis to tandem mass spectrometry for phosphopeptide analysis[J]. Talanta, 2013, 116(22): 985-990.
RecentAdvancesinCapillaryElectrophoresis-MassSpectrometryandItsApplicationinPharmaceuticalandBiologicalAnalysis
ZHOU Wei, LIU Yi-kun, CHEN Zi-lin
(SchoolofPharmaceuticalSciences,WuhanUniversity,Wuhan430071,China)
Capillary electrophoresis-mass spectrometry (CE-MS), developed on the basis of liquid chromatography-mass spectrometry, is a new hyphenated technique that combines the advantages like high separation efficiency, short analytical time, low sample consumption in CE and the high sensitivity, powerful molecular structure elucidation in MS. It has been paid great attention by analytical scientists and become a powerful tool for analysis of active components in Chinese medicine, in vivo drugs and bio-samples like amino acids, peptides, proteins and polysaccharides. In this paper, a brief review was given on recent advance in CE-MS and its applications, including advance in sheath-flow and sheathless nano-spray interfaces and applications in analysis of pharmaceutical and biological samples. The first part of this review summarizes the development of stable and efficient interfaces to improve the feasibility of CE-MS technique. Several interfaces like coaxial sheath-flow, electrokinetic sheath-flow, liquid injection and sheathless interface with etching emitter have been reviewed. The second part introduces the application of CE-MS in the past few years. The applications are categorized according to the types of analytes, including the analysis for active components in Chinese medicines, in vivo drugs, amino acids, peptides, proteins and carbohydrates. Coatings for capillary inner wall, online processing strategies, sample preparation methods and other experiment methods have been discussed in each category. In the last part of this review, a perspective of this technique has been discussed.
capillary electrophoresis-mass spectrometry (CE-MS); electrospray ionization interface; pharmaceutical analysis; bioanalysis; review
2016-12-26;
2017-02-28
国家自然科学基金(81573384,21375101)资助
周 韦(1994—),男(汉族),安徽合肥人,硕士研究生,药物分析专业。E-mail: zhouwei1994@whu.edu.cn
陈子林(1963—),男(汉族),江西乐平人,教授,从事药物分析与筛选研究。E-mail: chenzl@whu.edu.cn
O657.63
:A
:1004-2997(2017)04-0362-13
10.7538/zpxb.2016.0210

