伴癫痫持续状态、运动障碍和低通气综合征的自身免疫性脑炎:1例报告及文献复习
王勤鹰,顾 勤,余 敏,姜嘟嘟,詹 青
1. 上海中医药大学附属第七人民医院神经内科 上海 200137
2. 上海中医药大学附属第七人民医院神经康复科 上海 200137
病例报告
伴癫痫持续状态、运动障碍和低通气综合征的自身免疫性脑炎:1例报告及文献复习
王勤鹰1,2,顾 勤1,2,余 敏1,2,姜嘟嘟1,2,詹 青1,2
1. 上海中医药大学附属第七人民医院神经内科 上海 200137
2. 上海中医药大学附属第七人民医院神经康复科 上海 200137
目的:总结自身免疫性脑炎的临床特征,以减少临床误诊。
方法:回顾性分析1例年轻的女性自身免疫性脑炎患者的诊疗过程及随访资料。
结果:该患者以发热起病,病情迅速进展,并伴有癫痫持续状态、运动障碍和低通气综合征。诊断为自身免疫性脑炎后,给予免疫治疗。病程3个月时,病情逐渐趋于稳定,并渐趋好转;病程15个月时进行随访,预后较好。
结论:临床上对于出现精神障碍、肌张力运动障碍和癫痫的年轻患者,应及时进行自身免疫性脑炎的血清抗体检测和脑脊液检查,以明确诊断。
脑炎;自身免疫性脑炎;癫痫持续状态;运动障碍
詹 青
zhanqing@tongji.edu.cn
To cite: WANG QY, GU Q, YU M, et al. Autoimmune encephalitis with status epilepticus, dyskinesia and hypoventilation syndrome: A case report and literature review. J Neurol and Neurorehabil, 2017, 13(2):98-103.
脑炎具有高发病率与高死亡率的特点[1]。年轻患者如果出现头痛、发热、抽搐、局灶性神经体征以及脑脊液细胞增多,则提示为脑炎。高收入国家的脑炎发病率为每年(5~10)/10万[2]。近10年来,随着N-甲基-D-天冬氨酸 (N-methyl-D-aspartate,NMDA)、电压门控钾离子通道(voltage-gated potassium channel,VGKC)、α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid,AMPA)、γ-氨 基 丁 酸(gamma amino butyric acid,GABA)和甘氨酸等神经元细胞膜抗原受体被发现,越来越多的患者被诊断为免疫性脑炎[2]。然而,由于免疫性脑炎的症状多样,因此早期识别免疫性脑炎仍面临挑战。为此,本文报道1例伴癫痫持续状态、运动障碍和低通气综合征的自身免疫性脑炎患者,以期为临床上能够更好地识别这类患者提供借鉴。
1 病例报告
患者女性,26岁,未婚,急性起病,表现为高热、头痛、呕吐,之后迅速出现记忆力下降、失眠、精神症状、意识改变、癫痫持续状态、运动障碍、自主神经损害等。既往有甲状腺结节史。
2014年7月17日就诊于上海市同济医院,诊断为病毒性脑炎。2014年7月21日起在上海市同济医院神经重监护室接受住院治疗,给予抗病毒治疗、激素联合丙种球蛋白免疫治疗、多种抗癫痫药物联合治疗以及机械通气等治疗;治疗3个月后,病情出现缓慢好转;治疗5个月后,患者出院,出院时诊断为免疫性脑炎、癫痫和继发性肌张力障碍。此后,患者在上海市同济医院和上海中医药大学附属第七人民医院进行门诊随访,接受丙戊酸钠、苯妥英钠和氯硝西泮抗癫痫治疗。自发病后15个月时,除不能很好地控制情绪以外,一般情况恢复至病前状态。患者的诊疗经过见表1,头颅磁共振成像(magnetic resonance imaging,MRI)检查结果见图1。
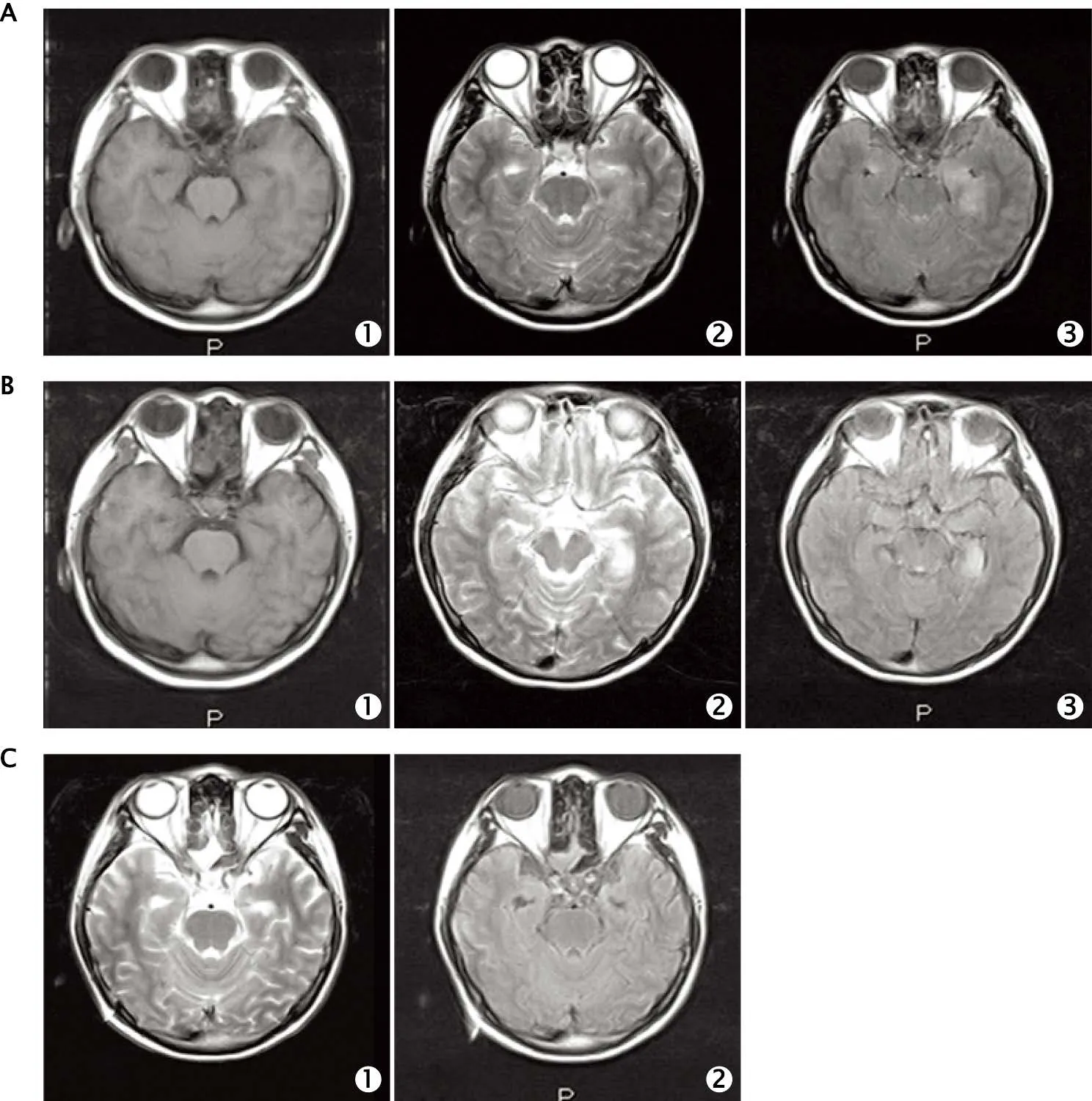
图1 1例伴癫痫持续状态、运动障碍和低通气综合征的自身免疫性脑炎患者的头颅磁共振成像检查结果。A1~3:病程第6天的T1、T2和液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列图像,T2序列显示左侧海马区有异常信号;B1~3:病程第16天的T1、T2和FLAIR序列图像,显示双侧海马区有异常信号;C1~2:病程第150天的T2和FLAIR序列图像,未见明显异常。
2 讨论
脑炎的病因有许多。近10年来,随着多种细胞膜表面抗原受体抗体被发现,自身免疫性脑炎已不再局限于副肿瘤综合征,其在青年和儿科患者中也并不罕见[3]。美国加利福尼亚州脑炎中心的一项研究发现,在≤30岁的脑炎患者中,抗NMDA受体脑炎发病数占据首位,是1型单纯疱疹病毒、水痘带状疱疹病毒和西尼罗河病毒脑炎发病数的4倍[4]。国内的一项研究对95例临床拟诊为“脑炎”的患者进行抗NMDA受体检测,结果发现阳性患者有25例,另有抗GABA受体抗体阳性患者2例[5]。
目前认为,认知障碍、脑炎表现、脑病表现和痴呆是抗细胞膜表面抗原受体脑炎的警示症状,其精神症状也很常见,包括错觉、幻觉、抑郁、躁狂和情绪改变等,也可表现为遗忘、迷失方向和执行功能障碍[2]。抗VGKC受体脑炎多见于中年以上人群,临床症状包括记忆缺失、定向力障碍、颞叶癫痫发作、抗利尿激素分泌失调综合征所致的低钠血症等[6-7]。抗NMDA受体脑炎以女性患者居多,临床表现包括显著的前驱高热、精神症状、癫痫发作、意识障碍、口手运动障碍和自主神经功能障碍等[8]。
抗VGKC受体脑炎常合并癫痫发作,表现为全面强直阵挛发作和典型的颞叶内侧复杂部分性发作,也可表现为简单部分发作[9]。近期研究的结果显示,在出现其他症状和MRI显示异常之前,抗VGKC受体脑炎患者通常先出现同侧面臂肌张力障碍发作(faciobrachial dystonic seizure,FBDS),每次发作时间仅数秒,每日发作的中位频次为30次。FBDS高度提示抗VGKC受体脑炎,77%的VGKC受体脑炎患者首先出现FBDS,而后再出现记忆缺失、定向力障碍、颞叶癫痫和低钠血症等典型症状。免疫治疗可以显著减少FBDS的发作频率,并且可以阻止进一步进展至认知障碍[7,9]。抗NMDA受体脑炎患者中,76%伴有不同发作类型的癫痫,最常表现为复杂部分性发作或全面强直阵挛发作,6%可伴癫痫持续状态[8]。抗NMDA受体脑炎合并癫痫持续状态患者通常对多种抗癫痫药物治疗无反应,因此需要给予麻醉药物治疗及气管插管行机械通气;而免疫治疗大多可使癫痫得到控制[10-12]。一项有关抗体介导的癫痫持续状态的回顾性研究发现,13例患者的平均年龄为25岁,其中女性有12例,从出现最初的症状至进展为癫痫持续状态的间隔时间为0~11个月;癫痫持续状态的时间为10 d~12年,平均为2个月,且多种传统或新型的抗癫痫药物的治疗效果均不佳[13]。
在抗VGKC受体脑炎患者中,4%合并肢体肌张力障碍,15%合并自主神经异常[9]。运动障碍和自主神经异常则是抗NMDA受体脑炎的突出表现。运动障碍包括舞蹈或手足徐动样运动、共济失调步态、颅神经异常、重复的口周面部运动和失语症。90%的患者可表现出2种以上的运动障碍,60%的患者表现出3种以上的运动障碍,60%的患者合并口周面部运动障碍,包括撅嘴、舌头突出和磨牙症;而同期的脑电图未见癫痫样放电。自主神经异常见于89%的抗NMDA受体脑炎患者,报道最多的症状包括心动过速、心动过缓、血压不稳、高热、肺换气不足和(或)呼吸暂停,大多数患者同时表现出3种以上的症状[14]。
在辅助检查方面,脑脊液常规和生化检查以及脑电图检查通常无特征性的异常发现[7,14]。出现FBDS时,仅有24%的患者的脑电图可见癫痫样放电,亦有患者表现为节律性4~5 Hz的慢活动。抗NMDA受体脑炎患者的脑电图通常表现为非特异性慢波[7]。20%的抗NMDA受体脑炎患者的早期脑电图可见癫痫样放电,广泛的慢波可见于80%的患者[8]。有研究发现,异常“δ刷(delta brush)”是抗NMDA受体脑炎的特征性表现,主要见于病程较长且病情严重的患者[15]。此外,在抗NMDA受体脑炎患者出现运动障碍时,往往难以对异常运动与癫痫发作进行鉴别,因此建议进行连续脑电图监测[16]。
抗VGKC受体脑炎MRI T2/液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列可显示海马肿胀,也可表现为尾状核和壳核的异常信号,病程后期可表现为海马萎缩[7,17]。仅46%的抗NMDA受体脑炎患者的MRI可出现非特异性的异常[4],一般表现为T2或FLAIR序列高信号;FLAIR序列时,在海马、大脑皮质、基底节和丘脑等部位可见高信号[8]。病程后期往往恢复正常而无海马萎缩表现[17]。
目前,自身免疫性脑炎的免疫治疗仍分为一线治疗(激素、丙种球蛋白、血浆置换)和二线治疗(利妥昔单抗、环磷酰胺及其他免疫抑制剂)。目前尚无研究对上述免疫治疗方案的优劣进行过比较,但临床上通常采用一线治疗中的1种方案或联合2种方案;如果一线治疗无效,则选择二线治疗。除免疫治疗以外,手术也被应用于自身免疫性脑炎的治疗[18]。
本例患者因条件所限而未能进行针对自身免疫性脑炎的血清和脑脊液检测。临床上,考虑这是一位年轻的女性患者,除脑炎常见症状以外,其在病程中还伴随长期的难治性癫痫持续状态、口面部和肢体运动障碍以及低通气障碍、血压升高、心率加快、呼吸频率加快、出汗、大量的口腔分泌物等明显的自主神经损害症状;脑脊液检查结果显示为非特异的白细胞计数和蛋白水平的轻度增加,病毒检测为阴性;头颅MRI检查显示T2序列海马区有高信号。病程初期给予糖皮质激素和丙种球蛋白治疗的效果不佳,但在坚持进行激素治疗后,于病程3个月时病情逐渐趋于稳定并渐趋好转,病程15个月时病情未见反复,预后较好。因此,临床上诊断为自身免疫性脑炎,抗NMDA受体型脑炎可能。
综上所述,临床上对于伴有认知障碍、精神障碍、肌张力运动障碍和癫痫的患者,应考虑自身免疫性脑炎的可能;早期诊断后,应尽早开始足量的免疫治疗;对于重症患者,即使暂时未能明确诊断,也可以启动免疫治疗;鉴于此类疾病常伴发肿瘤,应同时进行肿瘤筛查。
[1] Granerod J, Ambrose HE, Davies NW, et al. Causes of encephalitis and differences in their clinical presentations in England: a multicentre, population-based prospective study[J]. Lancet Infect Dis, 2010,10(12):835-844.
[2] Irani SR, Gelfand JM, Al-Diwani A, et al.Cell-surface central nervous system autoantibodies: clinical relevance and emerging paradigms[J]. Ann Neurol, 2014,76(2):168-184.
[3] Lopinto-Khoury C, Sperling MR. Autoimmune status epilepticus[J]. Curr Treat Options Neurol, 2013, 15(5):545-556.
[4] Gable MS, Sheriff H, Dalmau J, et al. The frequency of autoimmune N-methyl-D-aspartate receptor encephalitis surpasses that of individual viral etiologies in young individuals enrolled in the California Encephalitis Project[J]. Clin Infect Dis, 2012,54(7):899-904.
[5] 矫黎东, 王向波. 自身免疫性脑炎临床研究进展[J]. 疑难病杂志, 2012,13(12):1312-1314.
[6] 陆 卉, 张雅静. 自身免疫性脑炎临床鉴别诊断及治疗研究[J]. 中华医院感染学杂志,2014, 24(6):1423-1425.
[7] Irani SR, Stagg CJ, Schott JM, et al.Faciobrachial dystonic seizures: the influence of immunotherapy on seizure control and prevention of cognitive impairment in a broadening phenotype[J]. Brain, 2013,136(Pt 10):3151-3162.
[8] Dalmau J, Gleichman AJ, Hughes EG, et al.Anti-NMDA-receptor encephalitis: case series and analysis of the effects of antibodies[J].Lancet Neurol, 2008, 7(12):1091-1098.
[9] Irani SR, Michell AW, Lang B, et al.Faciobrachial dystonic seizures precede Lgi1 antibody limbic encephalitis[J]. Ann Neurol, 2011, 69(5):892-900.
[10] Dericioglu N, Vural A, Acar P, et al.Antiepileptic treatment for anti-NMDA receptor encephalitis: the need for video-EEG monitoring[J]. Epileptic Disord, 2013,15(2):166-170.
[11] Nolan B, Plenk K, Carr D. Anti-N-methyl-D-aspartate receptor (anti-NMDAR) encephalitis presenting to the emergency department with status epilepticus[J]. CJEM, 2014,16(5):425-428.
[12] Finné Lenoir X, Sindic C, van Pesch V,et al. Anti-N-methyl-D-aspartate receptor encephalitis with favorable outcome despite prolonged status epilepticus[J]. Neurocrit Care, 2013, 18(1):89-92.
[13] Holzer FJ, Rossetti AO, Heritier-Barras AC,et al. Antibody-mediated status epilepticus:a retrospective multicenter survey[J]. Eur Neurol, 2012, 68(5):310-317.
[14] Gable MS, Gavali S, Radner A, et al. Anti-NMDA receptor encephalitis: report of ten cases and comparison with viral encephalitis[J]. Eur J Clin Microbiol Infect Dis, 2009, 28(12):1421-1429.
[15] Schmitt SE, Pargeon K, Frechette ES,et al. Extreme delta brush: a unique EEG pattern in adults with anti-NMDA receptor encephalitis[J]. Neurology, 2012,79(11):1094⁃1100.
[16] Kayser MS, Kohler CG, Dalmau J.Psychiatric manifestations of paraneoplastic disorders[J]. Am J Psychiatry, 2010,167(9):1039-1050.
[17] Bien CG, Vincent A, Barnett MH, et al.Immunopathology of autoantibody-associated encephalitides: clues for pathogenesis[J].Brain, 2012, 135(Pt 5):1622-1638.
[18] 陈向军, 邓 波. 自身免疫性脑炎的诊断标准及其临床指导意义[J]. 中国临床神经科学, 2016, 24(3):336-340.
Autoimmune encephalitis accompanied with status epilepticus, dyskinesia and hypoventilation syndrome:A case report and literature review
WANG Qinying1,2, GU Qin1,2, YU Min1,2, JIANG Dudu1,2, ZHAN Qing1,2
1. Department of Neurology, Seventh People’s Hospital Affiliated to Shanghai University of Traditional Chinese Medicine,Shanghai 200137, China
2. Department of Neurorehabilitation, Seventh People’s Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 200137, China
Objective: To summarize the clinical features of autoimmune encephalitis so as to reduce the clinical misdiagnosis.
Methods: The diagnosis and treatment and the follow-up data of a young female patient with autoimmune encephalitis were reviewed retrospectively.
ZHAN Qing
E-MAIL ADDRESS
zhanqing@tongji.edu.cn
Results: The patient had a fever as the initial symtom and the disease progressed rapidly with status epilepsy, motor disorders and hypoventilation syndrome. Immunotherapy was administered when the diagnosis of autoimmune encephalitis was confirmed. At the third month since the onset of the disease, the condition of the patient was gradually improved; at the fifteenth month, the patient achieved good prognosis.
Conclusion: In clinical practice, a young patient with mental disorders, dyskinesia and epilepsy suspected of autoimmune encephalitis should receive detection of serum antibodies associated with autoimmune encephalitis and the cerebrospinal fluid test to make a definite diagnosis.
Encephalitis; Autoimmune encephalitis; Status epilepticus; Motor disorders
May 25, 2017; accepted for publication June 10, 2017
Copyright © 2017 by Journal of Neurology and Neurorehabilitation
10.12022/jnnr.2017-0021
上海市科学技术委员会青年基金项目(编号:20164Y0073);上海中医药大学校级科研项目(编号:2016YG36);上海中医药大学课程建设项目(编号:SHUTCMKCJSY2016090);上海市第七人民医院人才培养计划(编号:MZY2017-01)
FUNDING/SUPPORT: Youth Fund Project of Science and Technology Commission of Shanghai Municipality (No. 20164Y0073); Academic Research Project of Shanghai University of Traditional Chinese Medicine (No. 2016YG36); CourseConstruction Project of Shanghai University of Traditional Chinese Medicine (No.SHUTCMKCJSY2016090); Talents Training Program of Seventh People’s Hospital Affiliated to Shanghai University of Traditional Chinese Medicine (No. MZY2017-01)
CONFLICT OF INTEREST: The authors have no con fl icts of interest to disclose.
王勤鹰, 顾 勤, 余 敏, 等. 伴癫痫持续状态、运动障碍和低通气综合征的自身免疫性脑炎:1例报告及文献复习[J]. 神经病学与神经康复学杂志, 2017, 13(2):98-103.

