抗N-甲基-D天冬氨酸受体脑炎运动障碍临床分析☆
杭海伦 林柳余 陆杰 石静萍
抗N-甲基-D-天冬氨酸受体脑炎(N-methyl-D-aspartate receptor encephalitis,NMDAR)常急性或亚急性起病,主要表现为精神障碍、认知功能下降、癫痫、运动障碍、中枢性低通气、自主神经功能障碍等,其中运动障碍是其常见症状[1-2],多表现为震颤、肌张力障碍、舞蹈症、刻板运动、帕金森综合征等[3-5],且运动障碍多出现在精神障碍及认知障碍之后[6]。运动障碍可为儿童抗NMDAR脑炎首发症状,同一患者也可以出现多种运动障碍的叠加,且持续时间较长[7]。运动障碍复杂多样,在临床工作中常易被误诊[8]。因此,早期识别并诊断运动障碍较为重要。目前已有研究分析抗NMDAR脑炎在儿童患者中运动障碍的临床特点[5],本研究旨在对比分析成人抗NMDAR脑炎中运动障碍的临床因素,从而深化临床医生对运动障碍的认识。
1 对象与方法
1.1 研究对象 回顾分析2014年7月至2020年12月南京脑科医院神经内科连续性收治的确诊为抗NMDAR脑炎的患者资料。由一位具有丰富临床经验的神经免疫亚专科医师(主要擅长诊疗自身免疫性脑炎)审查每位患者的病历资料。入组标准:符合自身免疫性脑炎(autoimmune encephalitis,AE)诊断路径[9]及《中国自身免疫性脑炎诊治专家共识》[10]。①下列主要症状中的1项或者多项:精神行为异常或者认知障碍、言语障碍、癫痫发作、运动障碍、意识水平下降、自主神经功能障碍或者中枢性低通气。②抗NMDAR抗体阳性:建议以脑脊液基于细胞底物实验(cell based assay,CBA)法抗体阳性为准。若仅有血清标本可供检测,除了CBA结果阳性,还需要采用基于组织底物实验(tissue based assay,TBA)法与培养神经元进行间接免疫荧光法予以最终确认,且低滴度的血清阳性(1:10)不具有确诊意义。排除标准:排除合并有其他可能导致运动障碍的疾病,如帕金森病、脑肿瘤、其他类型的AE等。本研究获得南京脑科医院伦理委员会的批准及取得所有患者的知情同意书。
1.2 资料收集 收集所有患者人口统计学及临床资料,如年龄、性别、发病至入院时间、发病至诊断时间、临床症状及治疗情况。同时收集所有患者的实验室及影像学资料等,如抗体检测(脑脊液和/或血清)、头颅磁共振及脑电图。抗体检测由杭州欧蒙未一医学检验实验室采用间接免疫荧光法检测。参考既往文献,将运动障碍分为舞蹈症、紧张症、肌张力障碍、震颤、口面部不自主运动及刻板运动等[3-5],根据是否有运动障碍症状,将患者分为运动障碍组与非运动障碍组。此外,在急性期及出院时,利用改良Rankin评分(modified Rankin scale,mRS)[11]对所有患者的神经系统功能进行评估。
1.3 统计学方法 采用SPSS 23.0进行统计学分析。所有连续变量采用±s,或中位数(上下四分位数)[M(QL,QU)]描述以及采用频数(率)描述分类变量。连续变量间比较采用独立样本t检验(正态分布)或Mann-Whitney U检验(偏态分布)。分类变量间比较应用χ2检验。检验水准α=0.05。
2 结果
2.1 一般资料 共纳入125例患者,中位年龄28.0(19.0,42.0)岁,女性71例(56.8%)。与非运动障碍组相比,运动障碍组的发病年龄较小[26.0(19.0,32.0)岁 vs.30.5(21.0,47.0)岁,P=0.016]以及女性(67.6%vs.42.6%,P=0.005)较多见。两组间比较详见表1。
2.2 临床表现 患者均以急性或亚急性起病,其中运动障碍组71例(56.8%),非运动障碍组54例。口周不自主运动、肌张力障碍、震颤、刻板运动、舞蹈症、肌阵挛、帕金森综合征以及紧张症的发生率依次为 64.8%(46/71)、25.4%(18/71)、22.5%(16/71)、15.5%(11/71)、12.7%(9/71)、7.0%(5/71)、4.2%(3/71)和2.8%(2/71)。71例出现运动障碍的患者中,36(50.7%)例出现一种运动障碍,32(45.1%)例出现两种运动障碍和3(4.2%)例出现三种运动障碍。在36例一种运动障碍的患者中,口周不自主运动(36.1%)、震颤(25.0%)及肌张力障碍(13.9%)出现频率较高。口周不自主运动合并肌张力障碍(31.3%)、合并刻板运动(25.0%)以及合并舞蹈症(15.6%)在出现两种运动障碍的患者中发生率较高。出现三种运动障碍的患者仅3例。
运动障碍组发热(74.6%vs.38.9%,P<0.001)、癫痫(76.1%vs.59.3%,P=0.045)及通气不足(21.1%vs.5.6%,P=0.014)的发生率均高于非运动障碍组,而其他临床表现在两组中无统计学差异(P>0.05)。运动障碍组住院天数[31.0(23.0,42.0)d vs.22.5(15.0,28.0)d,P=0.008]长于非运动障碍组。此外,急性期mRS[4.0(3.0,5.0)vs.3.0(2.0,4.0),P<0.001]及出院时mRS[2.0(1.0,4.0)vs.1.0(0.0,2.0),P=0.007],运动障碍组中高于非运动障碍组。两组间的发病至入院时间以及发病至诊断时间均无统计学差异(P>0.05)。两组间的临床表现比较见表1。
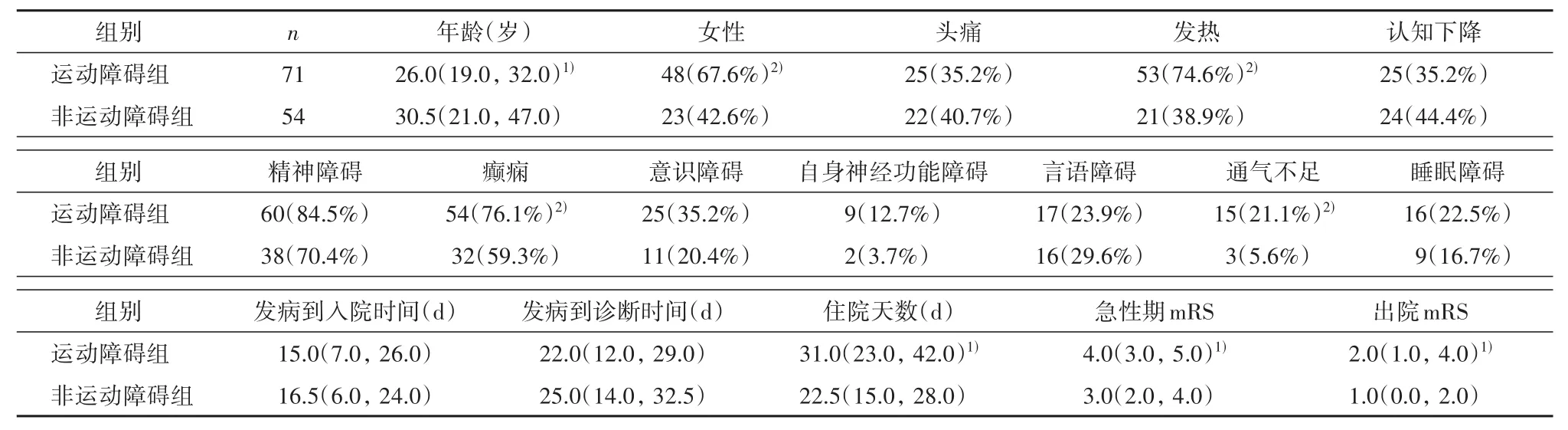
表1 两组间人口统计学及临床特征对比
2.3 治疗、实验室与影像学检查 125例患者中,119例(95.2%)采用一线免疫治疗,包括激素、丙种球蛋白及血浆置换,6例(4.8%)在一线免疫治疗无效的情况下,加用二线免疫治疗,包括吗替麦考酚酯、利妥昔单抗及环磷酰胺等。患者均接受了脑脊液和/或血清抗NMDAR抗体检测,其中98例(78.4%)患者的脑脊液及血清抗体均为阳性,27例(21.6%)患者仅脑脊液抗体阳性。101例(80.8%)患者出现了脑电图异常改变,其中仅有3例患者可见典型的δ刷。23例(18.4%)患者头颅磁共振检查显示相应脑区的T2及T2-FLAIR异常信号,其中2例累及锥体外系。实验室检查、头颅磁共振及脑电图检查在运动障碍组和非运动障碍组间比较无统计学差异(所有P>0.05)。见表2。
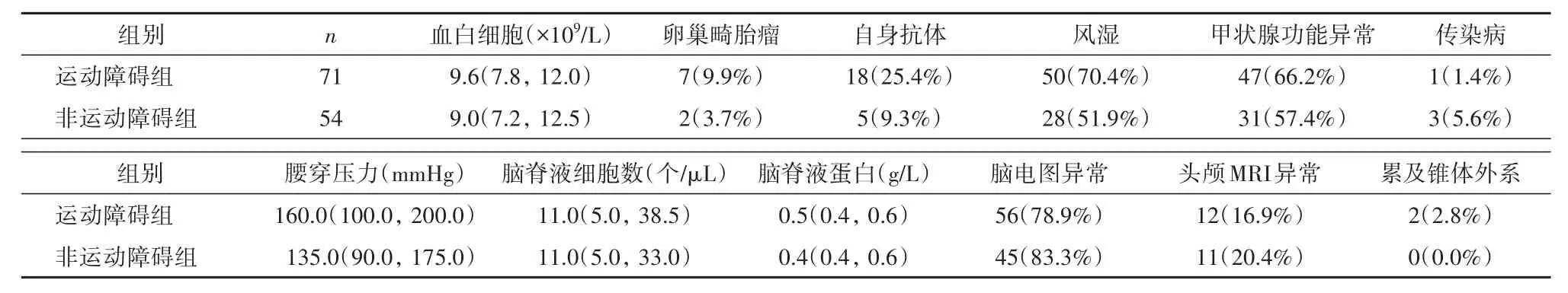
表2 两组间实验室、影像学及脑电图检查对比
3 讨论
本研究比较抗NMDAR脑炎中运动障碍组与非运动障碍组患者的人口统计学特征、临床表现、实验室、脑电图及影像学检查间的差异。与非运动障碍组患者相比,运动障碍组患者的发病年龄较轻、女性患者更多见、住院时间更长,且在疾病急性期及出院时的mRS均明显高于非运动障碍组。此外,运动障碍组的发热、癫痫及通气不足的发生率均显著高于非运动障碍组。
本研究结果表明运动障碍组的发病年龄较非运动障碍组小,这与既往研究报道基本一致。FLORANCE等[12]比较了抗NMDAR脑炎在成人与儿童之间的临床特征、实验室检查、治疗及预后的差异,结果发现运动障碍在年轻患者中更多见(P<0.05)。随后该团队又进行了一项大样本、多中心队列研究,证实运动障碍在年轻患者中更为常见(P<0.001)[2]。
本研究发现在抗NMDAR脑炎中,女性患者发生运动障碍的频率更高,而该结果与先前的研究类似。例如一项纳入了34例确诊为抗NMDAR脑炎且均有运动障碍的患者,经专家评估发现,运动障碍在女性患者中发生率更高(59%)[5]。究其原因,可能与女性患者的雌激素水平增高有关。有研究表明雌激素倾向于通过影响基底神经节加剧或恶化高运动状态,如舞蹈症、肌张力障碍和肌阵挛等[13-14]。因此,临床医生在诊治抗NMDAR脑炎患者时,应更加重视年轻的女性患者。
研究结果显示,抗NMDAR脑炎的患者中癫痫的发生率在运动障碍组更高。尽管癫痫发作和运动障碍是两种神经症状,但多种证据表明癫痫发作和运动障碍可能共存或重叠[15]。传统观点认为癫痫发作起源于大脑皮层神经元的异常放电,而运动障碍多是皮层下的功能异常,主要为基底神经节或其连接的功能异常而引起[15]。然而,研究证实仅用单纯的皮层及皮层下异常来解释癫痫和运动障碍过于简单,因为基底神经节和大脑皮层之间,有着密切的联系,如额叶-纹状体通路[15]。例如,1例同时确诊为癫痫与运动障碍的患者,检查发现癫痫发作来自于运动皮层,同时也发现癫痫发作时的神经元异常放电迅速扩散到基底神经节[16]。因此,我们推测在抗NMDAR脑炎中,疾病可能同时累及大脑皮层及基底神经节,从而导致癫痫发作及运动障碍发生。
相对于非运动障碍组患者,运动障碍组患者的住院天数更长、通气不足频率更高。本研究利用急性期mRS来评估抗NMDAR脑炎的严重程度,结果发现运动障碍组患者急性期mRS高于非运动障碍组。这或许解释了运动障碍组患者的住院时间更长、通气不足及发热更多见,这与既往报告类似[17]。此外,本研究还发现运动障碍组患者出院时mRS较非运动障碍患者高,这表明伴有运动障碍的患者在接受免疫治疗后总体症状仍较非运动障碍组患者重。因此,对于运动障碍的患者,需要更加重视其病情变化,当出现通气不足、发热时,应及时给予呼吸机、吸氧、降温等辅助治疗,以降低患者发生不良预后的风险。
本研究存在一些局限性。首先,本研究只是回顾性研究,且只比较抗NMDAR脑炎中有无运动障碍患者间的临床变量差异,并没有进行前瞻性研究确定两者之间的联系。其次,我们未将运动障碍进一步分组,无法探讨运动障碍其他亚型的临床特点。最后,我们未探究运动障碍与预后之间的关系。
总之,在抗NMDAR脑炎中,发病年龄小、女性、长时间住院、急性期及出院时高mRS、发热、癫痫以及通气不足更多出现在伴有运动障碍的患者中。临床医生在诊疗抗NMDAR脑炎患者的过程中,应予以重视,尽早识别及诊断,予以早期干预,从而降低患者发生不良预后的几率,提高患者的生活质量。

