首发未治疗精神分裂症缺陷和非缺陷亚型脑结构磁共振研究☆
李青 冉娅 魏巍 程勃超 李坤 陈婷 吕笑丽 邓伟※
精神分裂症可分为缺陷型和非缺陷型两类亚型[1]。缺陷型精神分裂症(deficit schizophrenia,DS)是以原发性、持续性阴性症状为特征的亚型。缺陷型占精神分裂症约32.64%[2]。相比非缺陷型精神分裂症(non-deficit schizophrenia,NDS),DS患者的神经认知功能损害更严重、预后更差[3-5]。纵向研究发现DS患者的侧脑室体积较NDS患者更大[6],神经发育相关研究则发现两种亚型患者的局部沟回指数等脑皮质折叠特征的分布模式不同[7],但也有meta分析表明两种亚型患者大脑体积未见明显差异[8]。然而这些研究的对象多是经过治疗或是有较长病程的患者,不同的用药情况以及较长的病程可能会对结果产生影响[9]。本研究拟在首发未治疗的精神分裂症患者中探讨缺陷型与非缺陷型患者大脑灰质、白质体积变化特征。
1 对象与方法
1.1 研究对象 纳入2003年1月至2010年8月四川大学华西医院心理卫生中心门诊及住院的首发未治疗精神分裂症患者。入组标准:①符合《精神障碍诊断与统计手册第四版》(Diagnostic and Statistical Manual of Mental Disorders,Fourth Edition,DSM-Ⅳ)精神分裂症诊断标准;②首次发病,未曾服用过任何抗精神病药物,或服药时间≤3 d且剂量低于常规治疗量;③符合复核分型策略要求(详见后文);④年龄16~45岁;⑤右利手[10],汉族,小学毕业以上文化,可理解神经心理测验内容。排除标准:①患有神经系统疾病,或严重的内分泌或代谢性疾病者;②伴有DSM-Ⅳ轴Ⅰ、Ⅱ其他疾病者;③对检查不合作或不能有效完成测验者;④患有色盲、色弱、口吃、耳聋及智能障碍者;⑤存在MRI禁忌证者。
同期通过广告招募正常对照(healthy controls,HCs)。入组标准:①不患有DSM-Ⅳ轴Ⅰ、Ⅱ的任何疾病,不曾服用抗精神病药、抗抑郁药;②无精神疾病史及家族史;③年龄16~45岁;④右利手,汉族,小学毕业以上文化,可理解神经心理测验内容;⑤社会功能完好(能够完成日常活动,具备社会参与、沟通能力,拥有良好的精神状态)。排除标准:①患有神经系统疾病,或严重的内分泌或代谢性疾病者;②患有色盲、色弱、口吃、耳聋及智能障碍者;③存在MRI禁忌证者。
本研究通过四川大学华西医院生物医学伦理审查委员会审查。受试者本人或监护人研究前签署知情同意书。
1.2 临床分型 采用复核分型策略解决部分首发未治疗DS患者首次评估分型时病程不足的问题。患者入组2年以后进行随访,随访时使用缺陷型精神分裂症诊断量表(schedule for the deficit syndrome,SDS)[11]对首发精神分裂症患者进行复核分型。该量表对情感受限、情感范围减低、言语贫乏、兴趣阻抑、目的性感受差及社会动机减退6种阴性症状的严重程度及原发性进行评估。DS型复核分型标准:至随访期末至少存在2种临床意义显著的上述阴性症状,连续病程2年以上,且阴性症状为原发者。不符合该标准者为NDS型。
1.3 临床评定 入组时收集所有受试者的性别、年龄、受教育年限等一般人口学资料。由经过一致性检验的精神科医生采用DSM-Ⅳ轴Ⅰ障碍临床定式检查(structured clinical interview for DSM-Ⅳ-TR axis I disorders,patients edition,SCID-I/P)对受试者进行系统的精神检查并诊断。采用阳性和阴性症状量表(positive and negative syndrome scale,PANSS)评定患者精神分裂症症状的严重程度。
1.4 影像学数据收集及预处理 所有受试者入组即进行头部MRI扫描。采用GE 3.0 T MR成像系统(EXCITE,General Electric,Milwaukee,USA),并用8通道头线圈提高信噪比。3D T1图像通过3D扰相梯度回波序列(spoiled gradient echo,SPGR)获得。扫描参数:重复时间8.5 ms,回波时间3.4 ms,翻转角12°,层厚1 mm,视野 24 cm×24 cm,矩阵 256×256,体素大小 0.47 mm×0.47 mm×1.00 mm,层数156。由2位放射科主治医师对所有受试者扫描图形进行评定,剔除不合格图像(头动、金属伪影)。
在Matlab 2013 b平台,采用SPM8内建的精确配准李代数微分同胚配准算法(diffeomorphic anatomical registration using the exponentiated Lie algebra,DARTEL)[12]技术,基于体素的形态学分析法对结构MRI数据进行预处理。处理流程包括:图像对齐;磁场不均匀性校正;组织分割;体积调制;空间平滑调制后,参考既往基于体素的形态学研究,对灰白质体积图像采用全宽半高(full width at half maximum,FWHM)值为6 mm的高斯平滑核做高斯平滑[13]。所得平滑后灰质及白质体积图像进行后续分析。
1.5 统计学方法 人口学及临床数据用SPSS 22进行统计分析。采用单因素方差分析对人口学特征进行组间比较,两患者发病年龄、PANSS量表得分组间比较采用独立样本t检验,病程不符合正态分布,组间比较采用Mann-Whitney U检验。影像学数据用SPM 8分析,使用方差分析比较三组间灰质和白质差异,多重比较校正采用族系错误(family-wise error,FWE)法。控制患者年龄、性别及受教育程度,使用偏相关分别分析DS组和NDS组差异脑区体积与PANSS评分相关性。检验水准α=0.05,双侧检验。
2 结果
2.1 一般资料与临床特征 共纳入精神分裂症患者91例,正常对照44名,因未进行MRI扫描或扫描影像质量差剔除3例,最终DS组、NDS组、HC组各44例纳入分析。
三组间年龄、性别、受教育年限及体重差异均无统计学意义(P>0.05)。DS组病程较NDS组长(P<0.05)。PANSS评分比较,DS组的阴性症状分较NDS组高(t=7.70,P<0.01),阳性症状分较NDS组低(t=2.50,P=0.01),两组间一般精神病理分无统计学差异(t=0.01,P=0.99)。见表1。

表1 三组被试一般资料与临床特征
2.2 基于体素的形态学分析 方差分析显示,灰质体积在三组间差异无统计学意义(P>0.05),白质体积在三组间差异具有统计学意义(P<0.05,FWE校正)。进一步的两两比较显示,DS组白质体积较HC组减少(P<0.05,FWE校正),区域包括小脑后叶、双侧枕叶舌回、左侧丘脑,见图1、表2。DS组与NDS组间、NDS组与HC组间的对比未发现白质体积差异有统计学意义(P>0.05)。
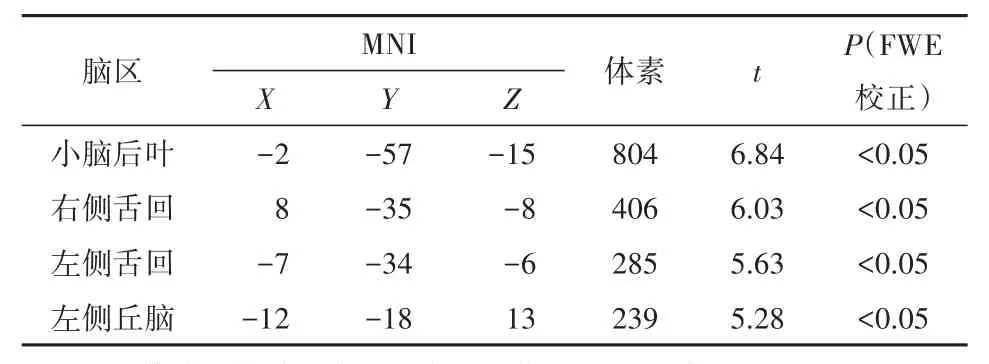
表2 DS组相对于HC组白质体积减少脑区
2.3 白质体积与临床症状相关性 在DS患者中,白质体积与PANSS评分相关性无统计学意义(P>0.05)。在NDS患者中,校正年龄、性别及受教育程度,右侧舌回(r=0.37,P=0.02)及左侧舌回(r=0.39,P=0.01)与PANSS阴性症状量表分存在正相关关系,其他区域白质体积与PANSS评分无统计学相关性(P>0.05)。
3 讨论
本研究通过对首发未服药精神分裂症患者进行缺陷型和非缺陷型分型,发现DS组的病程较NDS组更长,阴性症状更重。通过基于体素的形态学分析发现DS组相对于HC组出现双侧枕叶、左侧丘脑、小脑脑区白质体积减少,并未发现DS组和NDS组灰质、白质体积的差异。在进一步的相关分析中发现NDS患者脑区中双侧枕叶舌回白质体积与阴性症状评分存在正相关。
与NDS患者比较,DS患者突出表现为阴性症状较重,阳性症状较轻,这一结果提示亚型间的PANSS总分差异不能简单解释为症状严重程度的差异,而应根据症状维度进行具体分析[3,14]。首发未服药DS患者阴性症状严重程度更高,提示DS患者在早期阶段就已经存在明显的缺陷症状。同时多项研究发现DS较NDS患者的阴性症状更严重,与认知功能缺陷有关[15],如注意功能障碍[16-17]、记忆功能[18]和执行功能[19]等。DS患者较重的阴性症状不但严重损害神经认知功能,同时也损害社会认知功能[20],如病耻感[17],这些可能是造成DS患者转归差、社会功能恢复困难的原因之一。因此研究DS特异性的生物学标记物能够为精准干预提供有力的证据。
本研究还发现DS患者小脑、双侧枕叶和丘脑的白质体积下降,本课题组前期研究也发现DS患者小脑脑区的白质体积下降,并且在经过1年治疗后白质体积无明显变化,提示小脑的白质体积改变可能是DS神经发育中比较稳定的病理改变[21-22]。小脑异常的结构和功能改变,可能与注意力缺陷等认知功能障碍和社交退缩等社会认知功能障碍[23]有密切的联系。此外也有研究发现DS患者的丘脑结构异常[23],经过治疗后丘脑的灰质体积增加,而白质体积无明显改变[24],表明丘脑灰质可能对药物治疗比较敏感,而白质的修复比灰质更慢。此外,功能网络研究发现DS患者视觉皮质的功能网络存在异常[25-27],提示DS患者枕叶功能网络障碍是DS病理生理机制的重要基础。灰质结构研究发现精神分裂症枕叶皮质异常,DS较NDS的沟回模式指数低[14]。这些研究提示枕叶结构异常是DS的神经发育异常脑区之一。
本研究中一项有趣的发现是NDS组枕叶的白质体积与阴性症状呈正相关,并未发现DS组白质体积与阴性症状相关,提示缺陷分型并不与阴性症状平行发展,单独依靠阴性症状并不能预测疾病的预后。
本研究存在一定不足:首先样本量相对较小,未来研究需进一步扩大样本量。本研究发现首发未服药DS患者表现出比NDS患者更明显的白质结构缺陷,反映DS脑体积缺损在疾病早期即存在,尤其是边缘系统、小脑、枕叶,可能参与DS的病理生理机制,代表着DS结构的“内表型”。

