外周静脉输注脐带间充质干细胞致血栓形成临床研究
陈丰穗吴志贤蔡锦全高霞谭建明
外周静脉输注脐带间充质干细胞致血栓形成临床研究
陈丰穗1吴志贤1蔡锦全2高霞2谭建明2
目的探讨在干细胞的临床应用中,细胞输注后因血液介导的炎症反应,诱发血栓形成的现象及其治疗和预防策略。方法两例分别为肾移植术后和慢性肾脏疾病的患者,在输注脐带间充质干细胞后出现了血栓形成,采集临床表现和实验室检查资料并进行分析。结果通过外周静脉输注干细胞后,患者出现了前臂的疼痛和肿胀。彩超显示距穿刺部位较远距离静脉血栓形成,使用尿激酶和华法林进行溶栓治疗后,肿胀和疼痛得到缓解。结论血栓形成是干细胞临床治疗的一个重要安全性问题,应予以重视并采取充分的预防措施。
间质干细胞; 血栓形成; 肾移植; 肾病; 慢性病
人类干细胞具有分化成多种组织细胞、修复受损组织、调节免疫力等功能,这些功能在临床中有良好的应用前景。目前干细胞在移植物抗宿主病、糖尿病、肾移植等疾病有较多的临床研究取得令人鼓舞的临床效果[1-5]。但是,安全性的问题仍然是干细胞临床应用的主要挑战和障碍之一。目前已经有报道一些致命性的并发症如肺栓塞等[4]。另外有报道证明,干细胞接触血液后,会促进血栓的形成。其机制是由于血液介导的炎症反应(instant blood-mediated in fl ammatory reaction,IBMIR)[5],肝素等抗凝剂能有效防止血栓形成,增强了干细胞输注的安全性。然而,仍然需要加强预防干细胞的临床安全问题。本文中报道了两例患者输注干细胞后形成静脉血栓,通过抗凝治疗后好转,并回顾了输注干细胞后血栓形成机制的文献。
资料与方法
一、一般资料
患者一,男性,50岁。3年前诊断为慢性肾功能不全,渐进性发展为终末期肾病。于2011年11月30日行肾移植术。患者术后定期接受干细胞输注治疗,目的在于调节免疫和优化免疫抑制剂方案[3]。2011年12月12日该患者行第1次“外周血干细胞移植术”,术前给予低分子量肝素(2 500 IU,皮下注射),甲强龙琥珀酸钠(40 mg 静脉滴入)和盐酸异丙嗪(25 mg肌肉注射)。然后输注脐带间充质干细胞,细胞数量为 6.0×107个(1.0×106/kg)。2012年12月 14日进行第2次输注干细胞。2012年12月28日第3次输注干细胞之前,体检发现右结膜下出血,因此临床医师向干细胞实验室建议干细胞保存液不添加普通肝素。在输注之前,凝血试验和肢体血管超声未见明显异常。
患者二,男性,28岁。2013年10月11日入组,诊断为慢性肾功能不全,肌酐水平为281.6 μmol/L。为了改善慢性肾脏炎症,患者输注了细胞数量为 5.5×107(1.0×106/kg)的脐带间充质干细胞,输注时在干细胞保存液中加入了肝素。两例患者输注之前均无长期使用抗凝或促凝药物治疗的病史。
二、脐带间充质干细胞的制备
根据已发表文献[3]的方法进行细胞制备,冷冻脐带间充质干细胞为第2代传代细胞。输注前10 ~ 14 d,将细胞解冻并扩增至第4代或第5代。在输注当天,将脐带间充质干细胞混悬于含有10 U/ml肝素钠的生理盐水中用于输注,在输注前取保存液样品行细菌、支原体、真菌培养和内毒素检测。
对于肾移植的受者,需要在输注后观察免疫抑制剂剂量和检查肾功能。对于慢性肾脏疾病患者,需要观察肾功能和尿常规。重点观察是否出现发热、外周静脉血栓形成、肺栓塞和全血细胞计数和凝血功能。
结 果
干细胞输注后的第3天,患者一出现了前臂肿胀和疼痛。彩超检查显示在右肱静脉的远心端处有一个52.6 mm×5.0 mm的低回声无流动区域(图1a)。距穿刺部位距离大于40 cm,考虑与穿刺无关,与干细胞输注后血栓形成有关。输注前凝血试验显示凝血酶原时间为11.5 s,活化部分凝血活酶时间24.4 s,凝血酶时间17 s,纤维蛋白原3.12 g/L,D-二聚体阴性。输注后发生肿胀,查凝血试验除了D-二聚体升高(7.89 mg/L)外,与血栓形成前无明显差异。诊断干细胞输注诱导静脉血栓形成。给予尿激酶(2×105U,每天2次,静脉输注)、华法林(2.5 g,每天1次,口服)进行溶栓治疗后,肿胀和疼痛逐渐缓解。治疗过程中未出现颅内或胃肠道出血、皮下瘀斑。10 d后彩超提示血栓减小为28.5×3.6 mm,证明上述治疗有效,溶栓治疗维持了10 d后该患者右前臂肿胀完全消退。后期随访未发现右臂再次出现肿胀疼痛等异常。
患者二在输注细胞2 d后同样出现右前臂肿胀和疼痛。彩超检查发现在右肱静脉下1/3段有一个大小约为37.5 mm×4.0 mm低回声无流动区域(图1b),与穿刺点距离40 cm以上。凝血试验显示凝血酶原时间为12.3 s,活化部分凝血活酶时间26.8 s,国际标准化率1.05,凝血酶时间为16.2 s,纤维蛋白原3.05 g/L,D-二聚体活性下降,肿胀发生后凝血试验唯一的改变是D-二聚体水平升高(12.4 mg/L)。该患者最终诊断为静脉血栓形成,用尿激酶联合抗凝治疗7 d后血栓溶解。
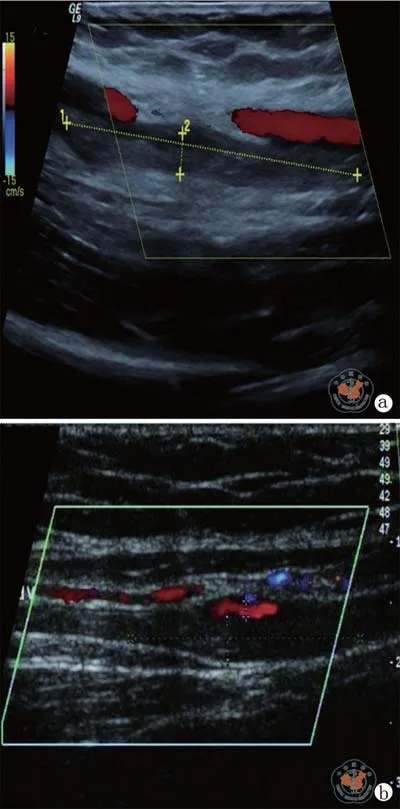
图1 彩超下观察二例患者右肱静脉
讨 论
混合淋巴细胞反应显示人间充质干细胞可以抑制淋巴细胞的同种异体反应活性,其机制与人类白细胞抗原无关[8-10]。静脉输注间充质干细胞可以促进肾、神经和肺损伤的修复,其机制主要是干细胞发挥旁分泌作用,产生抗炎细胞因子[11-12]。一项大样本的临床试验发现,肾移植应用自体间充质干细胞可以明显减少急性排斥反应,获得更好的肾功能,明显减少肾移植术后不良事件[3]。
研究发现细胞静脉输注可诱导IBMIR,IBMIR被广泛证实能够破坏移植的胰岛细胞[13],从而迫使临床1型糖尿病患者增加移植的胰岛细胞数量[14]。机制研究表明补体途径和凝血途径的激活在IBMIR中扮演了重要的角色,这两种途径引起血凝块的形成从而导致移植细胞受损。最近发现IBMIR现象同样发生于肝细胞移植和间充质干细胞治疗中[15]。另有研究表明,间充质干细胞暴露于ABO血型相容的人类血液后,触发了补体活化[16]。因此,以上研究提示了非直接接触血液的细胞在进入血液循环后可以诱导IBMIR。
组织因子是引起凝血途径的启动因子,间充质干细胞细胞表面可广泛表达组织因子[17]。实验研究证实抗组织因子抗体和Ⅴ、Ⅷ因子血浆可抑制间充质干细胞的促凝血反应。未培养的干细胞无促凝血反应功能,说明细胞培养是间充质干细胞细胞表面表达组织因子的重要诱因。因此,在间充质干细胞的临床应用中,使用抗凝血药抑制组织因子活性可能使患者获益。
患者一输注的干细胞保存液中未加入肝素,很可能因此导致了血栓的形成。但患者二使用了常规剂量的肝素,也发生了静脉血栓。肝素是最常用于间充质干细胞保存液的有效抗凝方法之一,而研究表明它的抗凝效果不如凝血酶拮抗剂[18]。Tatsumi等[17]提出凝血因子表达需要的肝素依赖(非依赖)这两条途径都可以被凝血酶拮抗剂抑制,因此目前临床上迫切需要更加有效的拮抗剂。
慢性肾脏疾病患者血液容易形成血栓,但是目前很少有文献报道慢性肾脏疾病患者输注人干细胞后的不良事件。有研究报道将干细胞直接注射到狼疮性肾炎患者的肾实质后,发生了血管肉瘤增生性病变[20]。因此还需要进一步收集慢性肾脏疾病患者应用干细胞的安全性数据。
总之,注入脐带间充质干细胞的促凝血反应活性可导致临床输注后不良事件,应进一步研究更为安全有效的抗凝血预防用药方案。
1 Introna M, Lucchini G, Dander E, et al. Treatment of graft versus host disease with mesenchymal stromal cells: a phase I study on 40 adult and pediatric patients[J]. Biol Blood Marrow Transplant, 2014,20(3):375-381.
2 Hu J, Yu X, Wang Z, et al. Long term effects of the implantation of Wharton’s jelly-derived mesenchymal stem cells from the umbilical cord for newly-onset type 1 diabetes mellitus[J]. Endocr J, 2013,60(3):347-357.
3 Tan J, Wu W, Xu X, et al. Induction therapy with autologous mesenchymal stem cells in living-related kidney transplants:a randomized controlled trial[J]. JAMA, 2012, 307(11):1169-1177.
4 姚志成, 刘波. 间充质干细胞促进肝再生的研究进展[J]. 中华肝脏外科手术学电子杂志, 2016, 5(3):198-200.
5 黄守强, 彭秀军. 间充质干细胞移植治疗眼干燥症的研究进展[J]. 转化医学杂志, 2015, (5):306-310.
6 Cyranoski D. Korean deaths spark inquiry[J]. Nature, 2010,468(7323):485.
7 Martin BM, Samy KP, Lowe MC, et al. Dual islet transplantation modeling of the instant blood-mediated in fl ammatory reaction[J]. Am J Transplant, 2015, 15(5):1241-1252.
8 Bartholomew A, Sturgeon C, Siatskas M, et al. Mesenchymal stem cells suppress lymphocyte proliferation in vitro and prolong skin graft survival in vivo[J]. Exp Hematol, 2002, 30(1):42-48.
9 Krampera M, Glennie S, Dyson J, et al. Bone marrow mesenchymal stem cells inhibit the response of naive and memory antigen-speci fi c T cells to their cognate peptide[J]. Blood, 2003, 101(9):3722-3729.
10 Le Blanc K, Tammik L, Sundberg B, et al. Mesenchymal stem cells inhibit and stimulate mixed lymphocyte cultures and mitogenic responses independently of the major histocompatibility complex[J].Scand J Immunol, 2003, 57(1):11-20.
11 Ortiz LA, Gambelli F, Mcbride C, et al. Mesenchymal stem cell engraftment in lung is enhanced in response to bleomycin exposure and ameliorates its fi brotic effects[J]. Proc Natl Acad Sci U S A, 2003,100(14):8407-8411.
12 Tögel F, Hu Z, Weiss K, et al. Administered mesenchymal stem cells protect against ischemic acute renal failure through differentiationindependent mechanisms[J]. Am J Physiol Renal Physiol, 2005, 289(1):F31-F42.
13 Nilsson B, Teramura Y, Ekdahl KN. The role and regulation of complement activation as part of the thromboin fl ammation elicited in cell therapies[J]. Mol Immunol, 2014, 61(2):185-190.
14 Ozmen L, Ekdahl KN, Elgue G, et al. Inhibition of thrombin abrogates the instant blood-mediated in fl ammatory reaction triggered by isolated human islets: possible application of the thrombin inhibitor melagatran in clinical islet transplantation[J]. Diabetes, 2002, 51(6):1779-1784.
15 Gustavson SM, Rajotte RV, Hunkeler D, et al. Islet auto-transplantation into an omental or splenic site results in a normal beta cell but abnormal alpha cell response to mild non-insulin-induced hypoglycemia[J]. Am J Transplant, 2005, 5(10):2368-2377.
16 Moll G, Jitschin R, Von Bahr L, et al. Mesenchymal stromal cells engage complement and complement receptor bearing innate effector cells to modulate immune responses[J]. PLoS One, 2011, 6(7):e21703.17 Tatsumi K, Ohashi K, Matsubara Y, et al. Tissue factor triggers procoagulation in transplanted mesenchymal stem cells leading to thromboembolism[J]. Biochem Biophys Res Commun, 2013,431(2):203-209.
18 Gast A, Tschopp TB, Schmid G, et al. Inhibition of clot-bound and free(fluid-phase thrombin) by a novel synthetic thrombin inhibitor (Ro 46-6240), recombinant hirudin and heparin in human plasma[J]. Blood Coagul Fibrinolysis, 1994, 5(6):879-887.
19 Stephenne X, Nicastro E, Eeckhoudt S, et al. Bivalirudin in combination with heparin to control mesenchymal cell procoagulant activity[J]. PLoS One, 2012, 7(8):e42819.
20 Thirabanjasak D, Tantiwongse K, Thorner PS. Angiomyeloproliferative lesions following autologous stem cell therapy[J]. J Am Soc Nephrol,2010, 21(7):1218-1222.
Thromboembolism induced by umbilical cord mesenchymal stem cell infusion
Chen Fengsui1,Wu Zhixian1, Cai Jinquan2, Gao Xia2, Tan Jianming2.
1Department of Hepatobiliary Disease,2Department of Urology, Fuzhou General Hospital, Fuzhou 350025, China
Tan Jianming, Email:doctortjm@yahoo.com
ObjectiveTo investigate the thromboembolism induced by blood-mediated inflammatory reactions against infused cells during the clinical application of stem cells.MethodsTwo patients with renal transplantation and chronic kidney disease, respectively experienced thromboembolism after umbilical cord mesenchymal stem cell(UCMSC)infusion. The clinical manifestations and the laboratory test results were collected and analyzed.ResultsThe patients
stem cell infusion through the peripheral veins and presented with a swollen and painful forearm post-infusion. Doppler ultrasound showed venous clots at the proximal end of the puncture site. Urokinase and warfarin were used for thrombolytic therapy. The swelling and pain were relieved and cured.ConclusionThromboembolism in stem cell therapy should be prevented appropriately
Mesenchymal stem cell; Thromboembolism; Renal transplantation;kidney disease; Chronic disease
2016-11-16)
(本文编辑:陈媛媛)
10.3877/cma.j.issn.2095-1221.2017.03.007
中国博士后基金(2016M590597);福建省自然科学基金面上项目(2016J01583);福建省科技创新联合资金项目(2016Y9063)
350025 福州总医院肝胆内科1,泌尿外科2
谭建明,Email:doctortjm@yahoo.com
陈丰穗,吴志贤,蔡锦全,等.外周静脉输注脐带间充质干细胞致血栓形成临床研究[J/CD].中华细胞与干细胞杂志(电子版),2017,7(3):159-161.

