淋巴细胞亚群成员研究进展
马锡慧 肖漓
·综述·
淋巴细胞亚群成员研究进展
马锡慧 肖漓
淋巴细胞是人体重要的免疫细胞,占外周血白细胞总数的20%~ 45%,主要分为T细胞、B细胞和NK细胞三大类。根据细胞表面标志及功能特征,将淋巴细胞亚群分为CD3+CD4+辅助性T细胞、CD3+CD8+的细胞毒性T细胞、CD19+B细胞、CD16+CD56+NK细胞。随着基础免疫学及免疫学技术的不断发展,临床和科研工作者不断地将淋巴细胞亚群细化并发现一些新的亚群,包括γδT细胞、Th1/Th2细胞、Th17细胞、Th9细胞、Tfh细胞、Treg细胞、Breg细胞、NKT细胞和NKB细胞等,淋巴细胞亚群的内容也随之被赋予了新的定义,现将近年来淋巴细胞亚群的研究进展进行综述。
T淋巴细胞亚群; B淋巴细胞亚群; 杀伤细胞,天然; 淋巴细胞亚群
随着免疫学的发展和免疫学技术的进步,横向来看,淋巴细胞亚群由相对计数发展到绝对计数;纵向来看,淋巴细胞亚群的细分更加精细化,并且各亚群在免疫网络中的作用日渐明显[1]。另外,临床和科研工作者不断地发现新亚群,使得淋巴细胞亚群在相关疾病的诊疗中的作用日趋显著[2],全面了解淋巴细胞的内容及分类,不仅是基础免疫学的范畴,更是临床诊疗的有力工具。本文对淋巴细胞亚群的成员(包括:淋巴细胞亚群类别、淋巴细胞亚群的细分和淋巴细胞特殊亚群)及研究进展进行综述,具体内容见表1。
一、淋巴细胞亚群类别及研究进展
(一)T淋巴细胞亚群
T淋巴细胞来源于骨髓的淋巴样干细胞,在胸腺中发育和分化成熟,T细胞在胸腺的发育成熟过程中,经历阳性和阴性选择,分化为CD4+T细胞和CD8+T细胞。一般而言,二者均为αβ T细胞,其中CD4+T细胞为辅助性T细胞(helper T cell,Th),在细胞免疫中发挥主要作用,并具有协助体液免疫的功能,可用于评价机体免疫系统的状态。CD8+T细胞为细胞毒性T细胞(cytotoxic T cell,Tc/CTL),是一类具有杀伤活性的效应细胞,主要通过分泌穿孔素、颗粒酶、TNF-α、借助FasL/Fas途径等方式发挥细胞毒效应。T淋巴细胞在外周血中含量最多,占淋巴细胞总数的65%~ 75%。正常状态下T细胞各亚群维持在一定的比例,尤其是CD4+/CD8+比值的稳定和平衡是机体发挥正常免疫功能的关键因素。
(二)B淋巴细胞
B淋巴细胞亦来源于骨髓的淋巴样干细胞,直接在骨髓内分化成熟,B细胞整个发育过程分为两个阶段,第1阶段为抗原非依赖期,在此过程中,经历膜表面分子的改变和免疫球蛋白的基因重排等,最终产生对抗原具有应答能力的成熟B细胞;第2阶段为抗原依赖期,在此过程中,B细胞经历体细胞突变、抗原选择、亲和力成熟、Ig类别转换等,最终分化为记忆性B细胞或浆细胞,从而发挥免疫功能。在外周血中B细胞约占淋巴细胞总数的8%~ 15%。CD19分布于除浆细胞外的B细胞发育的各个阶段,是B细胞的特异性标志,也是传统B淋巴细胞检测的表面标志(CD3-CD19+)。
(三)NK细胞
NK细胞主要来源于骨髓,并在骨髓内发育成熟。NK细胞缺乏T和B细胞的独特标志(TCR、BCR),又称第三类淋巴细胞。外周血中,NK细胞约占淋巴细胞总数的5%~ 10%,且无需抗原预先作用,就可直接杀伤肿瘤和病毒感染的靶细胞,因此在机体免疫监视和早期抗感染免疫过程中发挥重要作用。NK细胞主要通过分泌穿孔素和抗体依赖细胞介导的细胞毒作用(antibody dependent cell-mediated cytotoxicity,ADCC)作用发挥抗肿瘤、抗感染和免疫调节作用。CD56和CD16是NK细胞相对特异性的标志,也是传统T淋巴细胞亚群NK细胞流式检测的依据(CD3-CD16+CD56+)。
(四)淋巴细胞亚群研究进展
T淋巴细胞介导细胞免疫,B淋巴细胞介导体液免疫,NK细胞介导天然免疫。正常情况下,各淋巴细胞亚群(包括T细胞、B细胞、NK细胞等)可维持一定数量和比例,相互作用,稳定调节,维持着机体的正常免疫功能。当不同淋巴细胞亚群的数量及功能发生异常改变时,机体会产生一序列病理变化和免疫功能障碍,导致疾病的发生。大量研究表明,淋巴细胞亚群在肿瘤性疾病[3-5]、感染性疾病[6-8]、器官移植术后[9-11]、自身免疫性疾病、糖尿病等过程中发挥重要作用。
Niu等[3]通过检测淋巴细胞亚群对DC疫苗疗法治疗原发性脑肿瘤患者的短期免疫状态进行评估,发现DC疫苗具有诱导产生针对肿瘤细胞的免疫细胞毒性效应的潜力,进而验证了淋巴细胞亚群在脑肿瘤中发挥作用。Lisse等[7]的研究表明T淋巴细胞亚群在水痘感染急性期发生显著变化,包括CD4+T细胞的减少和CD8+T细胞的增加。而这些变化在水痘感染一个月后恢复正常。从而得出结论:T淋巴细胞亚群在水痘感染后的病程转归中发挥重要作用。Bravo Soto等[9]在术后12个月内连续监测了3组不同免疫抑制剂方案的肾移植受者的外周血淋巴细胞亚群,包括CD3+T细胞、CD3+CD4+辅助性T细胞、CD3+CD8+杀伤性T细胞、CD19+B细胞、CD3-CD16+NK细胞,结果显示骁悉能够通过“天然免疫进化”降低早期CD19+B细胞的数量,使外周血淋巴细胞各亚群的数量发生变化,进而为移植患者的免疫监测提供了一种新方法。
Jiang等[12]通过检测重症自身免疫病患者在自体造血干细胞移植治疗前后外周血淋巴细胞亚群的动态变化,得出结论:淋巴细胞亚群异常在SLE患者比RA患者更严重,虽然大多数自身免疫性T、B细胞在移植后的患者可有效去除,但非清髓性预处理是自身免疫病复发的危险因素。进而表明淋巴细胞亚群在自身免疫病的诊疗中的作用不可小觑。Kremer等[13]研究了甲氨蝶呤对活动期类风湿性关节炎患者血清细胞因子和T淋巴细胞亚群的影响,结果表明RA患者MTX治疗伴有多种淋巴细胞亚群及细胞因子的变化,而这些变化又反过来剧烈影响临床疾病的活动性和MTX的药代动力学。Francisco等[14]检测了Ⅱ型糖尿病患者的细胞因子谱和淋巴细胞亚群,结果发现产生循环IL-10和IL-17的CD3+T细胞数量显著增加,提示这些细胞因子参与了Ⅱ型糖尿病的免疫病理过程。从而证实淋巴细胞亚群在Ⅱ型糖尿病中发挥重要作用。
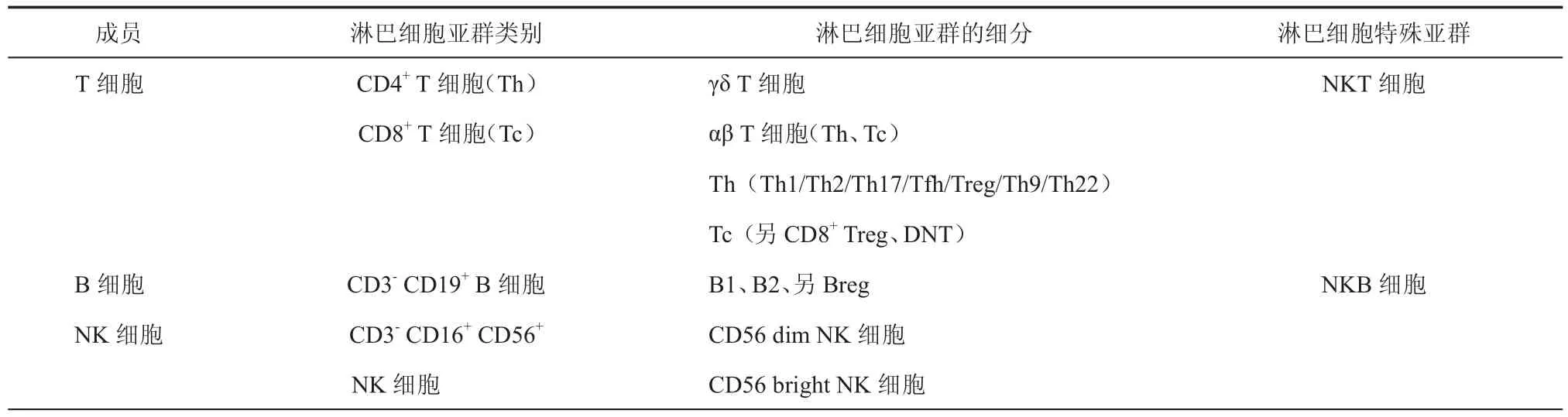
表1 淋巴细胞亚群成员
二、淋巴细胞亚群的细分和研究进展
随着基础免疫学及免疫学技术的不断发展,淋巴细胞亚群已经不仅仅局限于CD4+T细胞、CD8+T细胞、B细胞和NK细胞,各亚群不断细化并逐步发现一些新的亚群,比如:除通常所研究的αβ T细胞之外,γδ T细胞的作用也越来越受到人们重视,CD4+T细胞的功能亚群Th1/Th2细胞、Th17细胞、Treg细胞、Tfh等是临床和科研工作者的研究热点;Breg细胞、NKT细胞、NKB细胞成为医学免疫学的科研新宠。这些研究使淋巴细胞亚群的功能不断扩展,在越来越多疾病中发挥的作用也更加举足轻重。
(一)T淋巴细胞亚群
1.γδ T细胞:按照TCR双肽链的组成分类,T细胞可分为αβ T细胞和γδ T细胞,两者均为CD3+T细胞。通常所指T细胞即为αβ T细胞,是参与机体适应性免疫应答的主要淋巴细胞亚群。成熟αβ T细胞多为CD4或CD8单阳性细胞,其占外周血成熟T细胞的90%~ 95%,而γδ T细胞多为CD4-CD8-双阴性细胞,仅占外周血成熟T细胞的5%~10%,其广泛分布于皮肤和粘膜下,属于固有免疫细胞。
已有多项研究表明[15-18],γδ T细胞不但可以直接识别并杀伤靶细胞,参与早期抗HIV的天然免疫,而且其分泌的各类细胞因子有助于诱发获得性免疫反应,在机体的抗肿瘤、抗感染、抗过敏及自身免疫性疾病中发挥着重要的作用。Kremer[13]的报道指出γδ T细胞通过抗原驱动的方式参与人类纤维性疾病、系统性硬皮病,发挥抗纤维化作用。Henriques等[17]的研究也证明γδ T细胞在肺纤维化疾病和系统性硬皮病中发挥细胞毒效应。Murakami等[18]的研究结果表明:γδ T细胞通过分泌IL-23或独立机制在宿主抗克雷伯菌感染所致肺炎的过程中发挥重要作用。
2. CD4+T细胞(Th细胞)功能亚群:Th细胞并非终末细胞,接受抗原刺激但尚未分化的Th细胞称为Th0细胞,是不同Th细胞功能亚群的共同前体,细胞因子是调控Th细胞亚群分化的关键因素。在细胞因子、抗原特性和激素等因素的影响下,Th0进一步分化为Th1、Th2、Th17、Tfh、Treg、Th9、Th22细胞。微环境IL-12有利于Th0向Th1的分化,其胞内表达转录因子STAT4和T-bet,分泌IFN-γ;微环境IL-4可促进Th0细胞分化为Th2细胞,其胞内表达转录因子 GATA-3和STAT6,分泌 IL-4、IL-10、IL-5和 IL-13;微环境IL-6和TGF-β共同诱导Th0向Th17分化,其胞内表达转录因子RORγt和STAT3,分泌IL-17;IL-6和IL-21诱导Th0分化为Tfh细胞;TGF-β诱导Th0分化为Treg细胞;TGF-β和IL-4诱导Th0分化为Th9细胞 ;IL-6和TNF-α诱导Th0分化为Th22细胞。
CD4+Th细胞亚群并非终末分化细胞,在特定微环境中可被重新塑型为其他亚型。微环境中的细胞因子调控转录因子表达及表型改变,从而改变信号因子及信号转导通路,最终使T细胞功能亚群发生相互转化。CD4+Th细胞功能亚群的可塑性和相互转化意味着免疫应答及调控的再平衡,也决定了该细胞在免疫相关疾病中应用的可能性和广泛性。
Th1和Th2细胞是最先被发现的CD4+T细胞功能亚群,Th1细胞主要通过所产生的炎性细胞因子介导细胞免疫及迟发型超敏反应炎症;Th2细胞主要通过分泌Th2型细胞因子介导体液免疫应答,二者在体内保持动态平衡。Th17细胞可选择性高分泌IL-17而得名,活化的Th17细胞主要抵御胞外病原微生物感染,是最早参与抗感染应答的效应T细胞。Th1/Th2/Th17的数量和比例在多种疾病中作用显著。Choi等[19]报道,辣木叶提取物外用可通过调节Th1/Th2/Th17平衡诱发特应性皮炎,从而证明Th1/Th2/Th17在特应性皮炎中发挥作用。Gupta等[20]的研究表明Th1/Th2/Th17及Treg比例在创伤后脓毒症患者会出现紊乱和失衡,另外,Th2和Th17细胞数量的增多预示创伤后脓毒症发生率更高且预后不良。
调节性T细胞(regulatory T cell,Treg)是一类具有免疫负调节功能的T细胞亚群,约占外周血CD4+T细胞的5%~ 10%。根据CD4+T细胞来源、表面标志、所产生的细胞因子及作用机制,可将其分为自然调节性T细胞(natural Treg,nTreg)和诱导型调节性 T 细胞(inducible Treg,iTreg)。Treg细胞在维持机体内环境稳态、肿瘤免疫监视、诱导移植耐受及自身免疫病发生中发挥重要作用。Christiaansen 等[21]以23例呼吸道合胞病毒感染患儿和17例正常对照婴儿为研究对象,利用流式细胞术检测外周血单个核细胞的Treg细胞及24种细胞因子,研究表明降低Treg的数量和功能可以适当减轻严重呼吸道合胞病毒感染所致的炎症反应。Siemeni等[22]对人源化小鼠肺移植后外周血Treg细胞进行了研究,从而得出结论细胞治疗合并Treg细胞移植可能为肺移植后动脉粥样硬化的治疗提供新的策略。
滤泡辅助性T细胞(T follicular helper cell,Tfh)因定位于淋巴滤泡而得名,表型为CXCR5+CD40 LhiICOShi,高表达 Bcl6,低表达 T-bet、RORγt和 GATA-3等转录因子,Tfh细胞主要功能是促进B细胞分化和记忆性细胞产生。Th9细胞是近年来新发现的一类CD4+Th细胞亚群,因可分泌大量IL-9而得名,其表型特征为CD4+IL-9+IL-4-IL-17-IFNγ-,主要存在于超敏反应性疾病患者外周血及正常或炎症皮肤组织。Th22细胞是2009年在炎症性皮肤病患者表皮浸润的Th细胞中鉴定出的一个新Th细胞亚群,可以分泌IL-22和 TNF-α,不分泌 IFNγ-、IL-4 和 IL-17。Jeon 等[23]报道阻止Tfh细胞增殖可以作为动物模型中自身免疫性疾病和同种异体移植排斥反应的新一代治疗干预措施。Yamasaki等[24]的研究结果表明,DC靶向细胞疫苗借助人工辅助载体细胞成为一种长期产生抗体的机制,在此过程中,Tfh细胞通过Bcl-6途径发挥重要的作用。Luk等[25]对73例活动性狼疮肾炎、13例高血压硬化症、25例健康对照者尿液IL-9、IL-10、IL-22的mRNA水平及相应转录因子进行定量研究,发现Th22细胞的细胞因子mRNA水平在狼疮肾伴增生性肾炎中显著降低,IL-10和IL-22尿mRNA的表达水平可作为评价活动性狼疮肾炎和危险分层的标志物。Ryba-Stanislawowska等[26]研究发现Ⅰ型糖尿病患者Th9、Th22细胞数量及血浆细胞因子水平均下调,并认为Th9和Th22细胞参与Ⅰ型糖尿病慢性低水平的炎症。
3. CD8+T细胞(Tc细胞)功能亚群:Tc细胞是机体发挥特异性细胞毒作用的主要效应细胞,可特异性杀伤靶细胞,主要参与抗胞内感染[27]、抗肿瘤[28]及参与移植排斥反应[29]。CD8+T细胞也并非均一的细胞群体,但对它的研究远不如CD4+T细胞,除Tc细胞外,目前研究相对较多的是CD8+Treg细胞和CD4-CD8-T细胞(DN T),CD8+Treg细胞存在于胸腺、淋巴结和脾脏,在CD8+T细胞中所占比例不足1%,可直接杀伤活化的T细胞,或通过分泌IL-10和TGF-β等发挥免疫抑制作用。外周血DN T细胞在小鼠器官移植模型中被发现,该亚群能诱导CD8+T细胞凋亡,从而发挥负调节作用。
(二)B淋巴细胞功能亚群
根据是否表达 CD5,B 细胞分为 B1(CD5+)和 B2(CD5-)细胞,B1细胞属于固有免疫样B细胞,B2细胞是参与体液免疫应答的主要细胞类别。近年来研究发现,体内存在一类调节性B细胞(regulatory B cell,Breg),主要通过分泌IL-10下调炎症反应、抑制T细胞免疫从而发挥免疫负调节作用[30],Breg细胞也因此成为近年来的研究热点,Kalampokis等[31]的研究结果显示,在多种细胞因子的作用下,自身免疫性疾病患儿的B10细胞数量和频率均下调,从而证明Breg在自身免疫病中发挥重要作用。Ding T等[32]报道,Breg细胞不仅在自身免疫病、炎症和移植中的作用重大,最新研究表明Breg在某些肿瘤的生长和转移中也发挥不可或缺的作用。
(三)NK细胞功能亚群
NK细胞主要来源于骨髓,并在骨髓内发育成熟。NK细胞的活化受其表面活化性受体和抑制性受体调控,活化的NK细胞通过分泌细胞因子和细胞杀伤等方式发挥抗病毒[33-34]、抗肿瘤[35-36]和免疫调控作用[37]。按照CD56表达水平,可将人NK细胞分为两个亚群:CD56 dimNK细胞,占外周血NK细胞的90%,高表达CD16和杀伤细胞免疫球蛋白样受体(KIR),以杀伤功能为主,产生细胞因子的能力较低;CD56 brightNK细胞,占外周血NK细胞总数的10%,高表达CD94/NKG2A,低表达CD16、KIR、CCR7,具有较强分泌细胞因子的能力,细胞毒活性较低。
三、淋巴细胞特殊亚群
传统意义上的淋巴细胞亚群均具有本系相对特异的表面标志,而淋巴细胞亚群中有两类特殊的群体具有跨系标志物,即NKT(natural killer-like T cells,NKT)细胞和NKB(natural killer-like B cells,NKB)细胞。
NKT细胞是一群表面既有T细胞受体TCR,又有NK细胞受体的特殊T淋巴细胞亚群。经典NKT细胞一般为CD4+和DN NKT细胞,其中NK1.1是NKT细胞最主要的表面标志。NKT细胞识别由MHC-Ⅰ类样分子CD1d提呈的脂类抗原,活化后通过分泌细胞因子、胞吐颗粒等在固有免疫中发挥调节和杀伤作用。NKT细胞在自身免疫、抗感染免疫和抗肿瘤免疫中发挥作用[38-39],特别是在自身免疫病中的调节作用受到广泛重视[40-41]。
NKB细胞是近年来被发现的一类同时表达NK细胞和B细胞表面标志的新型B淋巴细胞亚群(NK1.1+CD19+CD3-),存在于脾脏和肠系膜淋巴结中。NKB细胞有不同于T细胞和B细胞的独特特征,在感染早期通过分泌IL-18和IL-12诱导NK细胞和1型先天性淋巴细胞(ILC1s)生成大量IFN-γ,激活天然免疫和适应性免疫,从而对抗微生物感染[42]。
综上所述,淋巴细胞作为人体最重要的免疫细胞,在生理和病理状态下都发挥着不可或缺的作用。淋巴细胞亚群种类繁多,功能各异,淋巴细胞亚群的细分和鉴定已经成为当代免疫学发展的新趋势,也更加符合临床和科研的需要,而淋巴细胞新亚群的研究有助于微环境免疫疾病机制的破解。不同微环境赋予淋巴细胞亚群独特的免疫特性与功能,并介导不同免疫应答和病理,但不同淋巴细胞亚群间复杂的相互调节机制有待进一步阐明。
1 Lv YF, Yan ZY, Chen NY, et al. Analysis of lymphocyte subsets in peripheral blood of patients with aplastic anemia or hypoplastic myelodysplastic syndrome[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi,2016, 24(5):1505-1510.
2 Rudnicka J, Czerwiec M, Grywalska E, et al. In fl uence of fi ngolimod on basic lymphocyte subsets frequencies in the peripheral blood of multiple sclerosis patients-preliminary study[J]. Cent Eur J Immunol,2015, 40(3):354-359.
3 Niu J, Chang Y, Lu X, et al. Effect of dendritic cell vaccine therapy on lymphocyte subpopulation in refractory primary brain tumor[J]. Indian J Cancer, 2016, 52(4):587-589.
4 Hsieh CT, Luo YH, Chien CS, et al. Induced pluripotent stem cellconditioned medium suppressed melanoma tumorigenicity through the enhancement of Natural-Killer cellular immunity[J]. J Immunother,2016, 39(4):153-159.
5 Shao B, Li HP, Di LJ, et al. Predictive and prognostic value of monitoring lymphocyte subsets in peripheral blood before and after chemotherapy in patients with metastatic breast cancer[J]. Beijing Da Xue Xue Bao, 2016, 48(2):304-309.
6 Yushchuk ND, Gadzhikulieva MM, Balmasova IP, et al. The role of immune factors in the progression of chronic kidney diseases in HIV infection[J]. Ter Arkh, 2016, 88(3):56-61.
7 Lisse IM, Qureshi K, Poulsen A, et al. T-lymphocyte subsets and eosinophil counts in acute and convalescence chickenpox infection: a household study in Guinea-Bissau[J]. J Infect, 2005, 50(2):125-129.
8 Yin M, Zhang H, Xu X, et al. Effects of sanjin tablets on T lymphocyte subsets of peripheral blood of women with recurrent urinary tract infection[J]. Zhongguo Zhong Yao Za Zhi, 2011, 36(16):2294-2296.
9 Bravo Soto JA, Esteban De La Rosa RJ, Luna Del Castillo JD, et al. Effect of mycophenolate mofetil regimen on peripheral blood lymphocyte subsets in kidney transplant recipients[J]. Transplant Proc,2003, 35(4):1355-1359.
10 Calarota SA, Zelini P, De Silvestri A, et al. Kinetics of T-lymphocyte subsets and posttransplant opportunistic infections in heart and kidney transplant recipients[J]. Transplantation, 2012, 93(1):112-119.
11 Cho JH, Yoon YD, Jang HM, et al. Immunologic monitoring of T-Lymphocyte subsets and Hla-Dr-Positive monocytes in kidney transplant recipients: a prospective, observational cohort study[J].Medicine (Baltimore), 2015, 94(44):e1902.
12 Jiang Y, Li TS, Zhao Y, et al. Changes of lymphocyte subsets in autologous hemopoietic stem cell transplantation for severe/refractory autoimmune disease[J]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao,2007, 29(3):388-393.
13 Kremer JM, Lawrence DA, Hamilton R, et al. Long-term study of the impact of methotrexate on serum cytokines and lymphocytesubsets in patients with active rheumatoid arthritis: correlation with pharmacokinetic measures[J]. RMD open, 2016, 2(1):e000287.
14 Francisco CO, Catai AM, Moura-Tonello SC, et al. Cytokine profile and lymphocyte subsets in type 2 diabetes[J]. Braz J Med Biol Res,2016, 49(4):e5062.
15 Bank I. The role of γδ T cells in fibrotic diseases[J]. Rambam Maimonides Med J, 2016, 7(4):e0029.
16 Zou C, Zhao P, Xiao Z, et al. γδ T cells in cancer immunotherapy[J].Oncotarget, 2017, 8 (5):8900-8909.
17 Henriques A, Silva C, Santiago M, et al. Subset-speci fi c alterations in frequencies and functional signatures of γδ T cells in systemic sclerosis patients[J]. In fl amm Res, 2016, 65(12):985-994.
18 Murakami T, Hatano S, Yamada H, et al. Two types of interleukin 17A-Producing γδ T cells in protection against pulmonary infection with klebsiella pneumoniae[J]. J Infect Dis, 2016, 214(11):1752-1761.
19 Choi EJ, Debnath T, Tang Y, et al. Topical application of Moringa oleifera leaf extract ameliorates experimentally induced atopic dermatitis by the regulation of Th1/Th2/Th17 balance[J]. Biomed Pharmacother, 2016, 84:870-877.
20 Gupta DL, Bhoi S, Mohan T, et al. Coexistence of Th1/Th2 and Th17/Treg imbalances in patients with post traumatic sepsis[J]. Cytokine,2016, 88:214-221.
21 Christiaansen AF, Syed MA, Ten Eyck PP, et al. Altered Treg and cytokine responses in RSV-infected infants[J]. Pediatr Res, 2016,80(5):702-709.
22 Siemeni T, Knöfel AK, Madrahimov N, et al. In vivo development of transplant arteriosclerosis in humanized mice reflects alloantigen recognition and peripheral Treg phenotype of lung transplant recipients[J]. Am J Transplant, 2016, 16(11):3150-3162.
23 Jeon YH, Choi YS. Follicular helper T (Tfh) cells in autoimmune diseases and allograft rejection[J]. Immune Netw, 2016, 16(4):219-232.
24 Yamasaki S, Shimizu K, Kometani K, et al. In vivo dendritic cell targeting cellular vaccine induces CD4(+) Tfh cell-dependent antibody against in fl uenza virus[J]. Sci Rep, 2016, 6:35173.
25 Luk CC, Tam LS, Kwan BC, et al. Intrarenal and urinary Th9 and Th22 cytokine gene expression in lupus nephritis[J]. J Rheumatol, 2015,42(7):1150-1155.
26 Ryba-Stanis awowska M, Werner P, Brandt A, et al. Th9 and Th22 immune response in young patients with type 1 diabetes[J]. Immunol Res, 2016, 64(3):730-735.
27 Kato S, Asano N, Miyata-Takata T, et al. T-cell receptor (TCR)phenotype of nodal Epstein-Barr virus (EBV)-positive cytotoxic T-cell lymphoma (CTL): a clinicopathologic study of 39 cases[J]. Am J Surg Pathol, 2015, 39(4):462-471.
28 Nakajima H, Murakami Y, Morii E, et al. Induction of eEF2-speci fi c antitumor CTL responses in vivo by vaccination with eEF2-derived 9mer-peptides[J]. Oncol Rep, 2016, 35(4):1959-1966.
29 Cho S, Dong S, Parent KN, et al. Immune-tolerant elastin-like polypeptides (iTEPs) and their application as CTL vaccine carriers[J]. J Drug Target, 2016, 24(4):328-339.
30 Xiao X, Lao XM, Chen MM, et al. PD-1hi Identifies a Novel Regulatory B-cell Population in Human Hepatoma That Promotes Disease Progression[J]. Cancer Discov, 2016, 6(5):546-559.
31 Kalampokis I, Venturi GM, Poe JC, et al. The regulatory B cell compartment expands transiently during childhood and is contracted in children with autoimmunity[J]. Arthritis Rheumatol, 2017,69(1):225-238.
32 Ding T, Yan F, Cao S, et al. Regulatory B cell: New member of immunosuppressive cell club[J]. Hum Immunol, 2015, 76(9):615-621.
33 Wolter F, Glässner A, Krämer B, et al. Hypoxia impairs anti-viral activity of natural killer (NK) cells but has little effect on anti- fi brotic NK cell functions in hepatitis C virus infection[J]. J Hepatol, 2015,63(6):1334-1344.
34 Muntasell A, Costa-Garcia M, Vera A, et al. Priming of NK cell anti-viral effector mechanisms by direct recognition of human cytomegalovirus[J]. Front Immunol, 2013, 4:40.
35 Krzywinska E, Allende-Vega N, Cornillon A, et al. Identification of Anti-tumor Cells Carrying Natural Killer (NK) Cell Antigens in Patients With Hematological Cancers[J]. EBioMedicine, 2015,2(10):1364-1376.
36 Polansky JK, Bahri R, Divivier M, et al. High dose CD11c-driven IL15 is suf fi cient to drive NK cell maturation and anti-tumor activity in a trans-presentation Independent manner[J]. Sci Rep, 2016, 6:19699.
37 Galazka G, Jurewicz A, Domowicz M, et al. HINT1 peptide/Hsp70 complex induces NK-cell-dependent immunoregulation in a model of autoimmune demyelination[J]. Eur J Immunol, 2014,44(10):3026-3044.
38 Viale R, Ware R, Maricic I, et al. NKT cell subsets can exert opposing effects in autoimmunity, tumor surveillance and in fl ammation[J]. Curr Immunol Rev, 2012, 8(4):287-296.
39 Vas J, Mattner J, Richardson S, et al. Regulatory roles for NKT cell ligands in environmentally induced autoimmunity[J]. J Immunol, 2008,181(10):6779-6788.
40 Reis EA, Athanazio DA, Lima I, et al. NK and NKT cell dynamics after rituximab therapy for systemic lupus erythematosus and rheumatoid arthritis[J]. Rheumatol Int, 2009, 29(4):469-475.
41 Aggarwal A, Sharma A, Bhatnagar A. Bi(o)communications among peripheral blood fractions: a focus on NK and NKT cell biology in rheumatoid arthritis[J]. Autoimmunity, 2013, 46(4):238-250.
42 Wang S, Xia P, Chen Y, et al. Natural killer-like B cells prime innate lymphocytes against microbial infection[J]. Immunity, 2016,45(1):131-144.
Research progress in members of lymphocyte subsets
Ma Xihui, Xiao Li.
Beijing Key Laboratory of Immunology Regulatory and Organ Transplantation, Basic Research Laboratory of Organ Transplant Institue, the 309th Hospital of Chinese People's Liberation Army, Beijing 100091, China Corresponding author:Xiao Li, Email:xiaolilab309@163.com
Lymphocytes are very important immune cells in the body, accounting for 20% ~ 45% of peripheral leukocytes. The three major subpopulation of lymphocytes are T cells, B cells and NK cells. According to different surface markers and functional characteristics, lymphocytes are mainly divided into CD3+CD4+helper T cells, CD3+CD8+cytotoxic T cells, CD19+B cells and CD16+CD56+NK cells. With the development of basic immunology and immunological techniques,new lymphocyte subsets are proposed, including gamma delta T cells, Th1/Th2 cells, Th17 cells,Th9 cells, Tfh cells, Treg cells, Breg cells, NKT cells, NKB cells, etc.The definition of lymphocyte subsets are refined constantly. The present review summarizes recent research progress of lymphocyte subsets.
T lymphocyte subsets; B lymphocyte subsets; Killer cells, natural;Lymphocyte subsets
2017-01-03)
(本文编辑:李少婷)
10.3877/cma.j.issn.2095-1221.2017.03.009
解放军第309医院院内课题(2016MS-002)
100091 北京,解放军第309医院器官移植研究所移植研究室 北京市器官移植与免疫调节重点实验室
肖漓,Email:xiaolilab309@163.com
马锡慧,肖漓.淋巴细胞亚群成员研究进展[J/CD].中华细胞与干细胞杂志(电子版),2017,7(3):168-172.

