免疫磁珠分离淋巴细胞在流式交叉配型试验中的应用及研究
郭靖罗奇志田芳郭旭丽罗伟光邹义洲
免疫磁珠分离淋巴细胞在流式交叉配型试验中的应用及研究
郭靖1,2罗奇志1田芳1郭旭丽1罗伟光1邹义洲1
目的探讨免疫磁珠快速分离法及密度梯度离心(Ficoll)分离法分离外周血单个核细胞(PBMC)在流式细胞交叉配型中的应用比较。方法取10例交叉配型供体外周抗凝血各10 ml,受体非抗凝血5 ml,分别采用密度梯度离心与免疫磁珠阴性选择试剂盒从相同体积的抗凝血中分离PBMC。用血细胞计数比较两种方法分离的WBC、PLT、RBC粒度分布和PBMC中淋巴细胞的纯度;用细胞流式和淋巴细胞表面标记荧光抗体检测两种方法分离得到的PBMC中T、B和NK细胞的数量质量;将免疫磁珠阴性分离和密度梯度离心法分离的供者PBMC与受者血清共孵育,加入羊抗人IgG-FITC,洗涤后加入抗人CD3-PE、抗人CD19-APC单克隆抗体,再用流式细胞仪检测细胞表面荧光强度。采用方差分析和t检验进行统计学分析。结果免疫磁珠阴性分离的PBMC数量是Ficoll分离PBMC的0.42倍,但淋巴细胞的比例[(99.2±0.08)%]高于PBMC分离的淋巴细胞比例[(82.5±5.27)%(t = 9.91,P < 0.01)],且两种方法分离的PBMC 中 RBC 分别为(0.001±0.001)×106/μl和(0.02±0.009)×106/μl(t = 6.64,P < 0.001);血小板的数量分别为(1.00±0.05)×103/μl和(196.00±4.21)×103/μl差异均有统计学意义(t =146.46,P < 0.01)。流式细胞检测免疫磁珠分离的PBMC中CD3+T细胞为(81.33±4.60)%,CD19+B细胞为(8.41±0.87)%,CD3-CD56+NK细胞为(9.35±0.67)%和CD3+CD56+NKT细胞为(2.47±0.07)%。而Ficoll分离的PBMC中CD3+T细胞为(37.36±3.27)%,CD19+B细胞为(5.79±0.94)%,CD56+NK细胞为(6.60±0.91)%,且差异均有统计学意义(t = 24.64、6.470、7.70、51.31,P均< 0.01)。T和B淋巴细胞流式交叉配型试验中,设门定量读取T和B淋巴细胞与受者血清中抗体结合情况,密度梯度离心获得的淋巴细胞中混有血小板等,使流式检测结果中会混有假阴性,而免疫磁珠分离法没有出现假阴性结果。证明免疫磁珠分离的PBMC可应用于临床交叉配型试验。结论免疫磁珠阴性选择分离全血PBMC,用时短,纯度高,去除了99%的血小板,不混有红细胞、血小板,是一种优于Ficoll分离PBMC的新方法。
外周血; 单核细胞; 离心法,梯密度; 免疫磁珠分离; 组织相容性试验
外周血单个核细胞(peripheral blood mononuclear cell,PBMC)即外周血中具有单个核的细胞,包括淋巴细胞和单核细胞。PBMC是临床和科研中研究与免疫学功能相关的重要免疫细胞。很多医院开展淋巴细胞表型检测、器官移植中的淋巴细胞交叉配型、科研中某种单核细胞的培养和人体DNA的抽提等,大都需要先从外周血分离PBMC。目前主要的分离方法有Ficoll-hypaque(聚蔗糖-泛影葡胺)密度梯度离心法(Ficoll),其原理是不同种类细胞颗粒之间存在沉降系数差,在一定离心力作用下,颗粒各自以一定速度沉降,在密度梯度不同区域上形成区带[1-2]。该方法分离的单个核细胞成分混杂,常含有一些血小板与红细胞。如要获得纯度更高的PBMC,可采用EasySep免疫磁珠阴性选择分离方法。其原理是用多种非淋巴细胞单克隆抗体,与微小免疫磁珠一起加入全血中,吸附不需要的红细胞、血小板和非淋巴细胞等,分离出未被磁珠吸附的淋巴细胞。本研究是应用新的淋巴细胞快速分离方法获取PBMC,分析其分离效果,并试用于临床器官移植前的流式交叉配型试验。
材料与方法
一、材料
1.样品:肾脏移植手术肾脏供者外周血10 ml,分装成两管,肝素抗凝,室温保存备用。受者非抗凝血5 ml,对10例交叉配型试验与传统分离法进行了对比分析。
2.主要仪器:高速台式离心机(德国Eppendorf公司),流式细胞仪(美国BD公司),血球计数板(美国 Hausser scienti fi c公司),50 ml离心管(美国Corning 公司),Mini-MACS磁性吸附性分离装置、MS吸附柱(德国Miltenyi Biotec 公司),全自动血细胞分析仪(美国Bechman公司)。
3.主要试剂 :Ficoll-Hypaque分离液(天津市灏洋生物制品科技有限责任公司),氯化钠注射液(湖南科伦制药有限公司),肝素钠注射液(天津生物化学制药有限公司),EasySep Direct Human Total lymphocyte Isolation kit(美 国 Stemcell公 司)免疫磁珠缓冲液(德国Miltenyi Biotec公司),鼠抗人CD3-PE单抗、鼠抗人CD19-APC单抗、鼠抗人CD56-FITC流式单抗、鼠抗人IgG-FITC(美国BD公司)。
二、方法
(一)Ficoll分离PBMC
在15 ml离心管中加入5 ml淋巴细胞分离液Ficoll;取5 ml抗凝外周血与5 ml无菌RPMI-1640按照1:1充分混匀,用移液管沿管壁缓慢叠加于分层液面上;500×g水平离心20 min;离心后管内分为3层,用移液器插到云雾层,吸取单个核细胞至另一15 ml离心管中,加入3倍以上体积的PBS,300×g离心10 min,洗涤细胞2次;末次离心后,弃上清液,细胞计数,用10%人血清PRMI-1640培养基调整细胞至1×106/ml.
(二)免疫磁珠阴性选择分离PBMC
按照人总淋巴细胞直接分离试剂盒(EasySepTM)的步骤说明操作,将1 ml×5新鲜肝素抗凝全血加入5 ml的圆底聚苯乙烯管,依次加入50 μl Isolation Cocktail和 50 μl RapidSpheresTM,混匀后室温孵育5 min;加入PBS至终体积为2.5 ml,轻轻吹打2 ~ 3次使其混匀;将不带盖的聚苯乙烯管放入磁极,室温孵育5 min,在不拿出磁极的情况下,混旋细胞悬液并倒入新的聚苯乙烯管,将收集的细胞悬液加入再加入50 μl RapidSpheresTM进行二次分离,获得的细胞悬液约2 ml,可进行下一步实验。
(三)全自动血细胞分析仪对PBMC的分析
将全血、密度梯度离心收集的PBMC和EasySep负性选择分离的PBMC,按分离前全血的用量调整细胞检测的浓度。各取50 μl用全自动血细胞分析仪进行分析。
(四)流式细胞术分析PBMC细胞中淋巴细胞比例
将上述两种方法收集的PBMC各100 μl,抗凝全血100 μl,分别装在2个试管中,分别加入鼠抗人CD19-APC流式单抗和鼠抗人CD3-PE流式单抗;CD3-PE 和 CD56-FITC 流式单抗各 20 μl。4 ℃孵育 30 min;PBS洗 3次,用 500 μl PBS重悬后,流式细胞仪分析。
(五)流式细胞仪交叉配型
将供者外周血按两种不同方法分离的PBMC分别制成浓度为1×106/ml的混悬液,将混悬液100 μl分别装在3个试管中,离心,去上清液。分别加入50 μl用10%人血清RPMI-1640按1:5稀释的阴性对照、阳性对照和患者血清。混匀后置4 ℃孵育30 min;PBS洗涤3次,加入鼠抗人IgG-FITC,4 ℃避光孵育30 min后,分别加入PBS洗涤3次,加入抗人CD3-PE、抗人CD19-APC单克隆抗体,4 ℃孵育10 min,再次洗涤;然后将细胞用500 μl PBS重悬后,用流式细胞仪3个颜色通道进行分析。
三、统计学分析方法

表1 血细胞自动分析仪检测不同方法分离的PBMC纯度
结 果
一、免疫磁珠法与Ficoll法分离PBMC细胞分类计数
取相同体积经EasySep和Ficoll分离获得的PBMC,与抗凝全血用分析仪进行血细胞计数。用Ficoll和Easy Sep法分离PBMC与原全血样本的血细胞计数粒度分布如图1所示:最明显的效果是用Easy Sep方法分离的PBMC中几乎不混有血小板,而且含有红细胞的比例也显著减少。表1列出了血细胞计数的具体数据。尽管EasySep方法在分离PBMC的过程中丢失了58%的WBC,但PBMC中含有淋巴细胞(LY)的比例从全血中的(37.7±1.46)%、Ficoll的(82.5±5.27)%提高至(99.2±0.08)%,三者之间比较,差异有统计学意义。其他细胞如红细胞(RBC)和血小板(PLT)的数量在EasySep分离的PBMC中接近于0,远远少于Ficoll分离的红细胞(0.02±0.009)×106/μl和血小板(196±4.21)×103/μl,两组数据比较,差异有统计学意义。(表1)
二、免疫磁珠阴性分离PBMC的流式细胞表型检测
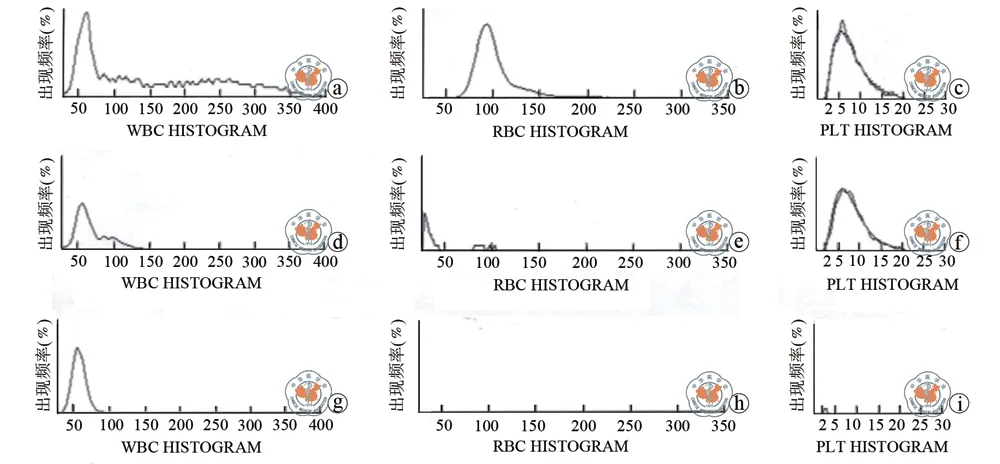
图1 全血、密度梯度离心与Easy Sep分离的PBMC中白细胞、红细胞和血小板粒度分布
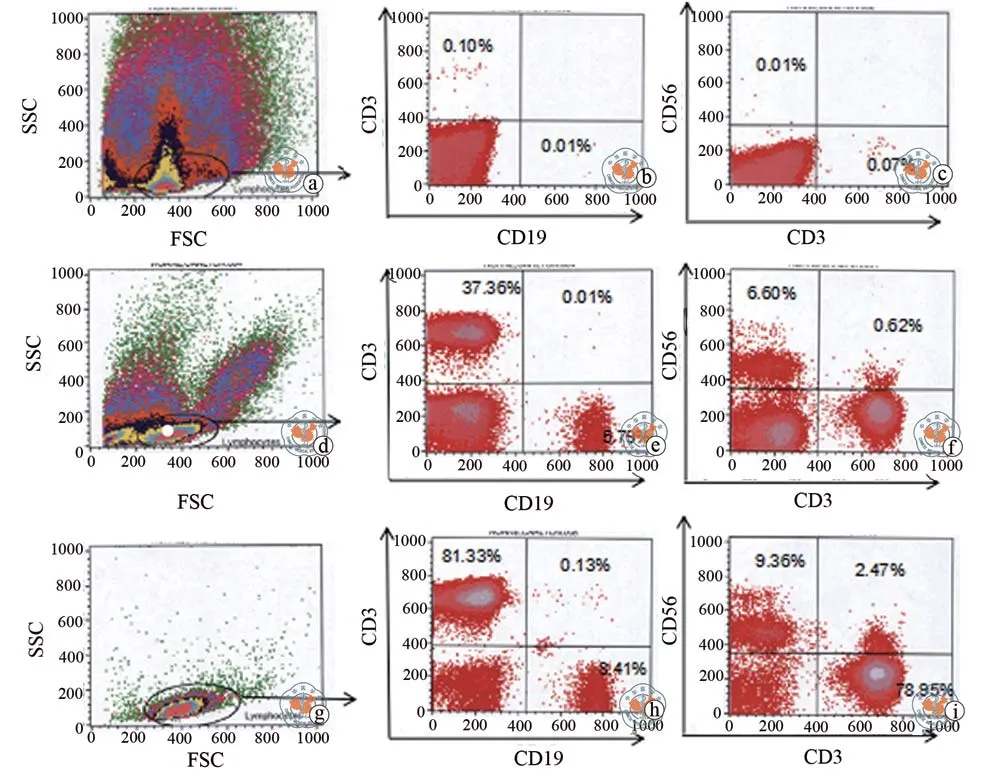
图2 外周血PBMC流式细胞表型测定
将10份血液样本的全血、Ficoll密度梯度离心分离的PBMC和EasySep阴性选择分离的PBMC进行CD3-PE和CD19-APC双染,经流式细胞仪分析(图2),展示样本-1的结果:从细胞SSC-FSC散点图可以看出,EasySep免疫磁珠阴性选择出来的PBMC比Ficoll分离的PBMC纯度要好很多。95%以上的细胞包含在所设的门中。分离得到的PBMC含有(81.33±4.60)%的 CD3+T细胞,(8.41±0.87)%的CD19+B细胞和(9.35±0.67)%的CD3-CD56+NK细胞,CD3+CD56+NKT细胞含量比例为(2.47±0.07)%(如图 2h、i);Ficoll密度梯度离心获得的PBMC中淋巴细胞的含量有所降低(如图 2e、f),CD3+T 细胞为(37.36±3.27)%,CD19+B 细胞为(5.79±0.94)%,CD56+NK细胞为(6.60±0.91)%。提示后者PBMC中混有大量的非淋巴细胞。综合流式检测结果:EasySpe免疫磁珠分离供者的PBMC占分离细胞总数95%,显著性高于Ficoll分离法(95.8%± 2.8%vs 20.3% ±6.8%,P < 0.01)。(表 2)
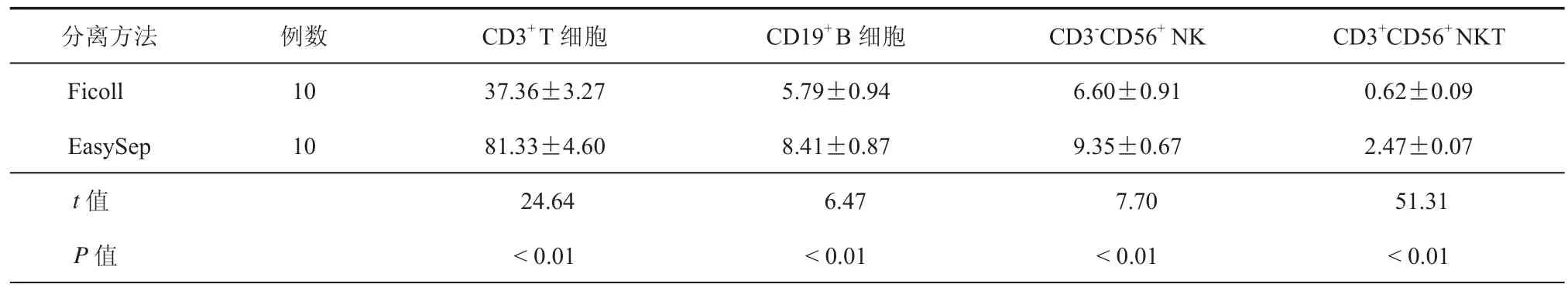
表2 两种方法分离的PBMC中淋巴细胞比例(%)
三、T和B淋巴细胞流式交叉配型
临床肾移植手术前需要做配型试验,即用供者血液中或脾、淋巴结组织中分离的淋巴细胞与受者血清进行抗原抗体反应。T和B淋巴细胞表面表达有HLA-I类抗原分子,B淋巴细胞表面表达有HLA-II类抗原分子。图3是选取10例样本中流式交叉配型中的一例:用供者外周血分离的PBMC与受者血清进行的流式细胞交叉反应。T细胞由CD3-PE标记,B细胞由CD19-APC标记,在流式点图中设门。如果供者T和B细胞与受者血清中可能存在抗供者特异HLA-I类抗体结合,接下来加入的鼠抗人IgG-荧光标记的二抗则能显示出来,并根据细胞表面荧光的亮度进行定量分析。图3a、b、e、f为EasySpe 免疫磁珠分离供者的PBMC,供者T和B淋巴细胞与受者血清中的抗体反应均呈现流式交叉配型阳性反应。图3c、d为Ficoll分离同一供者PBMC,其T和B淋巴细胞与相同受者血清中的抗体反应呈现流式交叉配型阳性反应。图3c、d、g、h中有大量的血小板和红细胞,T、B淋巴细胞分群并不是特别明显,会影响流式实验中门的设置,对检测结果有一定的影响。其他9例的T、B淋巴细胞流式交叉配型方法与上述方法一致。所有的交叉配型流式检测结果显示:应用EasySpe法分离获得的PBMC在进行流式交叉配型试验中,T、B淋巴细胞分群清晰,无血小板的影响,设门准确,实验结果具有更高实验稳定性。
讨 论
分离PBMC是现今临床与科研中的一项常规项目,Ficoll作为传统分离单个核细胞的方法其操作相对简便与价格实惠而一直备受青睐。理想状态下,Ficolll离心法获取单个核细胞的得率为80%~ 90% ,细胞纯度90%以上[4-5]。但实际操作中,由于实验室设备、环境因素及实验操作人员的原因,分离效果往往未能达到理想标准。特别是在临床组织配型实验室的操作过程中很难从全血中获得红细胞和血小板污染较少的PBMC,而混有大量的血小板的PBMC,对待测血清样本中HLA-Ⅰ类抗体具有吸附作用,吸附严重时可能导致交叉配型假阴性结果。另外由于Ficoll离心后取的细胞还需要洗涤几次,实验时间过长,这给临床需要4 h内做出器官移植交叉配型结果带来困难。因此,寻找一种直接从全血中快速分离高纯度的PBMC的分离方法十分必要。
Easy Sep分离法是最新的一种分离方法。其原理是将抗红细胞、血小板、除淋巴细胞以外的血细胞表面标记的单克隆抗体制成免疫磁珠,这些混合的免疫磁珠直接加入到全血中进行细胞吸附,未吸附的淋巴细胞可从磁场中分离洗脱出来,即为阴性选择获得的PBMC。其最少可以从0.5 ~ 1.5 ml的抗凝全血中分离到纯度高(96%)的PBMC,这其中的淋巴细胞可达99%以上,可除掉99.9%的红细胞,并且不含有血小板。在分离过程中不需与其他物品接触,减少了污染,操作简单,费时少。在科研及临床实验室其应用前景十分广范。
临床器官移植,特别是肾移植之前需要用供者的淋巴细胞与受体血清混合进行交叉配型试验,以排除产生超急性体液排斥反应的可能。传统的方法是用Ficoll分离的方法将供者全血中的PBMC分离出来,再进行交叉配型。PBMC的分离需要2 h。最大的问题在于Ficoll分离的PBMC中混有大量的血小板。由于血小板中含有HLA-Ⅰ类的抗原分子,大量的血小板吸附受者血清中可能存在的抗供者HLA-Ⅰ类分子的抗体,进而影响T和B淋巴细胞流式交叉配型的结果。在临床实验中,常需对分离的PBMC进行去红细胞和血小板的处理,但会丢失淋巴细胞。
近几年来,免疫磁珠阴性选择分离全血PBMC,不仅使获得PBMC的时间缩短至20 min以内,而且解决Ficoll分离PBMC混有大量血小板和红细胞的问题。为提高器官移植T和B淋巴细胞流式交叉配型的实验结果质量提供了一种新方法,具有重要的推广价值。
1 郝素珍, 王桂琴. 实用医学免疫学[M] .北京:高等教育出版社,2005:178
2 罗利琼, 陈诚华, 张军. 长期培养外周血单个核细胞的简易分离纯化方法[J]. 新乡医学院学报, 2013, 30(4):249-250.
3 Andy Kokaji, C Sun, G MacDonald, et al. Human regulatory T cell isolation in 55 minutes using EasySep™ Releasable RapidSpheres™(TECH2P.912)[J]. The Journal of Immunology, 2015, 194:206.22
4 蔡敏敏, 顾晓琼, 高飞, 等. 分离外周血单个核细胞的条件优化[J]. 国际检验医学杂志, 2016, 1(37):1-5.
5 周文玲, 郝一文. 三种不同型号的血细胞分离机在采集外周血单个核细胞中的应用分析[J]. 中国实验血液学杂志, 2014, 22(10):1103-1108.
A new approach of rapidly isolating lymphocytes from whole blood with immune magnetic beads for organ transplant flow cytometry cross-matching
Guo Jing1,2, Luo Qizhi1, Tian Fang1,Guo Xuli1, Luo Weiguang1, Zou Yizhou1.
1Department of Immunology, School of Basic Medical Science, Xiangya School of Medicine, Central South University, Changsha 410008, China;2Department of Immunology, School of Medicine, Ji Shou University, Jishou 416000, China
Zou Yizhou, Email: zouyizhou@hotmail.com
ObjectiveTo compare immunomagnetic bead and density gradient centrifugation(Ficoll)for the separation of peripheral blood mononuclear cells(PBMC)in flow crossmatching. Method Hemocytometer was used to count and compare the numbers of WBC,PLT, RBC isolated. For quality and quantity analysis of isolated T, B and NK cells in PBMC, flow cytometry was used to detect lymphocyte surface markers by specific fluorescent antibodies. Thedonor PBMC was used to detect antibodies in the recipient serum. Anti-human CD3-PE and antihuman CD19-APC monoclonal antibody were used for identification of T and B cells. Statistical analysis was performed using variance analysis and t test.ResultThe number of PBMC Macs separation is 0.42 times the Ficoll separation of PBMC, but the proportion of lymphocytes(99.2±0.08)%higher than that of PBMC isolated lymphocyte ratio(82.5 ± 5.27)%(t = 9.91, P < 0.01),and two methods of separating PBMC RBC respectively(0.001 ± 0.001)× 106/μl and(0.02 ± 0.009)×106/μl(t = 6.64, P < 0.001); the number of platelets were(1.00 ± 0.05)× 103/μl and(196.00 ± 4.21)×103/μl had statistical significance difference(t = 146.46, P < 0.01). Flow cytometry showed that CD3+T cells in PBMCs isolated from immunomagnetic beads were(8.41 ± 0.87)%, CD3-CD56+NK cell(9.35 ± 0.67)% and(2.47 ± 0.07)% of CD3+CD56+NKT cells. Ficoll isolated PBMCs contain(37.36 ± 3.27)% CD3+T cells,(5.79 ± 0.94)% CD19+B cells and(6.60 ± 0.91)% CD56+NK cells, and the differences were statistically significant(t = 24.64, 6.470, 7.70, 51.31, P < 0.01). In the cross matching test of T and B lymphocytes, quantitative read T and B lymphocytes and the serum antibody binding were tested. As density gradient centrifugation in lymphocyte mixed with platelets,so the flow cytometry results will be mixed with false negative, but the immune magnetic beads separation does not appear false negative results. It is proved that immunomagnetic separation PBMC can be used in clinical cross matching test.ConclusionPBMC isolated with immunomagnetic bead could yielded 99% pure lymophictes from whole blood with less contamination of RBC and platelets and may be used for T & B cell crossmatching in organ transplantation
Peripheral blood; Monocytes; Centrifugation, density gradient;Immunomagnetic bead separation; Histocompatibility testing
2016-05-23)
(本文编辑:陈媛媛)
10.3877/cma.j.issn.2095-1221.2017.03.005
国家自然科学基金面上项目(81571562)
410008 长沙,中南大学湘雅医学院免疫学系1;416000 吉首,湖南省吉首大学医学院微生物与免疫学教研室2
邹义洲,Email:zouyizhou@hotmail.com
郭靖,罗奇志,田芳,等.免疫磁珠分离淋巴细胞在流式交叉配型试验中的应用及研究[J/CD].中华细胞与干细胞杂志(电子版),2017,7(3):146-151.

