自体干细胞对常规血运重建失败的重度肢体缺血患者的疗效观察
方圆董智慧魏征符伟国潘天岳顾史洋陈斌郭大乔徐欣刘澎蒋俊豪杨珏
自体干细胞对常规血运重建失败的重度肢体缺血患者的疗效观察
方圆1董智慧1魏征2符伟国1潘天岳1顾史洋2陈斌1郭大乔1徐欣1刘澎2蒋俊豪1杨珏1
目的回顾性分析自体干细胞移植治疗常规血运重建失败的重度肢体缺血患者的有效性。方法收集2009年5月至2015年12月复旦大学附属中山医院血管外科14例卢瑟福4 ~ 5级肢体缺血患者,术前均曾接受常规血运重建治疗,包括人工血管旁路术、动脉支架植入术等,中位年龄(48±15)岁,术后缺血无显著改善,或短期内复发。接受GCSF动员5 d后,进行外周血单个核细胞采集,获得移植物后,肌肉注射于缺血肢体。接受纯化CD34+细胞移植治疗共计11例,外周血单个核细胞移植治疗共计3例。术后12个月保肢率使用Kaplan-Meier生存分析法分析,治疗前后疼痛评分、无痛步行时间差异比较采用配对t检验。结果14例均获随访,平均(42±25)个月(12 ~ 74个月),1例死亡,2例截肢,死亡及截肢患者均为老年下肢动脉硬化闭塞症患者。术后2年总体生存率92.86%(13/14),无截肢生存率78.57%(11/14)。术前平均无痛步行时间(3±2)min,术后 6 个月(12±8)min,较术前显著改善(P < 0.05,F = 14.95)。术前平均Wong-Baker疼痛评分为7±1,平均静息痛缓解起始时间为术后(3±1)周,术后6个月疼痛评分为1±1,较术前显著改善(P < 0.05,F = 18.00)。结论自体干细胞移植治疗常规血运重建失败的重度肢体缺血患者安全有效。
外周血管疾病; 缺血; 干细胞移植; 移植,自体
随着生活水平的提高,人口老龄化,糖尿病、高血压、高脂血症等疾病的频发,重度肢体缺血(criticallimbischemia,CLI)发病率呈明显升高趋势,手术重建血流是保肢的重要方法,目前主流方法包括腔内治疗和旁路手术,但部分患者因全身情况差、远端流出道差,病因学等因素不适合,中远期疗效差,6个月截肢率和死亡率分别高达40%和20%[1-2]。自体干细胞移植作为一种新兴的血管再生技术,为这部分患者提供了一种新的治疗方式[3]。复旦大学附属中山医院血管外科自2009年5月起开展自体干细胞移植治疗CLI以来[4-5],共收治了14例经常规血运重建治疗后无效的CLI患者,现对这部分患者的中期疗效作回顾性分析。
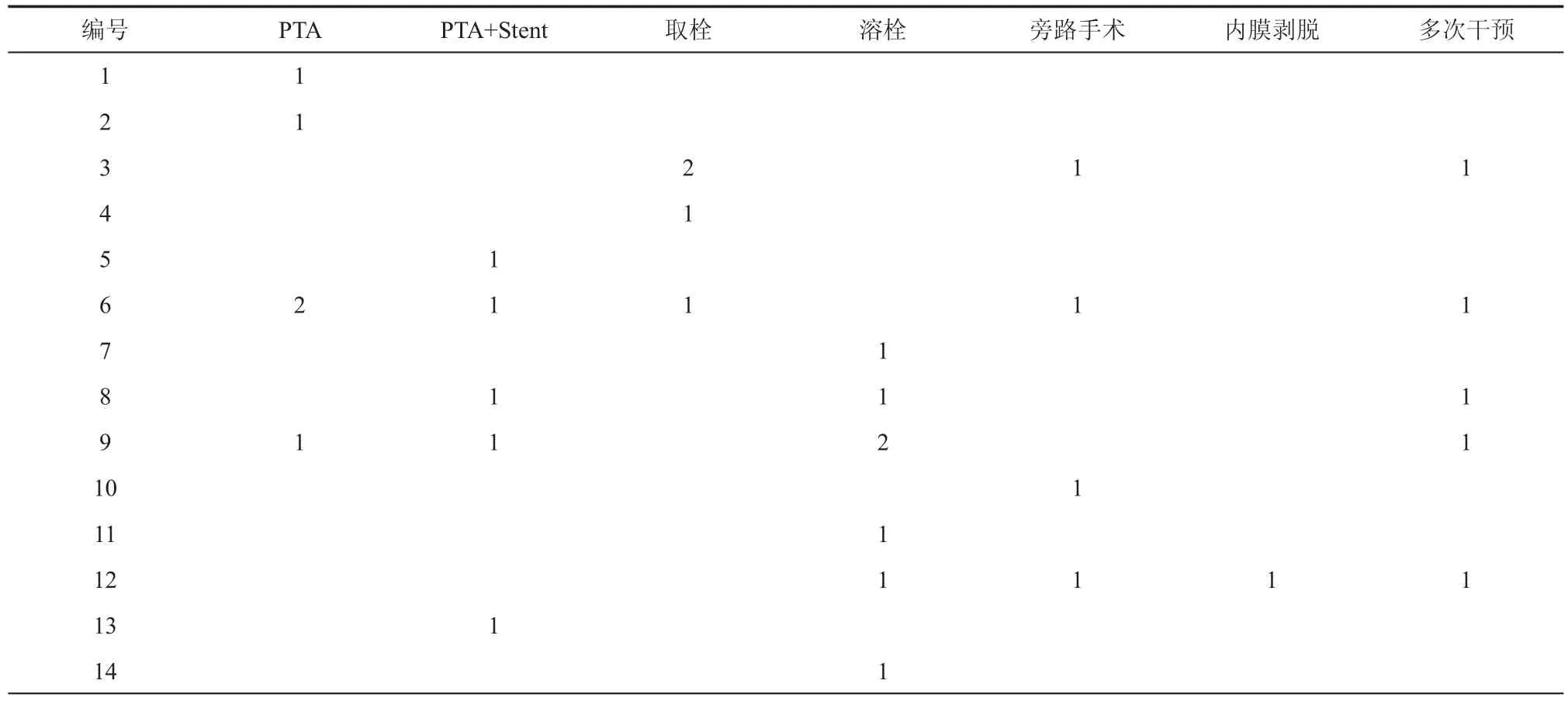
表1 14例患者血运重建治疗史
资料与方法
一、一般资料
2009年5月至2015年12月共收治14例经常规血运重建治疗后无效的CLI患者,均为男性,中位年龄(48±15)岁。其中血栓闭塞性脉管炎(thromboangiitisobliterans,TAO)9例,下肢动脉硬化闭塞症(atherosclerosis obliterans,ASO)3例,各种原因引起的动脉炎2例。所有患者术前均戒烟,并接受常规抗血小板、改善微循环药物治疗大于6个月。
14例患者除9号患者外,所有患者均有吸烟史,3例ASO患者均为老年男性,均合并高血压,1例合并高脂血症、冠状动脉搭桥术后,1例曾有脑梗史。所有14例患者均有腔内或开放手术治疗史,术后症状均无明显缓解或缓解后复发,甚至加重。14例患者治疗史如表1所示。
其中6号患者曾经接受4次常规血运重建治疗,每次均获得缓解,但每次症状最终都会复发(表 2)。
14例患者中溃疡6例,坏疽5例,单纯静息痛3例。初次血运重建术前Rutherford分级:3级4例,4级3例,5级7例。其中7例患者术后缺血症状得到改善,其中疗效维持大于1年的仅2例,剩余5例均于术后1年内症状复发;另外7例患者治疗后缺血症状无明显改善或加重。干细胞治疗前Rutherford分级:4级3例,5级11例。其中9例较初次治疗前无改善,5例加重。
二、治疗方案
具体方案既往已述[3-4],概述如下:
1.人重组粒细胞集落刺激因子(granulocyte colony stimulatingfactor,G-CSF)动员 5 d,每天注射低分子肝素,监测外周血白细胞计数;第5天进行血浆分离(血浆分离机,德国Fresenius Hemocare公司),采集单个核细胞,采集物体积在200 ~ 300 ml,行白细胞计数与淋巴细胞分类,流式细胞仪检测CD34+细胞纯度;PBS缓冲液洗涤,调整体积至100 ~150 ml,得到外周血单个核细胞移植物。
2.加入CD34磁珠抗体(德国,MiltenyiBiotec GMBH公 司),应 用 CliniMACS分 选 仪(德 国,MiltenyiBiotec GMBH公司)完成CD34+细胞纯化分选,获得纯化移植物,体积约45 ml,其中40 ml用于细胞移植,其余进行细胞计数与分类,台盼蓝染色检测细胞活力,流式细胞仪检测CD34+细胞纯度。
3.采用非纯化方法进行自体干细胞移植的患者,使用第一步所得到的产物进行移植,采用纯化方法的患者,使用第二步得到的产物进行移植。
4.移植物分点肌肉注射,移植细胞总数1×105~1×106个/kg。
5.对伴有明显感染的溃疡、坏疽,移植术中1期清创和或截趾,若为干性坏疽,无伴发感染则留待2期处理;术后长期口服西洛他唑和拜阿司匹林。
三、质量控制指标
1.动员期间,每日行血常规及CD34+细胞计数,随访白细胞及CD34+细胞上升趋势。
2.血浆分离采集产物,行血常规及CD34+细胞计数,以评估CD34+细胞数量是否足以完成移植并达到1×105~ 1×106/kg的剂量范围。
3.对分选纯化产物进行血常规及CD34+细胞计数,以确认CD34+细胞剂量是否达标。
四、随访及观测指标
所有患者术后第1个月内每周电话随访,记录静息痛缓解起始时间。术后第 1、2、3、6、9、12 个月时随访1次,之后每年随访1次。内容包括:Wong-Baker FACES疼痛评分、无痛步行时间、溃疡及坏疽愈合情况、眼底照相检查。
五、统计学分析方法
采用SPSS 22进行统计分析。术后12个月保肢率使用Kaplan-Meier生存分析法分析,疼痛评分、无痛步行时间以表示,治疗前后不同时间差异采用方差分析检验,以P < 0.05为差异有统计学意义。
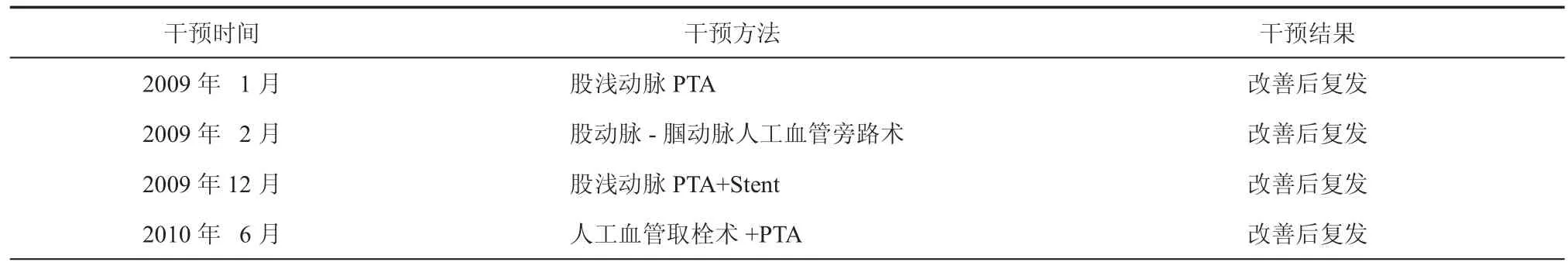
表2 6号患者接受干细胞移植前血运重建治疗经过
结 果
一、质量控制
所有患者动员5 d后,白细胞计数均> 40×109/L,CD34+细胞移植剂量均控制在 1×105~ 1×106/kg范围内。
二、不良反应
动员期间,除恶心、腰痛、低热等表现外,未观察到严重不良反应,且均于停止动员2 d内恢复。行血浆分离采集时,8例患者出现口唇手脚发麻,予以口服1 ~ 2 g葡萄糖酸钙后即获缓解。围手术期无死亡病例。14例患者均未发现眼底血管病理性增生。
三、随访结果
共计治疗14条肢体,14例患者均完成随访,平均随访时间(42±25)个月(12 ~ 74 个月),无失访病例,术后1年无死亡,术后2年死亡1例,术后2年总体生存率92.86%(13/14)。
使用Wong-Baker FACES疼痛评分量表对患者术前静息痛程度进行评估,14例患者干细胞移植术前术后平均疼痛评分,术后6个月及术后1年较术前改善均明显(P < 0.05,表 3)。
使用运动平板,以2.5 km/h、10%坡度对患者术前平均无痛步行时间进行评估,14例患者干细胞移植术前术后平均无痛步行时间,术后6个月及术后 1年较术前改善均明显(P < 0.05,表 3)。
术前共计6例患者合并溃疡,均于术后1年内全部愈合。术前合并坏疽患者共计5例,其中1例术后自行脱落,3例予以1期清创截趾,术后创面均愈合良好。10号患者坏疽愈合情况如图1所示。1例术后静息痛缓解不显著,坏疽无愈合趋势,患者无法耐受,于术后1个月行膝下截肢术。另有1例ASO患者术前单纯静息痛,因术后疼痛改善轻微,于术后3个月行膝上截肢术。14例患者术后1年共计2例截肢,使用Kaplan-Meier生存分析评估术后1年保肢率为86%(12/14),术后2年无截肢生存率78.57%(11/14)。
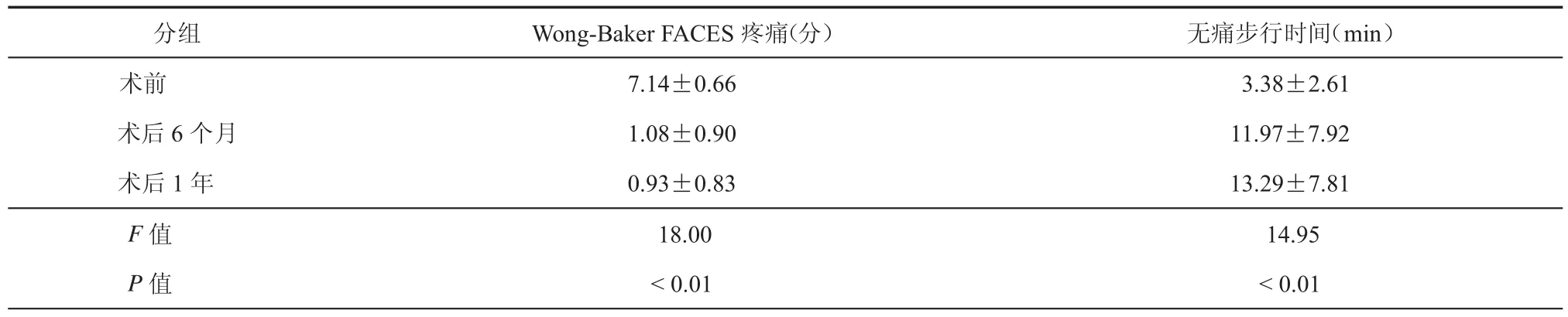
表3 14例重度肢体缺血患者手术前后Wong-Baker FACES疼痛评分及无痛步行时间比较
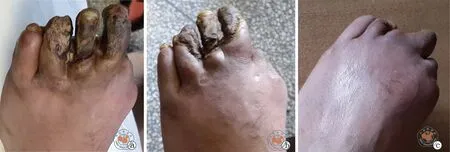
图1 10号患者自体干细胞移植术前后患足照片
讨 论
血管腔内治疗或旁路手术,是当下针对CLI血运重建治疗的主流模式,但其对患者本身一般情况能否耐受手术创伤或血管解剖条件是否允许,具备相当的要求,并且在有条件接受治疗的患者中,中远期治疗效果并不理想[6]。而对于接受常规血运重建治疗仍无法缓解缺血症状或术后短时间内缓解,中远期缺血症状再次出现的患者,即便有条件再次接受常规血运重建治疗,中远期治疗效果仍然不佳。本研究收录的14例患者中,均曾接受常规血运重建治疗,但部分患者术后疗效不明显,或仅获得术后短期内缓解。更有5例患者,曾反复多次接受常规血运重建,均未获得理想疗效。针对这一部分患者,缺乏一种中远期安全有效的血运重建方法,因此其预后极不理想,该部分患者截肢率高达40%,6个月内死亡率高达20%[7]。
干细胞疗法,作为一种新型血运重建方式,为这部分患者带来了希望,提供了治疗的可能性。Tateishi-Yuyama等[8]在2002年首次报道了使用自体外周血单个核细胞或骨髓单个核细胞移植治疗CLI的前瞻性随机对照研究,取得了令人满意的疗效,大部分患者静息痛得到缓解,溃疡愈合,并成功保肢。在此项里程碑式的研究之后,国内外治疗性血管再生疗法治疗CLI的研究不断涌现,外周血或骨髓单个核细胞移植治疗CLI的安全性和有效性得到了不断验证[9-12]。作为治疗性血管再生疗法的核心,移植物中内皮祖细胞的含量,是决定疗效的关键。CD34是一种造血干细胞、内皮祖细胞和内皮细胞的共同表面分子,通过使用CD34免疫磁珠纯化,可获得高纯度的上述3种细胞的混合物,而造血干细胞在缺血环境下又可分化为内皮祖细胞并发挥血管再生作用[13-14],因此纯化CD34+细胞移植治疗CLI,同样安全有效[15]。
为分析干细胞移植对常规血运重建治疗失败患者的疗效,本研究使用外周血单个核细胞移植,或纯化CD34+细胞移植的方法,对14例常规血运重建失败的CLI患者进行了治疗,大多数患者缺血症状明显改善,静息痛缓解,成功保肢,无痛步行时间明显延长,不仅获得了理想的预后,且生活质量亦有所提高。除2例老年ASO患者静息痛改善不明显外,其余12例患者静息痛均较术前改善显著并维持至术后1年。在无痛步行时间方面,疗效亦较为明确,个别患者术前无法步行,而术后所有14例患者均得到显著改善。术前所有合并溃疡的患者术后均愈合,术前合并坏疽患者也仅有一例未愈。缺血症状的显著改善,使得保肢率大大提高,如此显著的疗效,对于曾反复多次接受常规血运重建治疗失败的患者来说,显得更有价值。
然而研究同时发现,本研究中3例老年ASO患者,其中2例结局不良。6号患者单纯静息痛,7号患者静息痛合并坏疽,接受干细胞移植术后症状缓解不明显,并分别于术后3个月和1个月截肢。由此可见,干细胞移植对老年ASO患者的疗效,相比TAO患者较差。类似的,国外有研究曾报道了单个核细胞移植治疗TAO和ASO的疗效,有效率分别80%和50%[9-10,16]。究其原因,第一,引起内皮功能异常的高危因素,如高龄、高血压、糖尿病和高脂血症,在老年ASO人群中更为常见;第二,高龄患者血浆中促血管生长因子含量下降较为明显[7,17-19]。
综上所述,自体干细胞移植可为常规血运重建无效的CLI患者提供有效治疗,且疗效较持久,成功挽救肢体,改善生活质量,为临床治疗这部分棘手患者,提供了新的选择和可能。
1 Fadini GP, Agostini C, Avogaro A. Autologous stem cell therapy for peripheral arterial disease meta-analysis and systematic review of the literature[J]. Atherosclerosis, 2010, 209(1):10-17.
2 Hankey GJ, Norman PE, Eikelboom JW. Medical treatment of peripheral arterial disease[J]. JAMA, 2006, 295(5):547-553.
3 黄蓉, 梁瑜祯, 卢炳丰. 自体骨髓间充质干细胞移植促进缺血下肢血管新生的实验研究[J]. 医学研究生学报, 2015, 28(7):706-710.
4 Dong Z, Chen B, Fu W, et al. Transplantation of purified CD34+cells in the treatment of critical limb ischemia[J]. J VascSurg, 2013,58(2):404-411.e3.
5 董智慧, 魏征, 符伟国, 等. 纯化自体外周血CD34+细胞移植治疗下肢重度缺血[J]. 中华普通外科杂志, 2011, 26(3):184-187.
6 Norgren L, Hiatt WR, Dormandy JA, et al. Inter-society consensus for the management of peripheral arterial disease (TASC II)[J]. J Vasc Surg, 2007, 45 Suppl S:S5-67.
7 Carmeliet P, Ferreira V, Breier G, et al. Abnormal blood vessel development and lethality in embryos lacking a single VEGF allele[J].Nature, 1996, 380(6573):435-439.
8 Tateishi-Yuyama E, Matsubara H, Murohara T, et al. Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells: a pilot study and a randomised controlled trial[J]. Lancet, 2002, 360(9331):427-435.
9 Horie T, Onodera R, Akamastu M, et al. Long-term clinical outcomes for patients with lower limb ischemia implanted with G-CSF-mobilized autologous peripheral blood mononuclear cells[J]. Atherosclerosis,2010, 208(2):461-466.
10 Matoba S, Tatsumi T, Murohara T, et al. Long-term clinical outcome after intramuscular implantation of bone marrow mononuclear cells (Therapeutic Angiogenesis by Cell Transplantation [TACT]trial) in patients with chronic limb ischemia[J]. Am Heart J, 2008,156(5):1010-1018.
11 Losordo DW, Kibbe MR, Mendelsohn F, et al. A randomized,controlled pilot study of autologous CD34+cell therapy for critical limb ischemia[J]. CircCardiovascInterv, 2012, 5(6):821-830.
12 谷涌泉, 张建, 齐立行, 等. 自体骨髓干细胞移植治疗慢性下肢缺血94例不同病变分期患者的效果比较[J]. 中国临床康复, 2005,9(38):7-10.
13 Flamme I, Risau W. Induction of vasculogenesis and hematopoiesis in vitro[J]. Development, 1992, 116(2):435-439.
14 Kawamoto A, Asahara T. Role of progenitor endothelial cells in cardiovascular disease and upcoming therapies[J]. Catheter CardiovascInterv, 2007, 70(4):477-484.
15 Kawamoto A, Katayama M, Handa N, et al. Intramuscular transplantation of G-CSF-mobilized CD34(+) cells in patients with critical limb ischemia: a phase I/IIa, multicenter, single-blinded, doseescalation clinical trial[J]. Stem Cells, 2009, 27(11):2857-2864.
16 Saito Y, Sasaki K, Katsuda Y, et al. Effect of autologous bone-marrow cell transplantation on ischemic ulcer in patients with Buerger's disease[J]. Circ J, 2007, 71(8):1187-1192.
17 Ferrara N, Carver-Moore K, Chen H, et al. Heterozygous embryonic lethality induced by targeted inactivation of the VEGF gene[J]. Nature,1996, 380(6573):439-442.
18 Shalaby F, Rossant J, Yamaguchi TP, et al. Failure of blood-island formation and vasculogenesis in Flk-1-de fi cient mice[J]. Nature, 1995,376(6535):62-66.
19 Tepper OM, Galiano RD, Capla JM, et al. Human endothelial progenitor cells from type II diabetics exhibit impaired proliferation,adhesion, and incorporation into vascular structures[J]. Circulation,2002, 106(22):2781-2786.
Autologous stem cell transplantation in the treatment of critical limb ischemia after failure of conventional revascularization
Fang Yuan1, Dong Zhihui1, Wei Zheng2, Fu Weiguo1, Pan Tianyue1,Gu Shiyang2, Chen Bin1, Guo Daqiao1, Xu Xin1, Liu Peng2, Jiang Junhao1, Yang Jue1.
1Department of Vascular Surgery,2Department of Hematology, Zhongshan Hospital, Fudan University, Shanghai 200032, China
Dong Zhihui, Email: dzh926@126.com
Peripheral vascular diseases; Ischemia; Stem cell transplantation;Transplantation, autologous
2016-09-17)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2017.03.003
复旦大学附属中山医院人才培养计划-优秀骨干计划(2015ZSYXGG02)
200032 上海,复旦大学附属中山医院血管外科1,血液科2
董智慧,Email:dzh926@126.com
【Abstrat】ObjectiveTo evaluate the efficacy of autologous stem cell transplantation in the treatment of critical limb ischemia after failure of conventional revascularization.MethodsFrom May 2009 to November 2015, 14 patients with critical limb ischemia were enrolled and all of them had undergone conventional revascularization, including bypass surgery and stenting. The average age was 48±15 years(range, 21 ~ 75). Conventional revascularization failed to improve ischemia in them. Apheresis was performed after 5-days' mobilization with GCSF to harvest stem cells. Stem cells were transplanted into the ischemic limb by intramuscular injection. Eleven patients were transplanted with purified CD34+cells and 3 patients with peripheral blood mononuclear cells.ResultsFollowup was accomplished in all 14 patients with an average follow-up time of(42±25)months(range 12 ~ 74). During the follow-up there were 1 death and 2 major amputations which all occurred in aged patients with atherosclerosis obliterans. The overall survival rate 2 years after transplantation is 92.86%(13/14)and the amputation free survival rate is 78.57%(11/14). The peak pain-freewalking time at 6 months was significantly improved from(3±2)minutes to(12±8)minutes(P < 0.05,F = 14.95)and the Wong-Baker FACES pain rating score decreased from(7±1)to(1±1)(P <0.05, F = 18.00).ConclusionsAutologous stem cell transplantation is safe and effective in treating critical limb ischemia after conventional revascularization failure.
方圆,董智慧,魏征,等.自体干细胞对常规血运重建失败的重度肢体缺血患者的疗效观察[J/CD].中华细胞与干细胞杂志(电子版),2017,7(3):136-140.

